血液蛋白分解菌的筛选及分离鉴定
2020-09-17蔡新东王致远欧珠次仁丁功涛张海霞
蔡新东 王致远 欧珠次仁 丁功涛 张海霞
血液蛋白分解菌的筛选及分离鉴定
蔡新东1王致远1欧珠次仁1丁功涛2张海霞2
(1.西北民族大学生命科学与工程学院甘肃兰州730124;2.西北民族大学生物医学研究中心甘肃兰州730030)
为了筛选得到能够降解血液蛋白的微生物菌株,以甘南屠宰场的土壤为材料,将样品稀释涂布于基础培养基和哥伦比亚血平板上,筛分出了一株可以降解血液蛋白的菌株,将其命名为NwMcc01910043。对该菌株进行形态学鉴定、生理生化鉴定、16SrDNA序列鉴定,并测定其蛋白酶活力。试验结果显示NwMcc01910043菌株为变形杆菌(),其蛋白酶活力为194.203U/mL。本试验筛选鉴定出一株血液蛋白分解菌NwMcc01910043,为屠宰场处理废弃血液蛋白提供了一定的理论基础。
血液蛋白分解菌;筛选;分离;鉴定
我国的畜禽养殖量居世界第一,每年都有大量的畜禽被宰杀。据国家统计局数据可知,2019年,我国的生猪的出栏量超过6.8亿头,占世界总产量近50 %;各类家禽出栏量超过130 亿羽;牛出栏量超过5500 万头,羊出栏量超过2亿头[1]。畜禽血液是畜禽屠宰加工的主要副产物,我国每年畜禽屠宰所产生的血液总量可超过800 万吨,这些血液中含有丰富的蛋白质[2]。长期以来,由于屠宰分散、技术落后、血液有较重的血腥味、适口性差、易变质不易保存等原因,只有少量畜禽血液被加工成食品,供人们食用,大量血液遭到丢弃[3]。这不仅浪费了资源,还污染了环境,不符合可持续发展理念。随着现代生物技术的迅速发展,曾经制约着血液利用的不利因素正在被解决[4]。采用微生物发酵法处理畜禽血液成本低,可以除去多种抗营养因子,还能生成利于消化吸收的代谢产物和益生菌,提高营养成分的利用率,是公认的解决动物废弃血液污染的一个方向[5,6]。本试验以甘南合作市舟曲县屠宰场的土壤为材料,筛选出一株血液蛋白分解菌NwMcc01910043 ,并鉴定该菌株和测定其蛋白酶活力,为屠宰场处理废弃血液提供了一定的理论基础。
1 材料和方法
1.1 材料
1.1.1 试验样品
样品采集于甘南合作市舟曲县屠宰场淤泥,地址为313 省道南100 米,坐标(104.398644 ,33.770136 )。
1.1.2 试剂
哥伦比亚血平板(广东环凯微生物科技有限公司),酵母提取粉(OXOID),牛肉膏(青岛海博),蛋白胨(青岛海博),琼脂粉(青岛海博),干酪素(阿拉丁工业公司),氯化钠(分析纯,天津市大茂化学试剂厂),氢氧化钠(分析纯,天津市大茂化学试剂厂),革兰染色试剂(博精索拉博科技有限公司),细菌生化鉴定管(杭州微生物试剂有限公司),福林酚试剂(分析纯,博精索拉博科技有限公司),三氯乙酸(分析纯,博精索拉博科技有限公司)。
1.1.3 培养基
LB培养基:氯化钠10 g/L,蛋白胨10 g/L,酵母提取粉5 g/L;
基础培养基:牛肉膏5.0 g/L,蛋白胨10.0g/L,氯化钠5.0 g/L,琼脂15 g/L,血清30 g/L;
1.2 方法
1.2.1 样品采集及菌株的筛选
用无菌离心管收集屠宰场淤泥土壤,带回实验室,取出适量的样品,用无菌水进行10-4~10-6梯度稀释,将适量的土壤悬液涂布于基础培养基平板,37 ℃、120 r/min振荡培养48 h,挑取透明水解圈最大的菌落进行复筛。
1.2.2 菌株的复筛
将初筛获得的具有透明圈的菌株,挑取单菌落接种到LB液体培养基中进行扩繁,在37 ℃下、120 r/min振荡培养24 h。培养结束后,将菌种以2 %的接种量接种到哥伦比亚血平板上进行培养,观察后期生长的透明圈,透明圈直径越大,产酶量越多且酶活力越高[7,8]。
1.2.3 形态学鉴定
将复筛获得的菌株划线接种于哥伦比亚血平板上,37 ℃下,在培养箱中培养48 h,观察菌落的形状、大小、颜色、边缘、隆起、透明度等[9]。
1.2.4 革兰氏染色鉴定
将分离得到的菌株划线接种于血平板上,37 ℃下,在培养箱中培养48 h,挑取单个菌落进行革兰氏染色,染色后镜检,观察菌体细胞的形状、大小及染色结果[10]。
1.2.5 生化反应试验鉴定
对斜面活化后的菌株进行生理生化反应,主要从菌株对碳源利用、硝酸还原、淀粉水解、纤维素利用、明胶是否液化、硫化氢产生等方面来进行分析[11],根据分析所得到的结果,对照《常见细菌系统鉴定手册》来进行属种鉴定[12]。
1.2.6 16 SrDNA序列鉴定
制备PCR反应模板DNA:取1 mL菌液放于1.5 mL离心管中,12 000 g离心2min,弃去上清液,沉淀中加入500 μL的无菌水制成菌悬液,将菌悬液99 ℃加热10 min,-70 ℃冷击20 min,循环3次,循环结束的菌液12000 g离心5min,取其上清液作为PCR扩增的模板[13]。16 SrDNA的通用引物为27 F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492 R(5'-GGTTACCTTGTTACGACTT-3')。PCR反应体系为25 μL,其中2×Mix12.5 μL,F引物2 μL,R引物2 μL,无菌去离子水7 μL,模板1.5 μL,将各组分按以上顺序依次加入PCR反应管中,混匀后用PCR扩增仪进行扩增[14]。PCR产物进行琼脂糖凝胶电泳检测,电泳结束后,取出凝胶,在紫外线成像仪下观察PCR产物在胶块中的位置,参照DNAMarker确定各产物的分子大小。将正确扩增得到的PCR产物送到北京擎科生物技术有限公司进行DNA测序。将测序的结果序列输入到NCBI网站进行NucleotideBLAST,然后使用MEGA7.0软件构建系统发育树。
1.2.7 蛋白酶活力测定
粗酶液的制备:将单菌落接入LB培养基进行活化,于32 ℃的立式恒温振荡器中以180 r/min的转速培养12 h。活化结束后,取2 mL菌液于离心机中以10 000 r/min的速度离心10 min,得到的上清液即为粗酶液。蛋白酶活力的测定:采用GB/T23527—2009 《蛋白酶制剂》法[15]。将1 mL粗酶液与1 mL底物(酪蛋白溶液)混合均匀,于40 ℃反应10 min后加入2 mL的三氯乙酸来终止反应,以12000 r/min的速度离心3 min。在1 mL上清液中加入5mLNa2CO3溶液以及1 mLFolin-酚试剂,混合均匀后于40 ℃保温20 min,使用紫外-可见光分光光度计,在波长680 nm处测定OD值。同时进行空白试验,离心管中先后注入粗酶液1 mL、三氯乙酸2 mL、20 g/L酪蛋白溶液1 mL。15 min后离心分离,以下操作均与试样测定相同。蛋白酶活力的定义:在40 ℃,pH 7.5的条件下,每分钟水解酪蛋白以产生1μg酪氨酸所需的酶量被定义为一种蛋白酶活性单位,按下式计算酶活力值[16]:
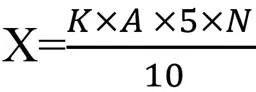
式中,X:样品的蛋白酶活力;K:OD值为1时相当的酪氨酸质量(μg);
A:样品得OD值与空白的OD值之差;N:样品的稀释倍数;5:测定中吸取了全部滤液的1/5;10 :整个过程反应了10 min,以1min计。
2 结果与分析
2.1 菌株的筛选
将从屠宰场废弃血液存放地收集得到的土壤,稀释涂布于基础培养基,结果如图1所示,产生透明水解圈;将初筛获得的具有透明圈的菌株,经分离纯化后挑取单个菌落接种到哥伦比亚血平板上进行培养,结果如图2所示,也产生透明水解圈。

图1 NwMcc01910043 菌株在基础培养基上的生长状况

图2 NwMcc01910043 菌株在哥伦比亚血平板上的生长状况
2.2 革兰氏染色及形态学鉴定
将筛选得到的菌种划线接种于血平板上,然后将平板放在 37 ℃的恒温培养箱中培养24 h,培养后的菌落形态为不规则、黏稠、湿润、白色,直径为2.8 mm,透明水解圈的大小约6 mm。经革兰氏染色后,在显微镜下观察到,分离得到的菌株为杆状菌,菌体细胞呈蓝紫色,初步鉴定为革兰氏阳性菌(图3)。

图3 NwMcc01910043 菌株革兰氏染色结果
2.3 生化反应试验
分离菌株生化反应特性鉴定结果(表1)显示,NwMcc01910043 菌株分解葡萄糖、尿素、DNA酶、枸橘酸盐、蔗糖、硫化氢、鸟氨酸、赖氨酸。不分解蛋白胨水、乳糖、麦芽糖、卫茅醇、甘露醇、木棉糖、还原硝酸盐、苯丙氨酸。根据NwMCC01910043 的菌落形态、生理生化反应以及革兰氏染色结果,按《常见细菌系统鉴定手册》进行初步分类,NwMCC01910043 菌株为变形杆菌。

表1 NwMCC01910043 菌株生化反应试验结果
注:“+”表示生化反应结果为阳性;“-”表示生化反应结果为阴性。
2.4 16 SrDNA序列鉴定
2.4.1 琼脂糖凝胶电泳
电泳结果(图4)显示出NwMCC01910043 菌株的16 SrDNA序列PCR扩增产物条带约为1500 bp。
2.4.2 菌株的16 SrDNA序列分析
将测序得到的16 SrDNA序列进入NCBI网站,与现存关系较近的序列进行NucleotideBLAST。其结果表明NwMcc01910043 菌株与变形杆菌亲源关系最近,与其同源性高达99.69 %。将NwMcc0191004 菌株的16 SrDNA的核酸序列和BLAST结果中的17 个序列用比对软件MEGA7.0进行多重比对,然后绘制系统发育树(图5)。

图4 PCR产物的琼脂糖凝胶电泳结果

图5 基16 SrDNA基因序列建立的NwMCC01910043 菌株系统进化树
2.5 蛋白酶活力的测定
由酪氨酸标准曲线(图6)所得的方程式计算得出K值为99.38,将K值代入酶活测定公式可得:NwMCC01910042 菌株粗酶液的蛋白酶活力为194.203 U/mL。

图6 酪氨酸标准曲线
3 讨论
畜禽血液制成的饲料存在“三差”问题,即氨基酸组成平衡差、可消化性差、适口性差[17]。通过微生物发酵可以降解大分子血液蛋白,使其水解成为利于动物吸收的小肽和氨基酸。与游离氨基酸或全蛋白相比,动物对二肽和三肽形式的蛋白质吸收效率更高,并且二肽和三肽形式的蛋白质可能会改善饮食成分的吸收[18,19]。WangLiang等[20]通过紫外线(UV)诱导枯草芽孢杆菌CICC10265,并优化了降解条件。在温度为33.8 ℃,降解时间为69.36 h,pH值为7.0,接种量为7.2×107CFU/mL,转速为250r/min的条件下,血粉水解度为62.18 %。LiDeng-long等[21]选择十二烷基吡喃葡萄糖苷作为表面活性剂,看表面活性剂对黑曲霉发酵鸡血有何影响,结果显示在发酵过程的第48 h以6.0 g/L的浓度添加十二烷基吡喃葡萄糖苷,检测到104.5 mg·N/mL的氨基氮,638.3 mg·N/mL的非蛋白质氮和766.3 mg·N/mL的可溶性氮,与对照组相比,分别增加了约0.7、3.7和3.8倍。YaoDawei等[22]通过屠宰场的污泥样品中分离出一株短小芽孢杆菌NJM4。在初始pH值为8.67,接种量为4 %,温度为37°C,搅拌速度为200 rpm的条件下,短小芽孢杆菌NJM4可以在36 h内将血红蛋白降解达85 %。俞炜洋等[23]研究发现,猪血发酵后粗蛋白质降解剂量、氨基酸含量显著提高,并有部分蛋白质降解成为小肽。陈宇等[24]采用复合菌株对猪血进行发酵,发酵产品血腥味很淡,营养丰富,蛋白质含量达到了69 %,还含有多种游离氨基酸和微量元素。张滨等[25]采用多菌种发酵血液产品,得到的产物中可溶性蛋白含量达到20 %以上,还有浓郁的香气。因此,通过微生物发酵血液生产利于动物吸收的小肽和氨基酸饲料,是目前解决动物废弃血液污染的一个方向,该研究筛选出的菌株为动物副产品的开发和利用提供一定的参考。
[1]方俊,卢向阳,马美湖,等.利用微生物发酵猪血粉研究现状[J].食品与发酵工业,2004(9):93-95.
[2]汪正熙,王卫,张旭,等.畜禽血精深加工利用及其研究进展[J].农产品加工,2020(6):67-71.
[3]杨葆春,靳义超,李全,等.动物血液资源的开发利用研究进展[J].青海畜牧兽医杂志,2011,41(5):44-46.
[4]郭秀云,张开臣,孟庆丰,等.饲用血粉加工工艺及其产品质量研究进展[J].中国家禽,2019,41(19):50-54.
[5]杜昕,李诚,肖岚,等.酶解牦牛血发酵液制备抗氧化肽工艺优化[J].核农学报,2017,31(2):325-333.
[6]鲁云风,杨柯金,杨建伟,等.牛血发酵菌株发酵条件的正交设计优化研究[J].饲料广角,2010(14):27-28,38.
[7]康晓彤.羊肚菌菌种的分离与纯化和形态鉴定[J].中国食用菌,2018,37(6):85-87.
[8]张韵,赵丽娜,曹琳,等.益生凝结芽孢杆菌的筛选及生物学特性研究[J].中国畜牧杂志,2017,53(1):109-114.
[9]胡广卫,沈艳丽,赵全邦,等.青海部分地区蜱的形态学鉴定[J].今日畜牧兽医,2018,34(6):10-11.
[10]李彦华.革兰氏染色原理[J].辽宁工程技术大学学报,2006(S2):335-336.
[11]刘波,陶天申,葛慈斌,等.芽胞杆菌(第1卷):中国芽胞杆菌研究进展[M].北京:科学出版社,2015:34-69.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:348-392.
[13]段德勇,汪雅琴,程天印.绵羊虱蝇形态学与分子生物学鉴定[J].畜牧兽医学报,2017,48(11):2181-2188.
[14]周雪雁,米玛普尺,马咸莹,马忠仁,丁功涛.1株血红蛋白分解菌的分离鉴定及其蛋白酶活力测定[J].微生物学杂志,2020,40(02):66-71.
[15]柏晓辉,李长军,肖玉芸,等.木瓜果醋产品中木瓜蛋白酶活性维持研究[J].黄山学院学报,2018,20(03):56-59.
[16]沈萍,陈向东.微生物学实验指导[M].北京:高等教育出版社,2018:43-47.
[17]郑召君,张日俊.畜禽血液的开发与研究进展[J].饲料工业,2014,35(17):65-70.
[18]Alfonso Clemente. Enzymatic protein hydrolysates in human nutrition[J].Trends in Food ence & Technology,2000,11(7):254-262.
[19]Siemensma,AndréD,WeijerWJ,BakHJ.Theimportanceofpeptidelengthsinhypoallergenicinfantformulae[J]. TrendsinFoodence & Technology,1993,4(1):16-21.
[20]Wang L,Zhang B,Han J,et al.Optimization of hydrolysis condition of blood meal by Bacillus subtilis with response surface methodology[J]. International Biodeterioration & Biodegradation,2015,104:112-117.
[21]Li D L,Wu B,Zhang X,et al.Enhancing hemoglobin peptide production from chicken blood fermentation by food-grade non-ionic surfactant[J]. Biotechnology and Applied Biochemistry,2019,66(5).
[22]Yao D,Qu J,Chang P,et al.Production and characterization of alkaline protease from hemoglobin-degrading Bacillus pumilus NJM4 to produce fermented blood meal[J]. Journal of Food Science and Technology -Mysore-,2012,49(5):626-631.
[23]俞炜洋.厌氧固态法发酵猪血蛋白的研究[D].华侨大学,2012.
[24]陈宇,付祖姣,莫湘涛,等.发酵血粉菌株的优化选育[J].食品与发酵工业,2003(5):32-36.
[25]张滨,马美湖.猪血发酵饲料加工工艺研究[J].粮食与饲料工业,2005(10):28-31.
Screening, Separation and Identification of Blood Protein Degrading Bacteria
Cai Xindong1,Wang Zhiyuan1,Ouzhu Ciren1,Ding Gongtao2,Zhang Haixia2
(1.College of Life Science and Engineering,Northwest Minzu University,Lanzhou,Gansu 730124;2. Biomedical Research Center,Northwest Minzu University,Lanzhou,Gansu 730030)
In order to screen out microbial strains capable of degrading blood proteins, the soil of Gannan slaughterhouse was used as a material, and the samples that were able to degrade blood proteins were screened out by diluting the samples on the basal medium and Columbia blood plate, the strain was named NwMcc01910043. The strain was tested for morphology, biochemical reaction, 16S rDNA sequence identification and its protease activity was determined. The test results showed that the NwMcc01910043 strain wasand its protease activity was 194.203U/mL. This experiment screened and identified a strain of blood protein decomposing bacteria NwMcc01910043, which provided a certain theoretical basis for the disposal of waste blood proteins in the slaughterhouse.
Blood protein degrading bacteria;Screening;Isolation;dentification
S476
A
2095-1205(2020)05-83-04
10.3969/j.issn.2095-1205.2020.05.41
“科技助力经济2020”重点专项(SQ2020YFF0405583);西北民族大学“双一流”引导专项生物工程特色学科(10018703,1001070204);西北民族大学中央高校基本科研业务费资金项目(31920190085);教育部“创新团队发展计划”项目(IRT_17R88);西北民族大学2020年国家级大学生创新创业训练计划项目(202010742106)
蔡新东(1998- ),男,汉族,河南南阳人,在读本科生,生物技术专业。
张海霞