一株甲基营养型芽孢杆菌抑菌活性物质鉴定
2020-09-17王蕊胡辉帆陈文兰张强刘变芳
王蕊,胡辉帆,陈文兰,张强,刘变芳
(西北农林科技大学 食品科学与工程学院,陕西 咸阳 712100)
真菌感染是导致农业生产过程中农作物减产和食品质量安全问题的主要原因之一,每年由于真菌污染造成的食物损失接近30%[1]。真菌在自然界中分布广、数量多,常见于食品及其原料中的污染真菌有疫霉属、核盘菌属、曲霉属、青霉属、镰刀菌属等[2-4]。一些真菌分泌产生的毒素会引起急慢性食物中毒,食品中真菌及真菌毒素的污染已成为一个重要的公共卫生问题[5]。在农作物和食品的生产加工过程中,更多以使用农药化肥、化学消毒剂、防腐剂为主要措施,但弊端日益显现,这些化学物质的残留不仅影响食品安全,也会造成环境污染,影响农业可持续发展[6]。
目前,通过植物源、动物源、微生物源有效活性成分抑制病原菌的生长与繁殖已经成为研究热点[7]。生物法有着高效、安全、无污染等特点,其中芽孢杆菌属易繁殖,对环境适应能力强,具有很大的开发研究价值。有研究报道[8-10],芽孢杆菌已广泛应用于豆豉、面包等发酵食品中,一方面可产生食品级的酶制剂,如淀粉酶、蛋白酶、豆豉纤溶酶、纳豆激酶;另一方面可代谢产生能用于食品加工与保鲜、农业生物防治等领域的脂肽类抑菌物质。满丽莉等[11]分离到一株枯草芽孢杆菌,研究发现其发酵液对青霉、金黄色葡萄球菌和大肠杆菌均有较强的抑制效果,具有开发为益生菌制剂的潜能。周涛等[12]从湖泥、土壤中分离筛选到具有广谱抑菌作用的多粘类芽孢杆菌,研究发现其有作为碱性食品保鲜剂的潜能。本研究基于从有机质土壤中选育的一株产淀粉酶的甲基营养型芽孢杆菌,研究了其对真菌的拮抗作用,并对该菌株代谢产物中可能的抑菌物质进行分离和鉴定,为进一步开发天然食品防腐剂及生防菌剂提供了理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
甲基营养型芽孢杆菌BFWR11:本课题组分离并保存;黑曲霉菌:由西北农林科技大学食品科学与工程学院提供;灰霉菌、赤霉菌:由西北农林科技大学植物保护学院提供。
1.1.2 试剂
BaCl2:天津市天力化学试剂有限公司;NaCl、苯甲酸钠、Na2HPO4·12H2O、甲醇、正丁醇:广东光华科技股份有限公司;KH2PO4:成都市科龙化工试剂厂;YA1080普通干型透析袋MD25(3500D):北京索莱宝科技有限公司。
1.1.3 仪器
NRY-2102型摇床培养箱 上海南荣实验室设备有限公司;LMQ.CE型立式灭菌锅 山东新华医疗器械股份有限公司;SmartSpecTMplus 分光光度计 美国 Bio-Rad仪器有限公司;CD-UPTL II型超纯水制造系统 成都越纯科技有限公司;Bioscreen全自动生长曲线分析仪 上海谓载商贸发展有限公司。
1.2 方法
1.2.1 BFWR11菌株生长曲线测定
从甘油保藏管中取1环菌液划线接种于LB平板,30 ℃过夜培养。挑取单菌落接种到5 mL新鲜LB肉汤中,130 r/min、30 ℃培养12 h。用新鲜的LB肉汤调整培养物OD600值为0.5,稀释10倍后吸取250 μL接于蜂窝板中,使用Bioscreen全自动生长曲线分析仪测定菌株生长曲线,设定参数为30 ℃、中速,每组试验3次重复。
1.2.2 BFWR11菌株对真菌的拮抗作用
选择赤霉菌、灰霉菌、黑曲霉菌为测试真菌。分别制备孢子悬液,涂布接种于PDA平板上,28 ℃培养5~7 d至菌丝长起,用直径5 mm的打孔器取真菌菌块,备用。采用平板对峙培养法测定BFWR11菌株对不同真菌的拮抗作用,在直径90 mm的PDA平板中心轻轻放置真菌菌块,菌丝面朝下,试验组将BFWR11菌株点接种到距离真菌菌块20 mm位置,平板上对称取4点接种,3个重复平板。对照组只接入测试真菌菌块。28 ℃培养5~7 d,观察、测量菌块大小,计算抑菌率。
抑菌率=(对照组菌块直径-试验组菌块直径)/对照组菌块直径×100%。
1.2.3 BFWR11菌株发酵上清液的制备
挑取单菌落接种到5 mL新鲜LB肉汤中,130 r/min、30 ℃培养12 h进行活化,作为种子液。按5%接种量将种子液接种到100 mL的LB肉汤中,130 r/min、30 ℃培养50 h,作为发酵液。发酵液于4 ℃、10000 r/min离心20 min,取上清液,经0.22 μm微孔滤膜除菌,获得发酵上清液,备用。
1.2.4 脂肽粗提物的制备
参考邵天蔚等[13]的研究方法,取200 mL发酵上清液,用6 mol/L的HCl溶液调节pH为2.0,4 ℃静置过夜。4 ℃,10000 r/min 离心20 min,倒掉上清,沉淀用50 mL甲醇溶解,真空抽滤后,将滤液进行旋转蒸发去除有机溶剂,浓缩后将样品于45 ℃进行真空干燥,所得的干燥样品用PBS缓冲液(0.02 mol/L,pH 7.2)定容至5 mL,经0.22 μm有机微孔滤膜除菌,获得脂肽粗提物。
1.2.5 正丁醇萃取物的制备
取200 mL发酵上清液,加入等体积正丁醇,萃取2次后合并有机相,于60 ℃旋转蒸发浓缩后进行真空干燥,所得的干燥样品用PBS缓冲液定容至5 mL,经0.22 μm有机微孔滤膜除菌,获得正丁醇萃取物。
1.2.6 粗蛋白提取物的制备
取200 mL发酵上清液,称取112.2 g硫酸铵颗粒,缓慢加入上清液中,使其饱和度达到80%,4 ℃静置过夜。4 ℃,10000 r/min离心20 min,倒掉上清,沉淀用0.02 mol/L PBS缓冲溶液重悬后装入透析袋(透析袋沸水浴10 min后于4 ℃保存在1%苯甲酸钠溶液中备用,使用前用蒸馏水冲洗干净),透析袋放置于装有2 L PBS缓冲液的烧杯中透析除盐。在透析3,6,12 h后更换透析液,直至采用1% BaCl2溶液滴定检测烧杯中透析液无沉淀生成。将透析袋内溶液于45 ℃进行真空干燥,所得的干燥样品用PBS缓冲液定容至5 mL,经0.22 μm有机微孔滤膜除菌,获得粗蛋白提取物。
1.2.7 不同提取物抑菌活性的测定
采用双层平板牛津杯法对上述粗提液进行抑菌活性的测定。将10 mL 2%琼脂倒入培养皿中待其凝固,用镊子将无菌牛津杯轻轻置于其上,均匀倒PDA培养基,待其凝固后于平板中心位置放置真菌菌块,每个牛津杯孔加入200 μL待检测粗提液,3个重复平板,28 ℃培养5~7 d。
1.2.8 LC-MS非靶标代谢组学检测
称取10 mg冻干后的正丁醇萃取物,加入10 mL提取液(乙腈∶水为1∶1,V/V),涡旋混匀30 s,冰水浴超声10 min,将样品于4 ℃,12000 r/min离心15 min,取100 μL上清液于进样瓶中,采用超高效液相色谱-串联四极杆飞行时间质谱(UHPLC-QTOF-MS)分析检测。
通过Waters ACQUITY UPLC BEH Amide (2.1 mm×100 mm,1.7 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱A相为水相,含25 mmol/L乙酸铵和25 mmol/L氨水,B相为乙腈。采用梯度洗脱:0~0.5 min,95% B;0.5~7 min,95%~65% B;7~8 min,65%~40% B;8~9 min,40% B;9~9.1 min,40%~95% B;9.1~12 min,95% B。流动相流速:0.5 mL/min,柱温:25 ℃,样品盘温度:4 ℃,进样体积:正离子1 μL,负离子1 μL。
使用Triple TOF 6600高分辨质谱,通过IDA(information-dependent acquisition)模式进行高分辨质谱数据采集。本部分检测委托北京奥维森基因科技有限公司完成。
1.2.9 发酵液蛋白提取物定性分析
蛋白提取物使用FASP(filter aided sample preparation)法进行酶解,获得的肽段使用0.1%甲酸-水溶液复溶,进样15 μL,78 min色谱梯度分离,采用Thermo Scientific Fusion超高分辨率质谱仪检测。本部分检测委托北京奥维森基因科技有限公司完成。
1.3 数据处理
试验数据采用OriginPro 2016软件作图,Minitab 16.2.3软件对数据进行分析处理,结果用平均值±标准差(x±SD)来表示。
2 结果与分析
2.1 BFWR11菌株对真菌的拮抗作用
用平板对峙培养法检测BFWR11菌株对真菌的拮抗作用,拮抗效果见图1。
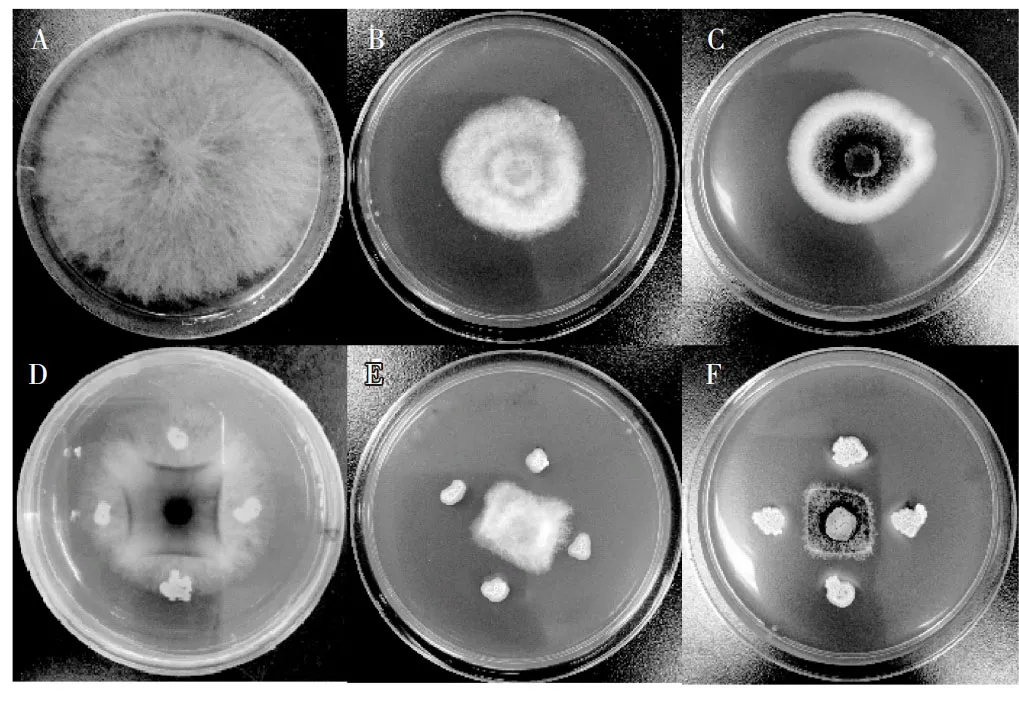
图1 BFWR11菌株对真菌的抑制作用Fig.1 Inhibition of BFWR11 strain on fungi
由图1可知,BFWR11菌株对赤霉菌、灰霉菌、黑曲霉菌的生长均有明显的拮抗作用,其中赤霉菌气生菌丝发达,向培养基上空伸展,由于皿盖阻挡,限制了气生菌丝直生,使其叠生于皿盖上,但在BFWR11菌落周围的培养基中没有生长,灰霉菌和黑曲霉菌试验组真菌菌丝生长均受到明显抑制。BFWR11菌株对赤霉菌、灰霉菌、黑曲霉菌的抑菌率分别为45.03%、30.60%和47.56%,结果见表1。

表1 BFWR11菌株对真菌的抑菌率Table 1 The antibacterial rates of BFWR11 strain against fungi
2.2 BFWR11菌株的生长曲线
采用全自动生长曲线分析仪测定BFWR11菌株在LB肉汤中的生长曲线,结果见图2。

图2 BFWR11菌株生长曲线Fig.2 Growth curve of BFWR11 strain
BFWR11菌株在3 h内很快进入对数生长期,菌数快速增长,培养12 h后细菌密度达到最大值,OD600为0.54。对数期微生物是发酵工业中用作种子的最优材料,后续试验选择12 h纯培养物作为发酵种子液。12 h后细菌生长进入稳定期,为积累代谢产物的发酵时期,此后OD600变化趋势平缓,OD600为0.50~0.55,试验选择培养50 h即积累代谢产物较多的稳定期的培养物作为发酵液,用其上清液提取不同代谢产物进行拮抗试验。
2.3 BFWR11菌株代谢产物对真菌的抑制作用
BFWR11发酵上清液的不同粗提物对真菌的抑制效果见图3。BFWR11菌株的发酵液和离心去除菌体后的上清液对赤霉菌有抑制作用。BFWR11发酵上清液经酸沉淀、甲醇抽滤后得到的淡黄色脂肽类物质对赤霉菌有抑制作用,和对照组比较,试验组菌丝无法蔓延生长。正丁醇萃取物对赤霉菌菌丝的抑制效果明显,揭示极性大的正丁醇可以萃取到较多的抑菌活性物质。80%硫酸铵溶液盐析提取的粗蛋白对赤霉菌菌丝生长也有抑制作用(见图3中Ⅰ)。
BFWR11发酵液和上清液对灰霉菌菌丝都有抑制作用。发酵液比上清液的抑制作用强,推测发酵液中BFWR11菌株不仅分泌抑菌物质在上清液中,而且还会通过生物竞争或其他途径对灰霉菌进行抑制。脂肽粗提物、正丁醇萃取物、粗蛋白提取物对灰霉菌的抑制效果明显,试验组菌丝均无法正常蔓延生长,表明酸沉淀、正丁醇萃取、硫酸铵沉淀3种方法可提取到发酵上清液中不同类型抑菌活性物质(见图3中Ⅱ)。
BFWR11发酵液对黑曲霉菌有抑制作用,但上清液、脂肽粗提物、正丁醇萃取物、粗蛋白提取物对黑曲霉菌丝的生长均未表现出明显的抑制作用,推测可能是因为黑曲霉繁殖力强,试验采用的200 μL不足以抑制其菌丝生长,或是与赤霉菌、灰霉菌相比,BFWR11菌株和黑曲霉菌之间的拮抗作用机制不同(见图3中Ⅲ)。
2.4 正丁醇萃取物UHPLC-QTOF-MS分析鉴定
采用UHPLC-QTOF-MS对正丁醇萃取物成分进行定性分析,非靶标代谢组学检测到2535种物质,包括酸类、酚类、碱类等。按相对含量由多到少列出部分抑菌相关物质鉴定结果,见表2。其中棕榈酸含量最高,其次为阿扎胞苷、3-羟基苯甲酸、肉豆蔻酸、水杨酸等。祁超等[14]对枯草芽孢杆菌YN201490发酵上清液的正丁醇萃取物采用基质辅助激光解吸电离飞行时间质谱技术鉴定到表面活性素和伊枯草菌素,与祁超等的研究结果不同可能是菌株差异或检测技术不同造成的。
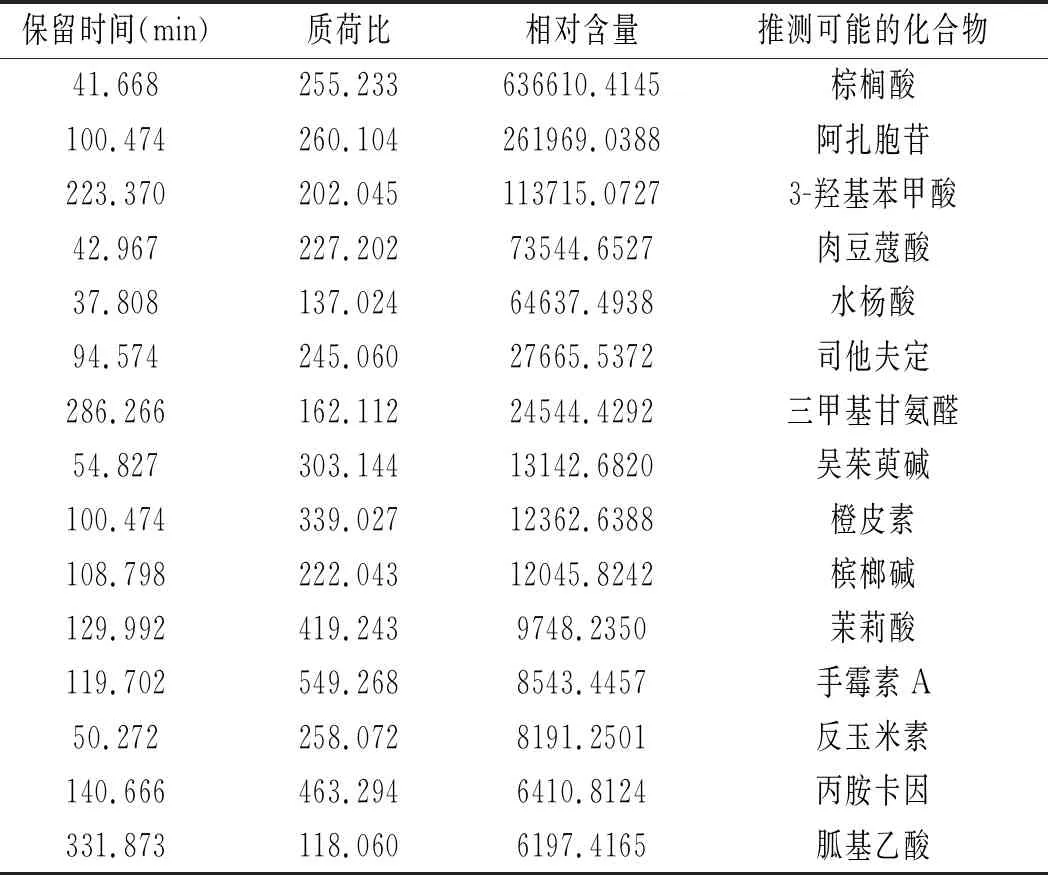
表2 正丁醇萃取物的UHPLC-QTOF-MS检测分析结果Table 2 The analysis results of n-butanol extracts detected by UHPLC-QTOF-MS
2.5 蛋白提取物LC-MS/MS定性分析
每个蛋白经酶解产生长短不一的肽段后应用LC-MS/MS对其进行鉴定,根据每个时间点质谱信号强度最高的母离子绘制得到TIC图(见图4)。基于信号最强的肽段的强度值绘制得到Base Peak图(见图5)。基于UniProt-Bacillussubtilis序列库进行蛋白样品的序列库搜索,比对获得共计750个肽段,520个蛋白质。抑菌活性相关蛋白信息见表3,鉴定到3种表面活性素合成酶亚基(基因名称分别为srfAA、srfAB、srfAC)、聚酮合成酶(基因名称分别为pksN、pksL)、鞭毛钩相关蛋白(基因名称分别为fliD、flgK)等。

图4 总离子流图Fig.4 Total ion chromatogram

图5 基峰色谱图Fig.5 Base peak chromatogram

表3 蛋白物质LC-MS/MS定性分析结果Table 3 The qualitative analysis results of protein substances detected by LC-MS/MS

续 表
表面活性素由环7肽Glu-Leu-(D)-Leu-Val-Asp-(D)-Leu-Leu与β-羟基脂肪酸组成,是由非核糖体途径合成的脂肽类抑菌物质,srfA,srfB和srfP基因已被证明是负责表面活性素合成的基因簇,srfA基因编码表面活性素合成酶的3个大亚基[15]。试验使用基质辅助激光解吸电离飞行时间质谱技术对BFWR11菌株发酵上清液的酸沉淀粗提物进行检测,未鉴定到脂肽类相关物质,但从粗蛋白中鉴定到表面活性素合成酶亚基,因此推测BFWR11菌株可产生表面活性素这一环状脂肽类抑菌物质。聚酮合成酶和非核糖体肽合成酶均可催化合成抑菌物质,这两类酶的基因常作为筛选产生新颖结构天然活性化合物的微生物指示基因[16]。鞭毛钩蛋白由flgK基因编码,fliD基因是鞭毛基因调节系统的关键组分,促使鞭毛亚单位聚合成完整的鞭毛蛋白,而鞭毛蛋白是典型的毒力因子,帮助细菌感染定殖,对抑菌活性有着重要作用[17,18]。
3 结论
甲基营养型芽孢杆菌作为芽孢杆菌属的新成员,具有广阔的应用前景。詹艺舒等[19]分离到一株甲基营养型芽孢杆菌,研究发现其对食品腐败真菌黑曲霉、康氏木霉、绿色木霉、少根根霉、易脆毛霉、赭绿青霉的生长具有较强的抑制作用。本试验中选用的BFWR11菌株是本课题组前期分离到的一株甲基营养型芽孢杆菌,牛津杯法和平板对峙培养法试验结果表明其对赤霉菌、灰霉菌及黑曲霉菌具有较强的拮抗作用,酸沉淀、正丁醇萃取、硫酸铵沉淀3种不同方法的发酵上清液粗提物对赤霉菌和灰霉菌有明显的抑制作用,这表明不仅可以利用BFWR11菌株进行生物防治,也可对其上清液中的抑菌物质进行提取浓缩和开发利用。
甲基营养型芽孢杆菌BFWR11可产生酸类、碱类、蛋白类等多种抑菌活性物质协同抑菌,其中脂肽类物质作为一种新型的生物表面活性剂,不仅具有良好的乳化性质,还具有抑菌、增溶、润湿等作用,目前主要应用于鱼、虾及其制品的保鲜[20],这为甲基营养型芽孢杆菌BFWR11及其代谢产物进一步开发为生防菌剂及天然食品防腐剂奠定了理论基础,后续可基于鉴定到的抑菌活性物质从代谢和基因水平进行系统深入研究,阐明其作用机理。
