表达透明颤菌血红蛋白对圆红冬孢酵母油脂积累的影响
2020-09-17周人辉吕力婷钱斯日古楞张素芳赵宗保
王 爽, 张 月, 周人辉, 吕力婷, 钱斯日古楞, 张素芳, 赵宗保
(1. 大连工业大学 生物工程学院, 辽宁 大连 116034; 2. 中国科学院大连化学物理研究所, 辽宁 大连116023)
0 引言
化石燃料的日益耗竭和环境问题的日益凸显,使得人们将目光投向绿色可再生能源。作为生物柴油的原料之一,微生物油脂具有生产周期短、底物来源广泛等优点, 因而受到研究者的广泛关注。自然界中,少数微生物可在细胞内合成并储存超过自身细胞干重20%以上的油脂,这些微生物被称为“产油微生物”[1]。 圆红冬孢酵母属于红酵母属, 其油脂积累可达细胞干重的60%以上,同时,其可以利用的底物较为广泛,木糖、甘油、木质纤维素等廉价的原料均可被其用于油脂发酵[2]~[4]。
透明颤菌是一种专性好氧原核生物, 其胞内表达的血红蛋白(VHb)使其在贫氧的环境下依然能够生存。 透明颤菌血红蛋白与氧气的结合速率远远小于其与氧气的解离速率,因此,透明颤菌能够在胞内储存更多的氧气[5]。 胞内储存的氧气可以加速胞内氧化磷酸化的效率; 影响细菌胞内的Fnr,OxyR 转录因子,从而提高胞内透明质酸、β-葡萄糖苷酶等异源蛋白的表达量; 参与胞内的代谢途径,增加胞内代谢物的产量[6]~[10]。
微生物油脂发酵后期,细胞密度增大,导致溶氧量不足,使得细胞生长受到抑制,胞内产物不能正常积累。 提高溶氧的传统方法有增加搅拌速率和增大通气量,但是,这两种方法均会增加机械力从而对细胞具有一定损伤。因此,通过基因工程技术来缓解氧气供给不足的情况是一种行之有效的替代方法。 Xue S J 研究了透明颤菌血红蛋白对Aureobasidium melanogenum 菌中普鲁兰产量的影响,研究结果表明,普鲁兰的产量从72.0 g/L 增加至102.3 g/L[11]。 Zhang H 的研究表明,在溶氧量为30%的3 L 发酵罐中,与出发菌株相比,表达vgb基因的重组菌株Yarrowia lipolytica 的生物量增加了27%,油脂含量增加了38.69%[12]。
本文尝试通过农杆菌介导转化的方法, 将透明颤菌的血红蛋白基因vgb 整合至圆红冬孢酵母中, 并考察重组菌株在氧气溶量不同的发酵条件下的细胞生长和油脂积累情况, 为微生物油脂的工业化生产提供了实验基础。
1 材料和方法
1.1 菌株和质粒
本实验所用的菌株和质粒的信息如表1 所示。
表1 所用菌株和质粒Table 1 Strains and Plasmids used in this study
1.2 工具酶和试剂
PrimeSTAR DNA 聚合酶、rTaq DNA 聚合酶、限制性内切酶、Dpn I 等均购自大连TaKaRa 公司;DNA Marker 2K plus II 购于北京全式金生物技术有限公司; 质粒快速提取试剂盒、DNA 胶回收试剂盒、PCR 产物回收试剂盒和其他生物试剂均购于上海生工生物工程股份有限公司, 测序工作委托苏州泓汛公司完成; 其他试剂均为分析纯试剂。 本研究所用的引物如表2 所示。

表2 本研究所用的引物Table 2 Primers used in this study
1.3 培养基
LB 液体培养基:胰蛋白胨10.0 g/L、酵母提取物5.0 g/L 和氯化钠10.0 g/L,pH 值为7.0。
LB 固体培养基:在LB 液体培养基的基础上加琼脂粉15.0 g/L。
YPD 液体培养基:葡萄糖20.0 g/L、酵母提取物10.0 g/L 和蛋白胨20.0 g/L,pH 值为6.0。
YPD 固体培养基:在YPD 液体培养基的基础上加琼脂粉15.0 g/L。
氮源限制培养基(NL 培养基):葡萄糖70 g/L、硫酸铵0.1 g/L、酵母提取物0.75 g/L、磷酸二氢钾1.0 g/L、结晶硫酸镁1.5 g/L、体积分数为1%的痕量元素储液(结晶氯化钙4.0 g/L、结晶硫酸亚铁0.55 g/L、一水合柠檬酸0.52 g/L、结晶硫酸锌0.1 g/L、结晶硫酸锰0.076 g/L 和100 μL 18 M 的浓硫酸),pH 值为6.0。
MM 盐溶液:磷酸氢二钾2.05 g/L、磷酸二氢钾1.45 g/L、氯化钠0.15 g/L、硫酸镁0.5 g/L、氯化钙0.066 g/L、 七水硫酸铁0.002 48 g/L 和硫酸铵0.5 g/L,pH 值为7.0。
IM 诱导平板:MM 盐溶液400 mL、 甘油5 mL、去离子水540 mL、琼脂粉20 g,高压灭菌后加入40 mL 1 M 的MES 和最终浓度为200 μM 的乙酰丁香酮(以上为配置1 L 时的添加量)。 培养微生物的过程中,可根据需求添加适量的抗生素。
1.4 载体构建
设计含有Nco I 和Spe I 两个酶切位点的引物NcoI-F 和Ble-P2A-VHb-R, 扩增pUC57-vgb得到Nco I-vgb-Spe I 片段; 将质粒pZPK-PPGKhyg-TNOS-PGPD-mcs-THSP与该片段同时进行Nco I和Spe I 双位点酶切,再连接;通过化学转化方法将连接产物转至大肠杆菌感受态DH5α, 在含有50 μg/mL 的Kan 的LB 平板上进行筛选, 挑取转化子并测序, 获得重组载体pZPK-PPGK-hyg-TNOSPGPD-vgb-THSP。
1.5 重组菌株的构建
将测序正确的pZPK-PPGK-hyg-TNOS-PGPD-vgb-THSP载体电转化至农杆菌AGL1 感受态细胞中,并在含有50 μg/mL 的Kan 的LB 平板上筛选转化子。 经菌落PCR 鉴定,挑取基因型正确的重组农杆菌单克隆转接于5 mL LB 液体培养基(含50 μg/mL 的Kan)中。 同时,挑取圆红冬孢酵母NP11接种于5 mL YPD 液体培养基中, 两种菌株均在温度为30 ℃, 转速为200 r/min 的条件下培养16 h。 取一定量的菌液于1.5 mL 离心管中,于13 000 r/min 离心30 s, 收集菌体, 用无菌蒸馏水洗涤1次。 用无菌蒸馏水将菌稀释至OD600=0.6,分别吸取100 μL 稀释好的农杆菌和酵母菌等量混合,涂布于IM 平板滤纸载面上, 并放于24 ℃培养箱培养2 d, 将滤纸转至潮霉素抗性浓度为50 μg/mL的YPD 平板进行重组菌株的筛选,长出转化子后进行遗传稳定性验证及基因型验证。
1.6 VHb 表达及功能验证
分别在平板上挑取出发菌株R. toruloides NP11(简记为NP11)与重组菌R. toruloides NG-20,R.toruloides NG-21 和R.toruloides NG-22(分别简记为NG-20,NG-21 和NG-22) 单菌落转接于50 mL YPD 液体培养基,在温度为30 ℃,转速为200 r/min 的条件下培养24 h 后, 以1∶50 的比例转接于50 mL YPD 培养基中,在温度为30 ℃,转速为200 r/min 的条件下培养24 h 后, 离心收集菌体,超纯水洗2 次,缓冲液(100 mM 的磷酸钾溶液,pH 值为7.4) 洗涤1 次, 将其重悬于10 mL上述缓冲液中至菌体冷却;将Mini 型低温高压破碎仪(广州聚能纳米生物科技股份有限公司)的压力调至180 MPa,然后将重悬菌体破碎3 次,再于4 ℃,14 000 r/min 离心30 min,取2 mL 上清液测总蛋白浓度。 由于透明颤菌血红蛋白能够与CO 结合成络合物,在419 nm 处有特异的吸收峰,因此,使用低温高压破碎仪破碎细胞, 再低温离心细胞破碎液并取上清液,进行CO 差异光谱分析[13]。 向待测蛋白样品中连续通2 min 的CO,再利用Evolution 220 型可见分光光度计[赛默飞世尔科技(中国)有限公司]进行全波长(400~500 nm)扫描。
1.7 摇瓶发酵
将出发菌株NP11 和重组菌株NG-20,NG-21 和NG-22,分别划线于YPD 平板,于28 ℃培养箱培养24 h。 分别挑单克隆接种于50 mL YPD培养基中,在温度为30 ℃,转速为200 r/min 的条件下培养24 h; 再将种子液分别转接至装有50,100 mL NL 液体培养基的250 mL 锥形瓶中,初始OD 控制为0.1,在温度为30 ℃,转速为200 r/min 的条件下发酵至发酵液残糖浓度小于10 g/L,收集细胞称取细胞干重,再利用酸热法提取油脂进行后续分析。
1.8 Western blot 分析
取2 mL 在YPD 液体培养基中培养24 h 的NP11 和3 种工程菌株, 于8 000 r/min 离心5 min,弃上清,再用双蒸水清洗一遍;加入200 μL细胞裂解液以及适量玻璃珠, 利用FastPrep○R-24细胞破碎仪[安诺论(北京)生物技术有限公司]振荡1 min(4.0 M/s),冰浴1 min,重复5 次;取60 μL 细胞破碎之后的上清液加入20 μL 4×loading buffer,98 ℃处理10 min, 取10 μL 处理过的样品上样 (8%分离胶),15 mA 限流的条件下进行电泳。通过湿法转膜,将胶上的蛋白转移至硝酸纤维膜上(100 mA 限流,电泳50 min);然后将膜37 ℃封闭1 h,膜清洗液清洗3 次,每次5 min。 一抗采用抗His-Tag 单克隆抗体(购于上海碧云天生物技术有限公司),37 ℃孵育1 h, 膜清洗液清洗3次,每次5 min;二抗选择山羊抗小鼠IgG 抗体(购于上海碧云天生物技术有限公司),37 ℃孵育1 h,膜清洗液清洗3 次,每次5 min;添加显色液进行显色, 使用Tanon-5200Multi 全自动化学发光图像处理系统分析 (上海天能科技有限公司)Western blot 结果。
1.9 细胞显微观察
分别取50 mL(模拟不限氧条件)和100 mL(模拟限氧条件)发酵液发酵终点时的菌液,利用EVOS 显微镜(北京东胜创新生物技术有限公司)进行镜鉴, 观察出发菌株与工程菌株的细胞形态及胞内油脂积累的情况。
2 结果与分析
2.1 工程菌株vgb 基因型验证
通过ATMT 的方法将vgb 整合至圆红冬孢酵母染色体中, 使用位于启动子的上游引物GPD-795-F 与位于终止子的下游引物Thsp-129-R 进行基因型鉴定,结果如图1 所示。

图1 基因型鉴定Fig.1 Genotype identification
从图1 可以看出,出发菌株NP11 无条带,而3 种重组菌株NG-20,NG-21 和NG-22 均具有预期大小的目的条带, 这表明透明颤菌血红蛋白基因vgb 已成功整合到圆红冬孢酵母染色体上。
2.2 透明颤菌血红蛋白的表达及活性功能的检测
Western blot 和CO 差异光谱分析的结果如图2 所示。 本文使用Western blot 分析VHb 蛋白在重组菌株中的表达。 从图2(a)中可以看出,在工程菌株泳道中有一条清晰的VHb 蛋白(VHb 蛋白单体的理论大小为15.7 kDa)的免疫杂交条带,说明重组菌株可以正常合成VHb 蛋白。 VHb 在不同的环境条件下可呈现3 种不同的状态, 若向含酶溶液中鼓入CO 气体, 则可形成VHb-CO 复合物, 在419 nm 处呈现特征吸收峰。 为了检测VHb 在圆红冬孢酵母中是否具有生物活性,利用CO 差异光分析方法进行检测,结果如图2(b)所示[14]。 从图2(b)中可以看出,3 个重组菌株NG-20,NG-21 和NG-22 在419 nm 处均具有吸收峰,而出发菌株NP11 没有吸收峰,3 个重组菌株间的吸光度有所差别,这可能与VHb 蛋白的表达量不同有关。综上可知,透明颤菌血红蛋白在圆红冬孢酵母胞内成功表达并且具有一定的生物活性。

图2 Western blot 和CO 差异光谱分析Fig.2 Western blot analysis and CO difference spectral
2.3 VHb 对油脂积累的影响
在本研究中, 为了充分验证透明颤菌血红蛋白对圆红冬孢酵母油脂积累的影响, 将发酵液的体积分别控制在50 mL(模拟不限氧条件)和100 mL(模拟限氧条件),在容量为250 mL 的摇瓶中进行发酵,结果分别如图3,4 所示。

图3 发酵液的体积为50 mL 时,VHb 对油脂积累的影响Fig.3 Effect of VHb on lipid accumulation under 50 mL fermentation liquid volume
从图3 中可以看出:在不限氧条件下,NG-20的葡萄糖消耗最少, 其他重组菌株的葡萄糖消耗无明显差异; 出发菌株NP11 的油脂产量为8.04 g/L,油脂产率为57%,3 种工程菌株NG-20,NG-21 和NG-22 的油脂产量分别为8.31,9.47,8.25 g/L,油脂产率分别为59%,61%,58%;与出发菌株相比,NG-21 的油脂产量提高了18%。
从图4 中可以看出: 在限氧条件下, 发酵至120 h 之后,3 种工程菌株的葡萄糖消耗速率开始快于出发菌株的消耗速率;在发酵终点时,出发菌株的生物量为11.59 g/L, 而3 种工程菌株NG-20,NG-21 和NG-22 的 生 物 量 分 别 为12.69,11.29,13.38 g/L,与出发菌株相比,NG-22 的生物量增加了15.40%,这表明透明颤菌血红蛋白能够促进细胞的生长; 出发菌株的油脂产量和产率分别为5.78 g/L 和50%, 而3 种工程菌株NG-20,NG-21 和NG-22 的油脂产量分别为7.17,5.77,7.39 g/L,油脂产率分别为57%,51%,55%,与出发菌株相比,NG-22 的油脂产量提高了28%。
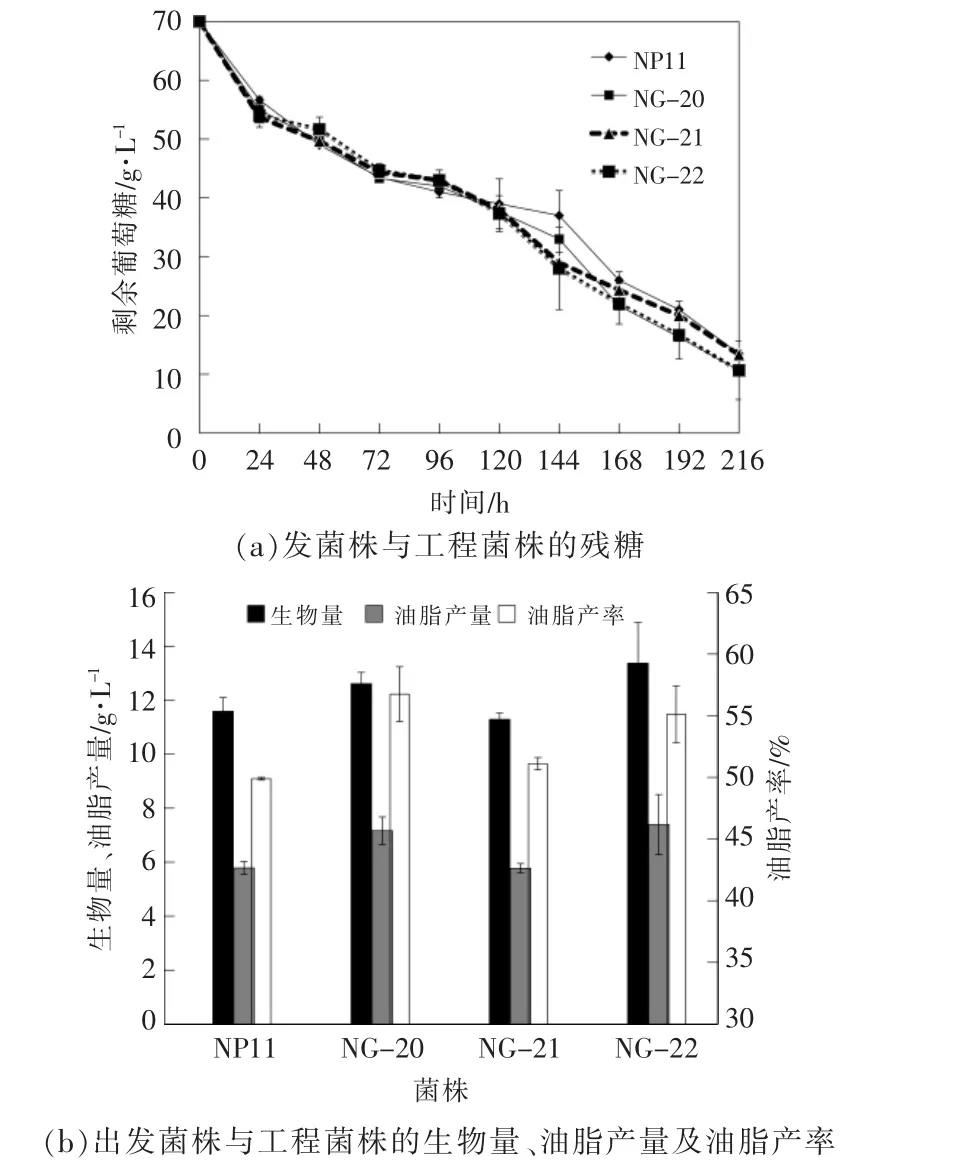
图4 发酵液体积为100 mL 时,VHb 对油脂积累的影响Fig.4 Effects of VHb on lipid accumulation under 100 mL fermentation liquid volume
2.4 VHb 对细胞形态的影响
在限氧和不限氧条件下, 出发菌株和3种工程菌株在发酵终点时的细胞形态如图5 所示。

图5 发酵终点时的细胞形态图Fig.5 Cellular morphology at the end fermentation
从图5(a)可以看出,出发菌株和3 种工程菌株的细胞相差不大,但是3 种工程菌株的胞内脂滴明显大于出发菌株。从图5(b)可以看出,3 种工程菌株的细胞均大于出发菌株的细胞, 并且胞内脂滴也明显大于出发菌株。 这进一步证明了vgb基因能够提高胞内氧气的利用率并且促进了胞内油脂的积累及细胞生长。
3 讨论和结论
在大规模发酵生产过程中, 细胞密度的增加须消耗更多的氧气,将导致发酵液溶氧量不足。透明颤菌血红蛋白具有运输氧气的功能, 本研究在圆红冬孢酵母中表达密码子优化后的vgb 基因,发现在限氧和不限氧的发酵水平下, 均提高了工程菌株的氧气利用率及耐受贫氧的能力。 本文的研究结果表明:在50 mL 的摇瓶发酵水平(不限氧条件)下,工程菌株NG-21 的油脂产量提高了18%;在100 mL 的摇瓶发酵水平(限氧条件)下,工程菌株NG-22 的油脂产量提高了28%。 值得注意的是,在氧气不足的情况下,工程菌株油脂产量的提高更为明显,由此说明,透明颤菌血红蛋白可以提高胞内氧气的利用率、缓解贫氧环境下的压力。
在限制氧气和不限制氧气条件下,VHb 均能够提高圆红冬孢酵母细胞的氧气利用率从而促进油脂的积累, 能够缓解因高密度发酵导致氧气不足而造成的细胞死亡及产量下降等问题;同时,降低了机械力对细胞的损害, 延长了设备的使用寿命,缩短了发酵时间,在大规模发酵过程中,具有一定的应用前景。
