小麦肽协同有机酸对花生红衣原花青素抗氧化稳定性的影响
2020-09-16肖建辉余莉莉牛丽亚
刘 沙,肖建辉,涂 瑾,余莉莉,牛丽亚
(江西农业大学 食品科学与工程学院,南昌 330045)
花生是我国的四大油料之一,产量与消费量均居世界首位。花生红衣是花生油脂、蛋白加工过程中产生的副产物,除部分用于制药外,大多用于饲料,其功能活性并未被完全利用[1-2]。花生红衣中含有大量的原花青素(PC),因其含有多个酚羟基而具有抗氧化性强的特点,此外还具有抗炎、降血糖、降血脂、抑菌等多种生理保健功能[3],在食品、医药、化妆品等领域具有较高的利用价值[4-5]。但由于生产加工中的温度、氧气、光照、酸碱性等因素,容易导致花生原花青素稳定性下降[6]。
近年来研究发现食品基质成分之间相互作用,能提高某些成分的稳定性[7]。利用食品天然组分,如多糖、蛋白质等,复配食源活性小分子构建复合物是解决多酚类物质稳定性的良好途径[8]。周中凯等[9]研究发现,脱铁红小豆铁蛋白-葡萄籽原花青素复合物中的原花青素在光照和热处理条件下的稳定性都比游离原花青素显著提高。
小麦作为我国重要的经济作物,含有丰富的蛋白质,小麦肽是一种源于小麦蛋白的小分子肽,具有良好的加工特性与生理活性。小麦肽富含谷氨酰胺,其肽链上易质子化的氨基及酰胺基及易去质子化的羧基都更易形成氢键,促进其发生自组装,这些都为其与花生原花青素的相互作用提供良好的结构基础[10]。目前尚未见有关多肽以及多肽协同其他成分对原花青素影响的研究。
基于此,本试验以小麦肽和花生红衣原花青素(质量比1∶30)为原料,以抗氧化性为指标,用4种不同的有机酸(柠檬酸、苹果酸、醋酸、乳酸)调节原花青素溶液的pH为5.0,经不同的热处理后(90℃、30 min和121℃、0.1 MPa、30 min),再分别将热处理后的原花青素溶液置于37℃条件下光照培养7 d,加速其降解,模拟自然储藏条件,探索小麦肽协同不同有机酸在不同处理下对花生原花青素抗氧化稳定性的影响,以期为提高花生红衣原花青素的综合利用价值提供理论依据。
1 材料与方法
1.1 试验材料
花生红衣原花青素(95%),陕西泰克生物科技有限公司;小麦肽,中食都庆(山东)生物技术有限公司;醋酸、乳酸、无水乙醇、DL-苹果酸、焦性没食子酸(邻苯三酚)、过硫酸钾、柠檬酸、盐酸、ABTS、Tris、DPPH,均为分析纯。
MS-H-S10标准加热型磁力搅拌器,美国Scilogex公司;HH-600数显恒温水箱;PHS-3E酸度计;YXQ-L5-505Ⅱ立式压力蒸汽灭菌器;SHA-C水浴恒温振荡器;Multiskan MK3酶标仪,美国Thermo labsystem公司; SPX-150B型生化培养箱;2100型&UV2100型可见分光光度计。
1.2 试验方法
1.2.1 原花青素溶液配制
用柠檬酸、苹果酸、醋酸、乳酸配制pH 5.0的缓冲溶液备用。小麦肽组溶液的配制:称取一定量的小麦肽与花生红衣原花青素(质量比1∶30),用上述4种缓冲溶液溶解,配制成原花青素质量浓度为1 mg/mL、小麦肽质量浓度为0.033 mg/mL的混合溶液。对照组溶液则是用上述4种缓冲溶液配制的质量浓度为1 mg/mL的原花青素溶液(不含小麦肽)。两组溶液均于室温下用磁力搅拌器搅拌溶解30 min后备用。
1.2.2 原花青素溶液的热处理
将搅拌溶解后的原花青素溶液分装至3批玻璃瓶中,按表1编号处理后,于37℃光照7 d。

表1 原花青素溶液样品分组
1.2.3 ABTS自由基清除能力测定
按照参考文献[11-12]中的方法配制ABTS工作液。在酶标孔中加入200 μL ABTS工作液或无水乙醇,再加入10 μL原花青素溶液或蒸馏水,避光反应10 min后,使用酶标仪在波长405 nm处测定吸光值,按下式计算ABTS自由基清除率。
清除率=[1-(Ai-Ai0)/A0] ×100%
式中:Ai为加入原花青素溶液的ABTS工作液的吸光值;Ai0为加入原花青素溶液的无水乙醇的吸光值;A0为加入蒸馏水的ABTS工作液的吸光值。
1.2.4 DPPH自由基清除能力测定
根据参考文献[13]配制0.1 mmol/L DPPH溶液避光备用。参考兰佳佳等[11]的方法,向3 mL DPPH溶液或无水乙醇中加入20 μL原花青素溶液或蒸馏水,避光反应30 min后,取反应液在波长517 nm下测定吸光值,按下式计算DPPH自由基清除率。
清除率=[1-(Ai-Ai0)/A0] ×100%
式中:Ai为加入原花青素溶液的DPPH溶液的吸光值;Ai0为加入原花青素溶液的无水乙醇的吸光值;A0为加入蒸馏水的DPPH溶液吸光值。
1.2.5 超氧阴离子自由基清除能力测定
根据参考文献[14]稍作修改。取50 mmol/L Tris-HCl缓冲溶液(pH 8.2)4.5 mL,加入2 mL蒸馏水,混合均匀后置于37℃水浴加热20 min后,加入0.5 mL原花青素溶液,随后立即加入0.5 mL已预热至37℃的25 mmol/L邻苯三酚溶液,在37℃水浴中反应6 min后立即加入1.0 mL 10 mmol/L的HCl缓冲溶液终止反应。取反应液用蒸馏水稀释后在波长325 nm处测定吸光值,按下式计算超氧阴离子自由基清除率。
清除率=[1-(Ai-Ai0)/A0] ×100%
式中:Ai为原花青素溶液与邻苯三酚溶液反应液的稀释液吸光值;Ai0为0.5 mL蒸馏水替代邻苯三酚溶液与原花青素溶液混合的稀释液吸光值;A0为0.5 mL蒸馏水替代原花青素溶液与邻苯三酚溶液混合的稀释液吸光值。
1.2.6 数据统计分析
每组数据平行测定3次,用DPS软件进行差异显著性分析。图中肩标小写字母不同表示同一种有机酸组内差异显著(p<0.05),大写字母不同表示不同有机酸组间差异显著(p<0.05)。
2 结果与分析
2.1 小麦肽协同有机酸对花生红衣原花青素的ABTS自由基清除率(见图1~图3)

图1 A处理组各样品的ABTS自由基清除率
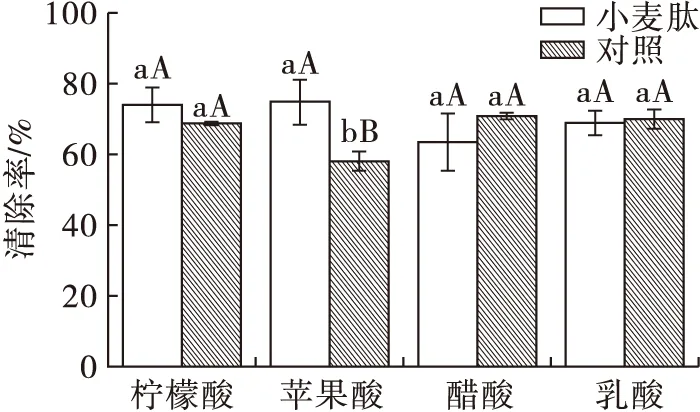
图2 B处理组各样品的ABTS自由基清除率

图3 C处理组各样品的ABTS自由基清除率
由图1可知,在A组处理条件下,小麦肽组与对照组的ABTS自由基清除率无明显差异,说明若无高温处理,花生红衣原花青素在pH 5.0条件下具有良好的抗氧化稳定性。在4种有机酸组间进行比较时,柠檬酸组中小麦肽组和对照组ABTS自由基清除率显著高于其他有机酸组,这可能是因为各有机酸的酸度系数不同而导致其作用效果不同,柠檬酸可以使原花青素处于较稳定的阳离子状态,有助于保持其稳定性,使其抗氧化能力比其他有机酸组强[15]。可见,在工业生产中,若要较好地维持花生红衣原花青素的抗氧化稳定性,酸处理的选择也尤为关键。
由图2可知,B处理组样品中只有在苹果酸体系中,小麦肽组ABTS自由基清除率显著高于对照组。这可能是因为在热、光处理下,苹果酸可以较好地促进小麦肽链上的某些基团发生自组装[16],与原花青素通过氢键形成复合物,从而起到维持其抗氧化能力的作用。
由图3可知,C处理组样品组内进行比较时,苹果酸与小麦肽协同时样品ABTS自由基清除率显著高于对照组,这与图2的现象一致,说明苹果酸与小麦肽的协同具有良好的温度适应性,在B、C组两种处理条件下都能表现出明显的稳定效果。醋酸与小麦肽协同时样品ABTS自由基清除率也显著高于对照组,而这一现象并未在图2中出现,这可能是因为C组样品的处理温度(0.1 MPa、121℃、30 min)为醋酸、小麦肽与原花青素三者的相互作用提供了适宜的条件,促进了三者间形成复合物,从而有利于维持其抗氧化能力。
2.2 小麦肽协同有机酸对花生红衣原花青素的DPPH自由基清除率(见图4~图6)

图4 A处理组各样品的DPPH自由基清除率

图5 B处理组各样品的DPPH自由基清除率

图6 C处理组各样品的DPPH自由基清除率
由图4可知,A处理组样品各有机酸协同下的小麦肽组与对照组间的DPPH自由基清除率均无明显差异。
由图5可知,B处理组样品在经过加热(90℃、30 min)和光照处理后,柠檬酸协同下的小麦肽组样品DPPH自由基清除率显著高于对照组,这说明柠檬酸与小麦肽的协同在B组处理条件下可以有效地维持原花青素清除DPPH自由基的能力,这可能是因为小麦肽与柠檬酸共同促进了原花青素基团的酰基化反应的发生,降低了原花青素的活性,使其活化能提高,提高其热稳定性[17],这与王宇滨等[15]的研究结果相似。
由图6可知,C处理组样品在经加热(0.1 MPa、121℃、30 min)和光照处理后,各有机酸组内小麦肽组与对照组样品的DPPH自由基清除率均无显著差异。乳酸作用的小麦肽组与对照组样品DPPH自由基清除率均显著低于对应苹果酸组,推测这可能是因为苹果酸通过氢键和疏水相互作用力与原花青素相结合,减少了水分子对原花青素分子的攻击,提高了其稳定性[18],而乳酸在水溶液中形成乳酸根与原花青素结合,占据了某些原花青素与DPPH自由基结合的位点[7],从而导致该组样品DPPH自由基清除率低于苹果酸组。
2.3 小麦肽协同有机酸对花生红衣原花青素的超氧阴离子自由基清除率(见图7~图9)

图7 A处理组各样品的超氧阴离子自由基清除率

图8 B处理组各样品的超氧阴离子自由基清除率

图9 C处理组各样品的超氧阴离子自由基清除率
由图7可知,A处理组样品中,小麦肽与柠檬酸、醋酸协同时样品的超氧阴离子自由基清除率显著高于对照组,说明此时样品体系中小麦肽、有机酸和原花青素的相互作用可能已经发生,可能是因为小麦肽上不同的氨基酸构型、氨基酸序列及某些末端氨基酸、电荷等为有机酸及原花青素提供了广阔的结合位点,而柠檬酸有着较多的羧基,在与小麦肽、原花青素结合时有着更强的优势。组间对比可以发现醋酸比柠檬酸效果更好,这可能是因为醋酸只含有1个羧基,酸度系数更大,在相同pH的体系中有着更多的醋酸根离子,有利于其与小麦肽、原花青素的结合。
由图8可知,B处理组样品在经加热(90℃、30 min)和光照处理后,小麦肽与醋酸协同的样品超氧阴离子自由基清除率显著高于对照组,这说明在该处理温度下,醋酸与小麦肽具有良好的协同效果,可能是醋酸上的羧基与小麦肽上某些氨基酸构型、氨基酸序列及某些末端氨基酸、电荷特异性结合,为维持原花青素稳定性提供了良好的结构基础。而对比不同有机酸作用于对照组的样品,其超氧阴离子自由基清除率无显著差异。小麦肽与不同有机酸协同时样品的超氧阴离子自由基清除率呈现显著差异,其协同下的超氧阴离子自由基清除率大小顺序为醋酸>乳酸>苹果酸>柠檬酸,推测这种差异可能是由于有机酸的酸度系数不同而导致的。
由图9可知,C处理组样品在经加热(0.1 MPa、121℃、30 min)和光照处理后,柠檬酸协同下的小麦肽组超氧阴离子自由基清除率显著高于对照组,这可能是因为柠檬酸与小麦肽中的谷氨酰胺共同与原花青素中的羟基作用,发生酰化反应,增大了原花青素的活化能,从而提高了原花青素的热稳定性[19]。有机酸单独作用于对照组时,各有机酸作用的样品之间没有明显差异,这与图8的现象一致,说明在没有与小麦肽协同的情况下,各有机酸对原花青素可能都只起到无明显差别调节pH的作用。而当小麦肽与有机酸协同时能对原花青素稳定性起到一定的维持作用,且协同作用效果随样品处理温度的不同而有所不同。
3 结 论
小麦肽协同有机酸在一定程度上可稳定原花青素的自由基清除能力,但这种稳定效果因有机酸、样品体系的热处理及清除自由基种类的不同而有所不同。
在清除ABTS自由基方面,经90℃加热后小麦肽与苹果酸的协同具有良好的稳定效果;经121℃加热后小麦肽与苹果酸、醋酸的协同都具有良好的稳定效果。在清除DPPH自由基方面,经90℃加热后小麦肽与柠檬酸的协同具有良好的稳定效果。在清除超氧阴离子自由基方面,小麦肽与柠檬酸协同在未加热与121℃加热时具有良好稳定效果;小麦肽与醋酸协同在未加热与90℃加热时具有良好的协同效果。
