补肾养血明目方基于线粒体途径对RPE 细胞凋亡的保护作用研究
2020-09-16陈强梁丽娜庄曾渊
陈强,梁丽娜,庄曾渊
视网膜色素上皮 (retinal pigment epithelium,RPE) 细胞在眼的结构和视觉功能中起着十分重要的作用。RPE 虽然是色素上皮细胞,却具有神经细胞不可再生的特性,一旦死亡只能依靠临近的RPE细胞扩张和移行填充死亡细胞占据的空间[1]。诸多研究[2-3]证实,RPE 细胞的损伤或增殖在许多视网膜疾病的病程进展中起着重要的作用,它主要参与了年龄相关性黄斑变性(age-related macular degeneration,AMD)、增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)、视网膜色素变性(retinitis pigmentosa,RP)等多种视网膜疾病的发生发展。因此,保护RPE 细胞正常生理性结构、功能和数量,抑制RPE 细胞的损伤变性,已成为治疗AMD、RP 等疾病的新方向。课题组前期研究[4-5]发现补肾养血明目方对RPE 细胞氧化应激损伤有保护作用,其作用靶点可能与线粒体有关。本文拟着重探讨补肾养血明目方基于线粒体途径对RPE 细胞凋亡的保护作用,以揭示其防治AMD 的作用机制。
1 材料与方法
1.1 材料
ARPE-19 细胞购自于中国典型培养物保藏中心细胞库。PBS 缓冲液及HBSS 缓冲液(博士德);氢醌 (Hydroquinone,HQ)(Sigma-Aldrich);DMEM/F12高糖培养基(HyClone);0.25%胰蛋白酶消化液(Solarbio);胎牛血清(Gibco);TUNEL 检测试剂盒(德国Roche);BCA 蛋白浓度测定试剂盒、线粒体/胞浆制备试剂盒 (北京普利莱基因技术有限公司);Cytochrome c Profiling ELISA 试剂盒(abcam)。CO2培养箱(Thermo);SYNERGYTM H1 酶标仪(美国BioTek公司);荧光分光光度计(美国Perkin Elmer 公司);荧光显微镜(Leica)。
空白肠吸收液的制备[4]:以不含药物的台氏缓冲液制备得到,储存在-80℃冰箱备用。补肾养血明目方含药肠吸收液的制备:参照文献[5]制备补肾养血明目方含药肠吸收液,0.22 μm 微孔滤膜过滤除菌后分装至无菌Eppendorf 管中,-80℃保存备用。
1.2 方法
1.2.1 RPE 细胞培养RPE 细胞接种于含10%FBS的DMEM/F12 培养液中,置于5%CO2、37℃细胞培养箱中常规培养,细胞贴壁后,每2~3 d 更换1 次培养液,接近融合状态时消化传代。
1.2.2 HQ 诱导建立RPE 细胞氧化损伤模型 参照此前方法[5],以终浓度为90 μM 的HQ 作为造模浓度,置于细胞培养箱中孵育24 h,诱导建立ARPE-19 细胞氧化应激损伤模型。
1.2.3 细胞分组及处理 将细胞分为正常组:常规培养液培养;模型组:90 μM 的HQ 作用24 h;空白对照组(对照组):空白肠吸收液干预24h 后,加入90 μM的HQ 作用24 h;肠吸收液干预组(干预组):补肾养血明目方含药肠吸收液干预24 h 后,加入90 μM 的HQ 作用24 h。
1.3 观察指标
1.3.1 含药肠吸收液对细胞活力的影响 细胞接种于96 孔板,HQ 诱导后采用不同浓度含药肠吸收液(0.5%、1%、2%、5%)作用24 h 后,弃上清液,PBS 缓冲液洗涤细胞3 次,每孔加入100 μL DMEM 和10 μL CCK-8 试剂的混合液,37℃孵育3 h 后,采用酶标仪于450 nm 波长测定各孔吸光度值(OD 值)。按照下列公式计算细胞活力抑制率:抑制率(%)=(OD 值正常组-OD 值肠吸收液组)/OD 值正常组×100%。
1.3.2 细胞色素C(cytochrome c,Cyt-c)含量的测定胰酶消化收集各组细胞,参照试剂盒说明书分离细胞胞浆成分,经过BCA 法蛋白定量,各样品调整为一致的蛋白浓度。采用Cyt-c 定量ELISA 试剂盒测定,具体操作按试剂盒说明书进行。样品经过酶联免疫反应后显色,测定450 nm 吸光值(OD 值)间接反映样品中Cyt-c 的含量。
1.3.3 检测细胞线粒体膜通透转换孔(mitochondrial permeability transition pore,mPTP)的开放Calcein-AM作为一种敏感的活细胞染料,可用于检测线粒体内膜通透性的改变[6]。具体操作如下:胰酶消化收集各组细胞,进行如下操作: 空白对照管中,加入含钙HBSS 重悬细胞;其余各组细胞分为2 管,加入含钙HBSS 重悬细胞后,其中一管加入2 μL Calcein-AM工作液(2 μM),另一管加入2 μL Calcein-AM 工作液(2 μM)和2 μL CoCl2,轻轻混匀后,37℃避光孵育15 min;1000 rpm 离心5 min,弃上清液;用HBSS 洗涤1 次,1000 rpm 离心5 min,弃上清液;加入HBSS轻轻混匀细胞后用荧光分光光度计检测分析: 设置激发光488 nm,发射光为517 nm。
1.3.4 TUNEL 检测RPE 细胞凋亡 对数生长期ARPE-19 细胞以1.0×106/mL 的浓度接种于预先放置盖玻片的6 孔培养板中,每组设置一个平行复孔。各组细胞经相应处理后吸出细胞培养液,按照TUNEL 检测试剂盒说明书操作,荧光显微镜下计数RPE 凋亡细胞及RPE 细胞总数,计算凋亡率。凋亡率=凋亡细胞数/同视野RPE 细胞总数×100%。
1.4 统计学方法
采用SPSS17.0 统计学软件完成统计学分析,各组实验数据通过正态性分布、方差齐性检验后,以均数±标准差()表示,多组间比较用单因素方差分析,两两比较采用LSD-t 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 ARPE-19 细胞形态
ARPE-19 细胞镜下呈现扁梭形、圆形或多角形的细胞形态,贴壁良好,胞浆内未见明显黑色素颗粒。不同处理组之间的细胞形态未见明显差异(图1)。
图1 倒置显微镜下ARPE-19 细胞形态图。1A 低倍镜下(×100);1B 高倍镜下(×200)
2.2 对RPE 细胞活力的影响
与正常组比较,HQ 诱导后ARPE-19 细胞活力降低(t=19.466,P=0.000)。与模型组比较,干预组(浓度分别为1%,2%,5%)RPE 细胞活力提高(t1%=-4.309,P=0.002;t2%=-9.503,P=0.000;t5%=-4.008,P=0.003),浓度为2%时细胞活力最好(表1)。

表1 含药肠吸收液对HQ 诱导的ARPE-19 细胞活力的影响(n=6)
2.3 对RPE 细胞mPTP 开放的影响
与正常组比较,HQ 诱导后的模型组ARPE-19细胞Calcein 平均荧光强度下降(t=8.398,P=0.000);与模型组比较,干预组Calcein 平均荧光强度提高(t=-5.521,P=0.001),对照组无明显变化(t=-0.512,P=0.623);与对照组比较,干预组Calcein 平均荧光强度提高(t=-5.009,P=0.001)(表2)。
2.4 对RPE 细胞胞浆Cyt-c 含量变化的影响
ELISA 法分析Cyt-c 含量显示,与正常组比较,模型组ARPE-19 细胞胞浆Cyt-c 含量升高(t=-9.987,P=0.000);与模型组比较,干预组ARPE-19 细胞胞浆Cyt-c 含量降低(t=2.968,P=0.018),对照组无明显变化(t=0.251,P=0.808);与对照组比较,干预组Cyt-c 含量降低(t=2.717,P=0.026)(表2)。
表2 含药肠吸收液对氧化应激损伤ARPE-19 细胞mPTP开放及胞浆Cyt-c 含量变化的影响(,n=3)
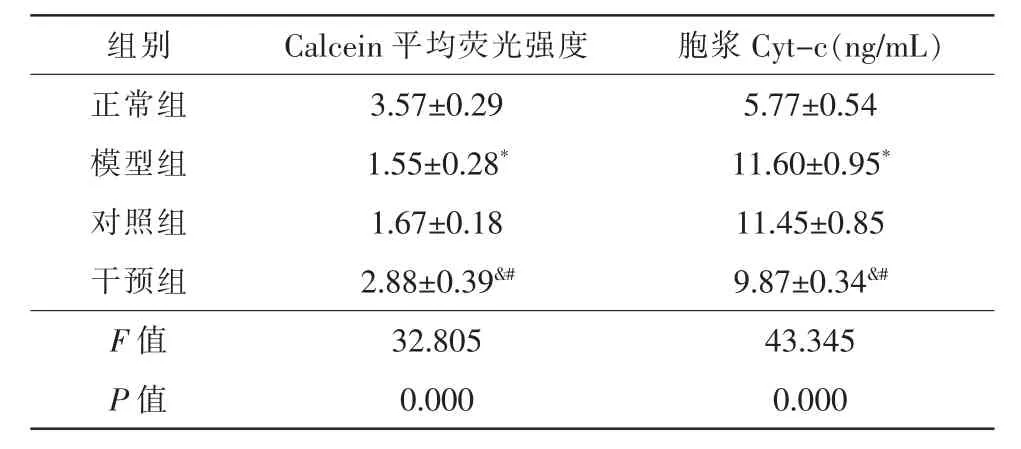
表2 含药肠吸收液对氧化应激损伤ARPE-19 细胞mPTP开放及胞浆Cyt-c 含量变化的影响(,n=3)
注:* 与正常组比较,P<0.05;& 与模型组比较,P<0.05;# 与对照组比较,P<0.05
2.5 对RPE 细胞凋亡的影响
正常组几乎没有凋亡阳性细胞。与正常组比较,HQ 诱导后模型组可发现ARPE-19 细胞凋亡现象(t=-6.564,P=0.000)。与模型组比较,干预组ARPE-19 细胞凋亡率下降(t=2.360,P=0.029),对照组凋亡率无明显变化(t=-0.572,P=0.573);与对照组比较,干预组细胞凋亡率下降(t=2.932,P=0.008)(图2、表3)。
表3 含药肠吸收液对氧化应激损伤ARPE-19 细胞凋亡的影响(,n=6)

表3 含药肠吸收液对氧化应激损伤ARPE-19 细胞凋亡的影响(,n=6)
注:* 与正常组比较,P<0.05;& 与模型组比较,P<0.05;# 与对照组比较,P<0.05
3 讨论

图2 TUNEL 检测各组ARPE-19 细胞凋亡情况图片(×200)。凋亡细胞阳性呈红色。2A 正常组;2B 模型组;2C 对照组;2D 干预组
AMD 是50 岁以上人群视力丧失的主要病因,伴随人口老龄化,其发病率呈逐年上升趋势[7-8]。虽然目前对AMD 病因的认识尚不十分清楚,但吸烟已被国内外学者公认为首要危险因素。香烟中的焦油含有高浓度的氧化剂前体,其中HQ 的含量最高。体内或体外实验[9-12]均表明,吸烟或HQ 引起的RPE细胞的氧化应激损伤可能在AMD 的发生和发展中起着重要作用。为此,课题组选择HQ 为诱导因素造模,通过建立RPE 细胞体外氧化损伤模型,探讨补肾养血明目方的作用机制。
补肾养血明目方是庄曾渊研究员多年的临床经验方,方药组成包括枸杞子、淫羊藿、黄芪、石斛等,其中枸杞子、淫羊藿补益肾精,黄芪、当归益气养血,石斛滋阴明目,诸药合用,共奏补肾养血明目功效。现代药理学研究发现,枸杞多糖能抑制蓝光照射对体外培养的人RPE 细胞的损伤作用[13]。淫羊藿苷可以明显减少糖尿病大鼠心肌胶原含量及心肌线粒体活性氧(reactive oxygen species,ROS)水平,高剂量淫羊藿苷明显抑制了心肌线粒体丙二醛(malondialdehyde,MDA)含量,增加了心肌线粒体超氧化物歧化酶(superoxide dismutase,SOD)活性[14]。尾叶远志无论总提取物还是萃取所得各组分,在高浓度时对羟自由基、超氧阴离子自由基均有一定的清除作用,显示出较强的抗氧化作用[15]。课题组前期发现补肾养血明目方可以增加RPE 细胞内ATP 水平,减少ROS 的生成,减轻线粒体DNA(mitochondrial DNA,mtDNA)损伤[5]。根据RPE 细胞氧化损伤机制、补肾养血明目方的组成功效及现代药理学研究结果推测,补肾养血明目方很可能通过线粒体途径发挥对RPE 细胞氧化应激损伤的保护作用,从而阻止或延缓了AMD 的发生和发展。近年来,我国学者探索出了含药肠吸收液的体外药理研究方法,模拟复方的体外吸收过程,该体系能较好地反映出复方进入体内的化学成分。本研究亦通过肠吸收液的方法来观察补肾养血明目方的干预效果,与传统的含药血清法相比,该方法不仅去除了复方的非吸收成分及其他杂质,也无含药血清的自身内源性成分对实验的干扰。
HQ 可诱导细胞出现氧化损伤,使细胞活力降低,造成非致死性损伤。本研究表明,补肾养血明目方肠吸收液可抑制ARPE-19 细胞损伤,细胞活性检测表明终浓度为2%的含药肠吸收液保护效果最好,因此在后续实验均采用浓度2%的肠吸收液进行干预。
线粒体是真核动物细胞进行生物氧化和能量转换的主要场所,细胞生命活动所需能量的80%是由线粒体提供的。Cyt-c 是线粒体呼吸链的重要组成部分,是一种相对分子量为1.45×104的水溶性蛋白质,位于线粒体膜间隙,稳定地结合于线粒体内膜,不能通过外膜。本研究的结果提示RPE 细胞损伤过程中Cyt-c 的释放与线粒体外膜通透性增高有关。线粒体外膜蛋白聚合形成膜通透转运孔(permeability transition factor,PTP) 复合体,PTP 复合体是一种高电导非选择性通道,许多因素如Ca2+、氧自由基、pH 改变都可触发PTP 开放[16]。当氧化应激发生时,ROS 的积累导致线粒体的膜系统受到损害,线粒体外膜通透性增加,跨膜电位降低,使线粒体膜间腔的凋亡蛋白Cyt-c 释放入细胞质中,诱导细胞凋亡[17]。本研究的结果揭示了补肾养血明目方可通过抑制RPE 细胞mPTP 开放,减少线粒体Cyt-c 的释放从而减少RPE 细胞凋亡,线粒体的保护是其实现保护作用的重要途径。研究结果为临床应用和新药研发提供了理论依据。
