茯苓配方颗粒、猪苓配方颗粒标准汤剂的质量评价
2020-09-15徐云辉张倩倩朱敏航华茉莉
刘 洁 徐云辉 张倩倩 朱敏航 华茉莉 周 靖*
(1.中国医药工业研究总院, 上海医药工业研究院创新药物与制药工艺国家重点实验室, 上海201203;2.复旦大学药学院, 上海201203)
茯苓、猪苓均是临床应用历史悠久的常用中药,前者为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf 的干燥菌核,性平,味甘、淡,具有利水渗湿、健脾宁心之功效[1],中医有“十药九茯苓”之说[2];后者为多孔菌科真菌猪苓Polyporus um⁃bellatus(Pers.) Fr.的干燥菌核,性平,味甘、淡,具有利水渗湿之功效[1]。《本草纲目》 明确记载:“猪苓与茯苓同功,但入补药不如茯苓也”。
在2015 年版《中国药典》 中,茯苓药材项下仍无明确含有量测定项,而猪苓药材项下规定麦角甾醇含有量不得低于0.07%。目前,一般认为茯苓活性成分为三萜和多糖[3],而猪苓为甾体和多糖[4]。对于茯苓中三萜和猪苓中甾体类,国内已开展诸多研究[5⁃8],发现前者含有量极低,单一成分大多不足万分之一[5],可能是《中国药典》 未将其列为茯苓药材及饮片含有量测定项的主要原因;后者含有量稍高,但麦角甾醇也不足千分之一[6]。对于茯苓、猪苓中多糖含有量的测定,大多通过苯酚⁃硫酸法水解显色,以葡萄糖(单糖)为对照,再采用紫外分光光度法计算[9],但该方法误差大,缺少专属性,无法有效表征2 种药材中多糖类成分的组成差异。
中药配方颗粒是单味中药饮片经提取、浓缩、干燥、制粒而成,中医临床配方后供患者冲服使用,也称为免煎中药饮片,是对传统中药饮片的一种改进。由于配方颗粒已失去中药饮片的外在形态特征,因此对其质量控制标准的制定显得尤为重要,可有效客观地反映不同药材的内在质量与特征,以保证临床用药的可靠性和量效化[10]。
本实验参考2016 年8 月国家药典委员会发布的《中药配方颗粒质量控制与标准制定技术要求》(征求意见稿) 相应要求,前期制备多批次茯苓、猪苓标准汤剂。经反复研究发现,标准汤剂中茯苓所含三萜和猪苓所含甾体类成分的提取转移率极低,即使配制每1 mL 含10 g 药材的供试品溶液,HPLC 法分析时仍低于检测限,无法将其作为有效的含有量测定指标[11⁃12]。核苷类成分也是真菌类中药特有的活性物质[13],而且在水煎液中能达到较好转移,虽然其含有量偏低,但基本可实现检测,同时采用内标法以减小误差。
本实验首先以茯苓、猪苓中的水溶性多糖为研究对象,结合多糖水解后单糖的衍生化处理[14],通过HPLC 指纹图谱展示多糖组成,可较好地实现两者有效区分。同时,以2 种药材中共有的微量核苷为研究对象,选择栀子苷作为内标,再通过HPLC 法同时测定尿苷、鸟苷、腺苷含有量,计算相应转移率,可有效控制茯苓配方颗粒、猪苓配方颗粒质量,以期为相关标准的制定提供参考依据。
1 材料
1.1 仪器 U3000 型高效液相色谱仪 (美国Dionex 公司);变色龙工作站(美国Thermo Fisher Scientific 公司);Extend C18、Zorbax SB⁃Aq 色谱柱(4.6 mm×250 mm,5 μm,美国Agilent 公司);AL204 型电子天平 (瑞士Mettler⁃Toledo 公司);FD⁃1A⁃50 型冷冻干燥机(北京博医康实验仪器有限公司);Millipore 超纯水仪(德国Merck 公司)。
1.2 试剂与药物 茯苓药材饮片22 批 (批号FL⁃001~FL⁃022)、猪苓药材饮片20 批 (批号ZL⁃001~ZL⁃020),产自安徽、云南、陕西等省,经上海医药工业研究院华茉莉研究员鉴定为正品,按2015 年版《中国药典》 方法检测均合格。D⁃半乳糖(批号840215)、L⁃鼠李糖(批号839801)、D⁃木糖(批号820115) (上海试剂二厂);D⁃甘露糖(批号 F20120107)、无水葡萄糖 (批号20070115) (国药集团化学试剂有限公司);D⁃核糖(批号1451793)、D⁃岩藻糖(批号050M1909)(美国Sigma 公司);栀子苷(纯度97.6%,批号110749⁃201718)、鸟苷(纯度93.6%,批号111977⁃201501)、尿苷 (纯度 99.5%,批号 110887⁃201803)、腺苷 (纯度 99.7%,批号 110879⁃201703) 对照品(中国食品药品检定研究院)。1⁃苯基⁃3⁃甲基⁃5⁃吡唑啉酮[PMP,批号H1718064,阿拉丁试剂(上海) 有限公司]。乙腈为色谱纯(阿达玛斯试剂有限公司);其他试剂均为分析纯(国药集团化学试剂有限公司);水为超纯水(Milli⁃Q 超纯水仪制备)。
2 方法与结果
2.1 标准汤剂制备 参考2016 年8 月国家药典委员会发布的《中药配方颗粒质量控制与标准制定技术要求》 (征求意见稿) 相应要求制备。称取茯苓、猪苓饮片各约100 g,加9 倍量水浸泡一定时间,煮沸后再煎煮30 min,趁热过滤,滤渣加7 倍量水,煮沸后再煎煮30 min,趁热过滤,合并滤液,减压浓缩至一定体积后冷冻干燥,即得。
2.2 多糖水解后单糖组成HPLC 指纹图谱建立
2.2.1 色谱条件 Agilent Extend C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈⁃50 mmol/L 磷酸盐缓冲液(pH =6.80) (17.5 ∶82.5);体积流量1.0 mL/min;柱温30 ℃;检测波长250 nm;进样量10 μL。
2.2.2 多糖提取 精密称取“2.1” 项下标准汤剂适量,加水至完全溶解,配制成每1 mL 相当于含1 g 茯苓或猪苓饮片的溶液,缓慢滴加无水乙醇至含醇量约80%,混匀,4 ℃冰箱中静置过夜,离心,沉淀,冷冻干燥,即得。
2.2.3 供试品溶液制备 精密称取“2.2.2” 项下多糖20 mg,加入5.00 mL 4 mol/L 盐酸,90 ℃水浴加热6 h,取出,加入适量甲醇进行减压浓缩,重复操作数次以除去盐酸,残渣加水定容至1 mL,得水解液。再进行衍生化,吸取100 μL 水解液,加入0.3 mol/L NaOH 溶液50 μL、0.5 mol/L 1⁃苯基⁃3⁃甲基⁃5⁃吡唑啉酮(PMP) 甲醇溶液60 μL,70 ℃水浴加热30 min,取出,冷却至室温,加入50 μL 0.3 mol/L 盐酸中和,加入适量氯仿萃取数次,水层定容至1 mL,即得。
2.2.4 对照品溶液制备 精密称取甘露糖、核糖、鼠李糖、葡萄糖、半乳糖、岩藻糖对照品适量,加水制成每1 mL 含上述单糖各1 mg 的贮备液,各精密移取100 μL,按 “2.2.3” 项下方法衍生化,即得。
2.2.5 精密度试验 取同一供试品溶液,在“2.2.1” 项色谱条件下进样测定6 次,选择半乳糖作为参照峰,测得各共有峰相对保留时间RSD均小于3%,相对峰面积RSD 也均小于3%,表明该方法精密度良好。
2.2.6 稳定性试验 取同一供试品溶液,于1、2、4、6、12、24 h 在“2.2.1” 项色谱条件下进样测定,测得各共有峰相对保留时间RSD 均小于3%,相对峰面积RSD 也均小于3%,表明供试品溶液在24 h 内稳定性良好。
2.2.7 重复性试验 取同一批标准汤剂,按“2.2.3” 项下方法平行制备6 份供试品溶液,在“2.2.1” 项色谱条件下进样测定,测得共有峰相对保留时间RSD 均小于3%,各共有峰相对峰面积RSD 均小于8.73%,表明该方法重复性良好。
2.2.8 指纹图谱生成及相似度分析 在“2.2.1”项色谱条件下检测22 批茯苓供试品溶液、20 批猪苓供试品溶液,所得HPLC 指纹图谱导入中药指纹图谱相似度分析软件(2004A 版),见图1~2,相似度见表1。
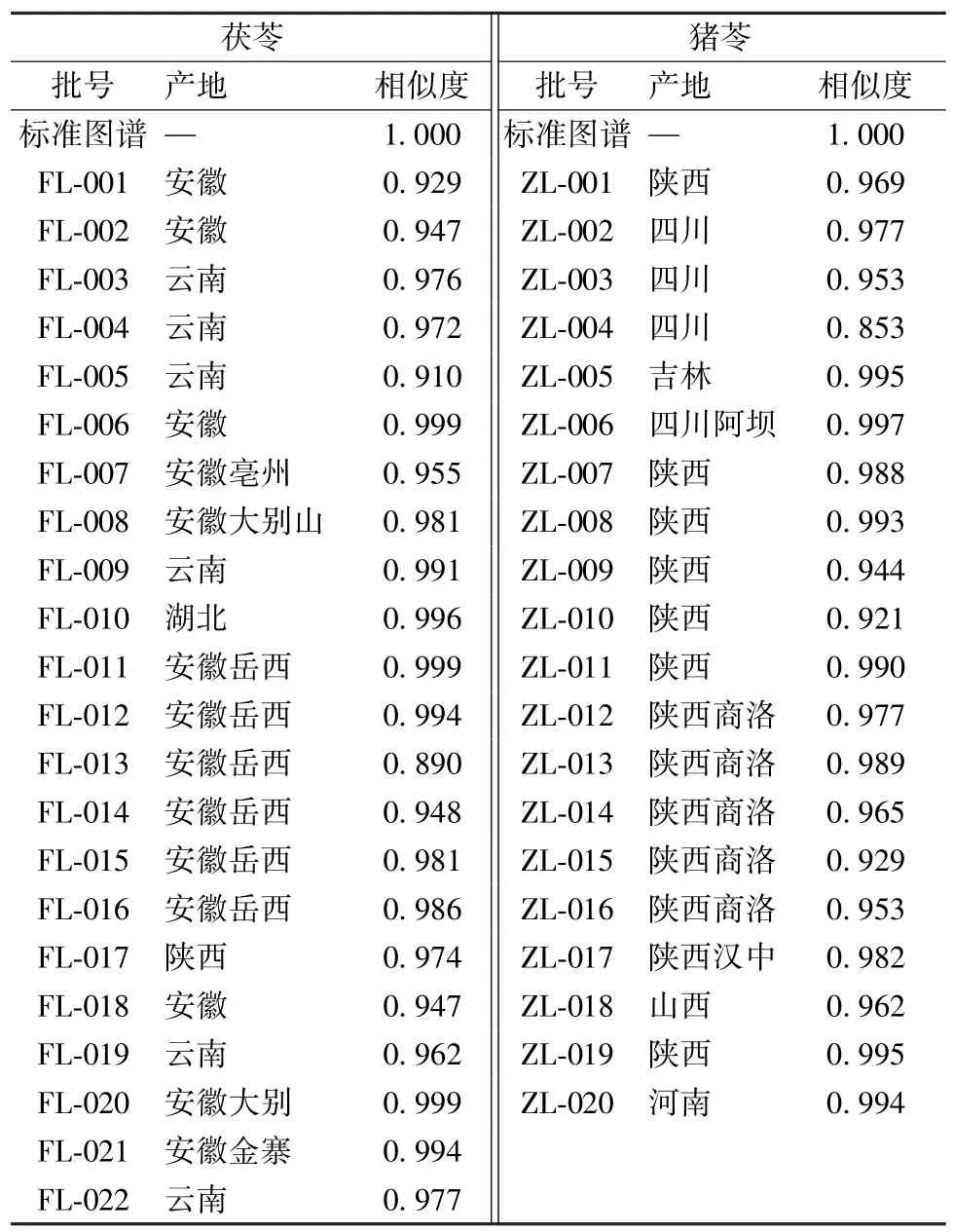
表1 各样品相似度测定结果Tab.1 Results of similarity determination of various samples
由此可知,同一品种水溶性多糖的单糖组成相似度较高,但不同品种其共有色谱峰存在明显差异;不同批次茯苓饮片指纹图谱中有5 个共有峰,通过与对照品比对确认为甘露糖、核糖、葡萄糖、半乳糖、岩藻糖;不同批猪苓饮片指纹图谱中有8个共有峰,通过与对照品比对确定其中7 个为甘露糖、核糖、鼠李糖、葡萄糖、半乳糖、木糖、岩藻糖,表明可在一定程度上表征和区分2 种饮片。
2.3 核苷含有量测定
2.3.1 色谱条件 Agilent Zorbax SB⁃Aq 色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈⁃水,梯度洗脱,程序见表2;体积流量0.8 mL/min;柱温30 ℃;检测波长260 nm;进样量10 μL。色谱图见图3。

表2 梯度洗脱程序Tab.2 Gradient elution programs
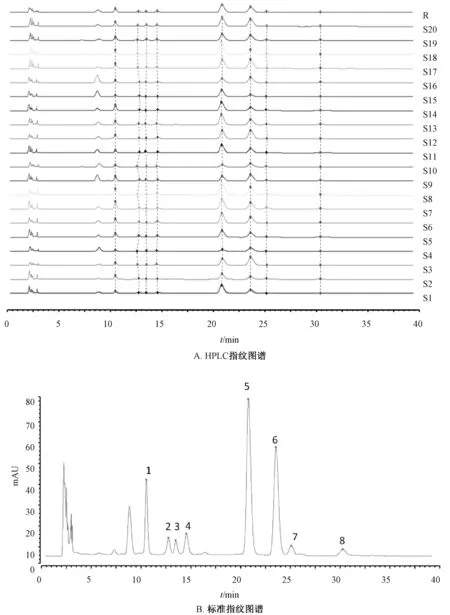
图2 猪苓单糖组成的指纹图谱Fig.2 Fingerprints for monosaccharide composition of P.umbellatus
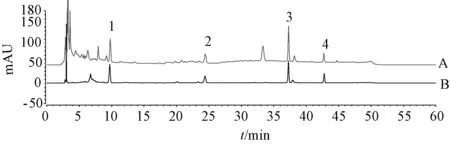
图3 各核苷HPLC 色谱图Fig.3 HPLC chromatograms of various nucleosides
2.3.2 内标溶液制备 精密称取适量栀子苷对照品,甲醇溶解定容,制成每1 mL 含0.6 mg 该成分的溶液,即得。
2.3.3 对照品溶液制备 精密称取尿苷、鸟苷、腺苷对照品,加水制成每1 mL 分别含三者0.2、0.1、0.2 mg 的贮备液,各精密移取1 mL,置于10 mL量瓶中,精密加入1.00 mL 内标溶液,加水至刻度,摇匀,滤过,即得。
2.3.4 供试品溶液制备 精密称取标准汤剂冷冻干燥粉末200 mg,置于10 mL 量瓶中,加8 mL 水超声处理30 min,精密加入1.00 mL 内标溶液,加水至刻度,滤过,即得。
2.3.5 线性关系考察 精密移取0.05、0.25、0.50、1.00、2.50、5.00 mL “2.3.3” 项下贮备液,精密加入1.00 mL 内标溶液,加水至刻度,摇匀,滤过,得不同质量浓度的对照品溶液,各精密吸取10 μL,在“2.3.1” 项色谱条件下进样测定。以溶液质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,得方程分别为尿苷Y=87.986X+0.031 1 (r=0.999 9)、鸟苷Y=97.446X+0.015 1(r=1.000 0)、腺苷Y=120.26X+0.050 2 (r=0.999 9),分别在1~100、0.5~5、1~100 μg/mL范围内线性关系良好。
2.3.6 精密度试验 取同一份供试品溶液,在“2.3.1” 项色谱条件下进样测定6 次,测得茯苓饮片中尿苷、鸟苷、腺苷峰面积RSD 分别为0.87%、0.43%、0.49%,猪苓饮片中分别为0.38%、1.20%、0.15%,表明仪器精密度良好。
2.3.7 重复性试验 取同一批样品,按“2.3.4”项下方法平行制备6 份供试品溶液,在“2.3.1”项色谱条件下进样测定,测得茯苓饮片中尿苷、鸟苷、腺苷含有量RSD 分别为2.65%、1.32%、0.78%,猪苓茯苓饮片中分别为1.39%、0.60%、1.92%,表明该方法重复性良好。
2.3.8 稳定性试验 取同一份供试品溶液,于0、2、4、8、12、24 h 在“2.3.1” 项色谱条件下进样测定,测得茯苓饮片中尿苷、鸟苷、腺苷峰面积RSD 分别为0.52%、0.42%、0.46%,猪苓饮片中分别为0.58%、0.55%、0.69%,表明供试品溶液在24 h 内稳定性良好。
2.3.9 加样回收率试验 精密称取含有量已知的同一批样品9 份,每份0.1 g,精密加入高、中、低质量浓度的对照品溶液,按“2.3.4” 项下方法制备供试品溶液,在“2.3.1” 项色谱条件下进样测定,计算回收率。结果,茯苓饮片中尿苷、鸟苷、腺苷平均加样回收率分别为96.66% (RSD =1.32%)、99.76%(RSD =1.56%)、100.15%(RSD =1.30%),猪苓饮片中分别为101.54% (RSD =1.85%)、98.13% (RSD = 1.79%)、101.01%(RSD=1.66%)。
2.4 样品含有量测定 取不同批次样品,按“2.3.4” 项下方法制备供试品溶液,在“2.3.1”项色谱条件下进样测定,计算含有量,结果见表3。
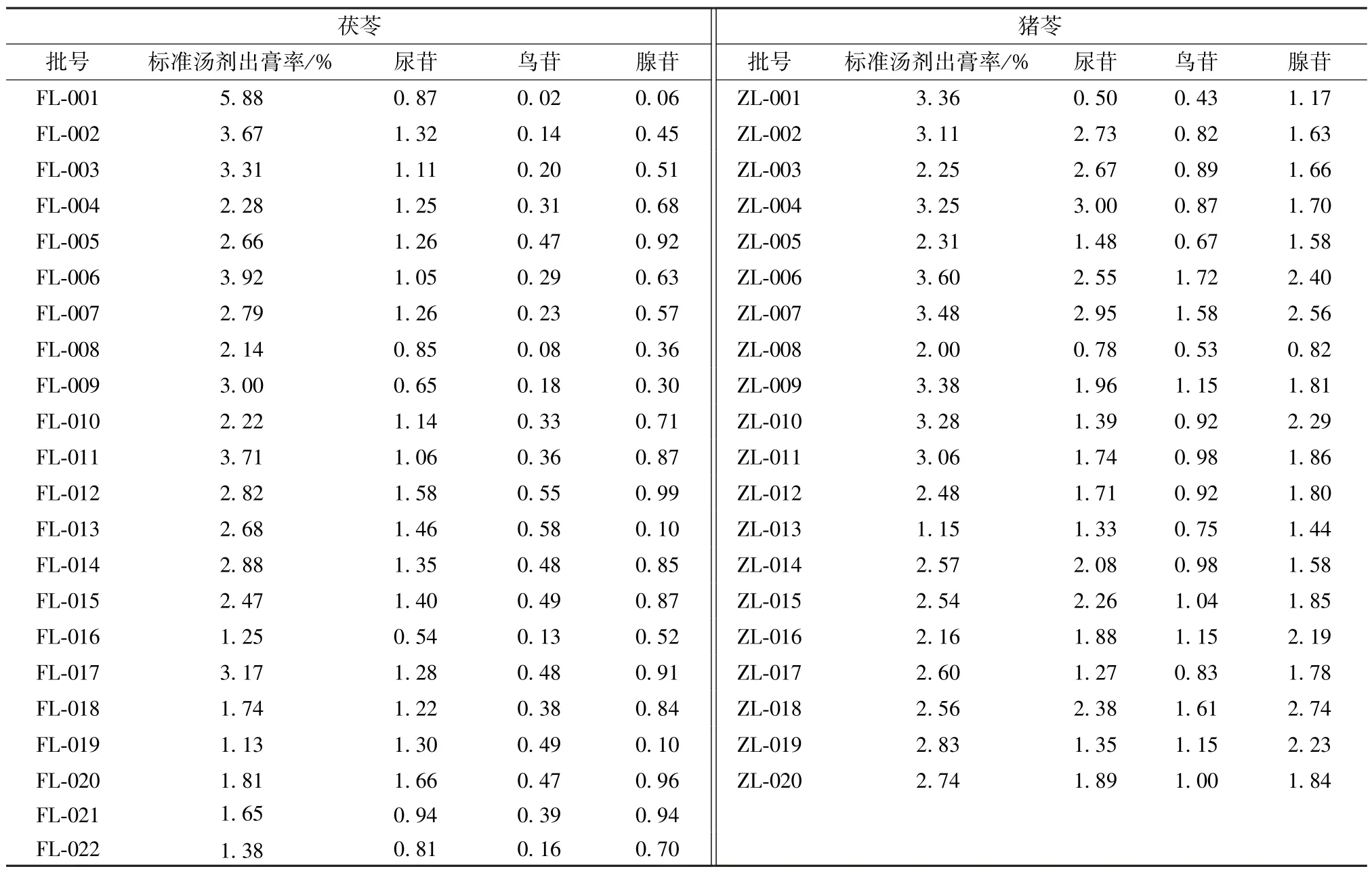
表3 各核苷含有量测定结果(mg/g)Tab.3 Results of content determination of various nucleosides (mg/g)
3 讨论与结论
本实验在制备茯苓配方颗粒、猪苓配方颗粒标准汤剂的过程中,对影响出膏率的工艺参数(浸泡时间、加水量、煎煮时间) 进行了比较。最终确定,两者出膏率分别为1.13%~5.88%、1.15%~3.60%。
多糖是茯苓、猪苓重要的活性物质[15],由于中药配方颗粒终产品大多会添加淀粉或糊精类辅料,故采用分光光度法测定其含有量,但并无实际质量控制意义。因此,本实验建立其单糖组成的HPLC 指纹图谱,以共有峰特征来区分茯苓、猪苓差异,并将其作为标准汤剂的质量检查项,对相关配方颗粒的质量控制是非常必要的。
核苷作为真菌类药材中公认的活性成分[16⁃17],对其含有量进行测定是茯苓标准汤剂、猪苓标准汤剂有效的质量控制方法,由于该成分含有量偏低,故采用内标法以减小误差。本实验考察了不同内标(如肌苷、红景天苷等) 的效果,最终选择不干扰目标成分分析、分离度好、响应值高的栀子苷,可用于测定标准汤剂中尿苷、尿苷、腺苷含有量,而且该方法稳定可靠。
综上所述,本实验制备的各批次茯苓配方颗粒、猪苓配方颗粒标准汤剂均一性较高,质量相对稳定。将多糖水解后单糖组成的HPLC 指纹图谱与核苷的含有量测定相结合时,可有效控制上述2 种标准汤剂的质量,并为其标准制定提供参考依据。
