通过式固相萃取-超高效液相色谱-串联质谱法测定猪肉和牛肉中9种类固醇激素
2020-09-14张再永马俊美李强范斌刘亮
张再永 马俊美 李强 范斌 刘亮
摘 要:建立通过式固相萃取-超高效液相色谱-串联质谱法检测猪肉和牛肉中9 种类固醇激素的方法。样品于37 ℃酶解16 h,乙腈涡旋提取后,经新型PRiME HLB通过式固相萃取小柱净化,采用Waters Acquity BEH C18色谱柱(2.1 mm×100 mm,2.5 μm)分离,以体积分数0.1%甲酸水溶液-乙腈为流动相进行梯度洗脱,使用电喷雾离子源正离子模式检测,内标法定量。结果表明:9 种类固醇激素在0.2~100.0 ng/mL质量浓度范围内线性关系良好,检出限为0.2~0.5 μg/kg,定量限为0.4~1.0 μg/kg;方法回收率为84.5%~117.3%,相对标准偏差小于10%。该方法操作简便且灵敏度高,适用于猪肉和牛肉中9 种类固醇激素的定量分析。
关键词:通过式固相萃取;超高效液相色谱-串联质谱法;类固醇激素;内标法
Abstract: A method for determination of 9 steroid hormones in pork and beef was developed by filtration solid phase extraction (FSPE) followed by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). Samples were digested for 16 h at 37 ℃, extracted with acetonitrile, and purified by a PRiME HLB cartridge. Then the analytes were separated on a Waters Acquity BEH C18 column (2.1 mm × 100 mm,2.5 μm) by gradient elution using a mixture of 0.1% formic acid solution and acetonitrile as the mobile phase. The detection was operated using an electrospray ionization source in the positive mode, and quantitation was performed by the internal standard method. The results showed that the nine steroid hormones had a good linear relationship in the concentration range of 0.2–100.0 ng/mL. The limits of detection and limits of quantitation were respectively 0.2–0.5 and 0.4–1.0 μg/kg. Recoveries of the method were in the range of 84.5%–117.3%, with relative standard deviation (RSD) lower than 10%. The method is simple, sensitive, and useful for quantification of 9 steroid hormones in pork and beef samples.
Keywords: filtration solid phase extraction; ultra performance liquid chromatography-tandem mass spectrometry; steroid hormones; internal standard method
DOI:10.7506/rlyj1001-8123-20200429-109
中图分类号:O657.6 文献标志码:A 文章编号:1001-8123(2020)07-0058-06
引文格式:
张再永, 马俊美, 李强, 等. 通过式固相萃取-超高效液相色谱-串联质谱法测定猪肉和牛肉中9 种类固醇激素[J]. 肉类研究, 2020, 34(7): 58-63. DOI:10.7506/rlyj1001-8123-20200429-109. http://www.rlyj.net.cn
ZHANG Zaiyong, MA Junmei, LI Qiang, et al. Determination of 9 steroid hormones in pork and beef samples by filtration solid phase extraction-ultra performance liquid chromatography-tandem mass spectrometry[J]. Meat Research, 2020, 34(7): 58-63. DOI:10.7506/rlyj1001-8123-20200429-109. http://www.rlyj.net.cn
類固醇激素是一类具有较强抗炎和蛋白同化作用的四环脂肪烃化合物[1-2],能促进动物超常态生长[3],提高动物养殖经济效益,但在动物体内不易被分解,通过食物链进入人体后,会导致机体代谢紊乱,甚至可导致发育异常或癌症、畸形等[4-6]。因此,世界各国对类固醇激素采取禁用或限用,但动物源性食品中类固醇激素残留问题时有发生,我国在风险监测和监督抽查中多次发现动物源性食品中类固醇激素残留的现象,曾一度影响我国动物源性食品的出口量。因此,为保障消费者健康以及我国进出口贸易往来,建立具有高灵敏度、高选择性的动物源性食品中类固醇激素检测技术具有重要意义。
目前,动物源性食品中类固醇激素的检测方法主要包括液相色谱法[7]、气相色谱-质谱联用法[8]和液相色谱-串联质谱法[9-13]。液相色谱法的灵敏度较差[14];气相色谱-质谱联用法需对目标物进行衍生化,前处理过程较繁琐[15];液相色谱-串联质谱法灵敏度高、特异性好,已成为动物源性食品中类固醇激素检测的首选方法[16-19]。目前,国内外已有类固醇激素检测的文献[20-22]与标准[23-25],虽然这些方法能满足检测要求的回收率和准确度,但大多采用传统固相萃取、液-液萃取的净化方式,或缺乏样品净化步骤[26-30]。猪肉和牛肉基质较为复杂,不经净化步骤或净化方式较为简单容易对目标物造成干扰,损耗色谱柱寿命,对质谱造成污染。传统固相萃取与液-液萃取的净化方式操作复杂、耗时长且试剂消耗量大。本研究采用PRiME HLB新型固相萃取小柱,不需要活化、淋洗、洗脱等步骤,可直接将样品中的脂肪等非极性干扰物吸附在填料内,将目标化合物过滤到进样瓶中,有效简化了前处理步骤,提高了检测效率。本研究将该技术与超高效液相色谱-串联质谱法相结合,建立猪肉和牛肉中9 种类固醇激素的检测方法,且采用同位素内标法定量,保证检测结果的准确性。
1 材料与方法
1.1 材料与试剂
猪肉和牛肉样品购自当地超市。
司坦唑醇(纯度99.88%)、美雄酮(纯度95.00%)、睾酮(纯度99.20%)、丙酸睾酮(纯度99.73%)、丙酸诺龙(纯度98.68%)、苯丙酸诺龙(纯度99.10%)、甲基睾酮(纯度98.30%) 德国Dr.Ehrenstorfer GmbH公司;群勃龙(99.9 μg/mL)、诺龙(100 μg/mL)、睾酮-D3(100 μg/mL) 北京曼哈格生物科技有限公司;乙腈、甲醇、甲酸(色谱纯) 美国Fisher公司;超纯水 广州屈臣氏有限公司。
1.2 仪器与设备
AB SCIEX Triple Quad 6500超高效液相色谱-串联质谱仪(配有MultiQuant 3.0.1数据处理软件、电喷雾电离(electrospray ionization,ESI)源) 美国Sciex公司;CR22N高速冷冻离心机 德国Hitachi公司;Elmasonic P300H超声波清洗器 德国Elma公司;SHA-B恒温水浴振荡摇床 常州润华电器有限公司;Vortex Genius 3漩涡混合器 德国IKA公司。
1.3 方法
1.3.1 标准溶液的配制
分别称取司坦唑醇、美雄酮、睾酮、丙酸睾酮、丙酸诺龙、苯丙酸诺龙、甲基睾酮标准品至棕色容量瓶中,用甲醇定容,得到质量浓度为100 μg/mL的标准储备溶液,于-20 ℃保存,有效期6 个月。量取适量的司坦唑醇、美雄酮、睾酮、丙酸睾酮、丙酸诺龙、苯丙酸诺龙、甲基睾酮标准储备溶液和群勃龙、诺龙、睾酮-D3标准物质溶液,用甲醇稀释成10 μg/mL的9 种激素混合标准中间溶液和内标中间溶液,于-4 ℃保存,有效期1 个月。
1.3.2 样品前处理
将样品充分绞碎混匀后,装入洁净的容器内。称取5 g(精确至0.001 g)试样置于50 mL聚丙烯离心管中,加入5.0 μL睾酮-D3内标中间溶液和5 mL乙酸铵缓冲溶液(pH 5.2),再加入β-葡萄糖醛苷酶/芳基硫酸酯酶20 μL,涡旋混匀,于37 ℃振荡酶解16 h;取出冷却至室温,加入10 mL乙腈,超声提取20 min后,加入2 g氯化钠,涡旋混匀1 min,9 000 r/min离心5 min;吸取约3 mL上清液,使其通过PRiME HLB固相萃取柱并弃去滤液,再取1 mL上清液,再次通过小柱并收集流出液,将收集到的流出液过0.22 ?m再生纤维素滤膜,待测。
1.3.3 色谱条件
色谱柱:Waters Acquity BEH C18柱(2.1 mm×100 mm,2.5 μm);柱温35 ℃;进样量2.0 μL;流动相A:体积分数0.1%甲酸水溶液,流动相B:乙腈;流速0.25 mL/min;洗脱程序:0~1.00 min,流动相B体积分数20%;1.00~4.00 min,流动相B体积分数20%~90%;4.00~6.00 min,流动相B体积分数90%;6.00~6.10 min,流动相B体积分数90%~20%;6.10~7.00 min,流动相B体积分数20%。
1.3.4 质谱条件
离子源:ESI+;扫描方式:多反应监测(multiple reaction monitoring,MRM),离子化电压5.5 kV,离子源温度550 ℃,氣帘气压力206.8 kPa,雾化器压力344.7 kPa,辅助气压力344.7 kPa。9 种类固醇激素定性离子、定量离子对的MRM参数见表1。
1.4 数据处理
采用Origin 9.1专业制图软件(美国Originlab公司)进行绘图。
2 结果与分析
2.1 前处理条件的优化
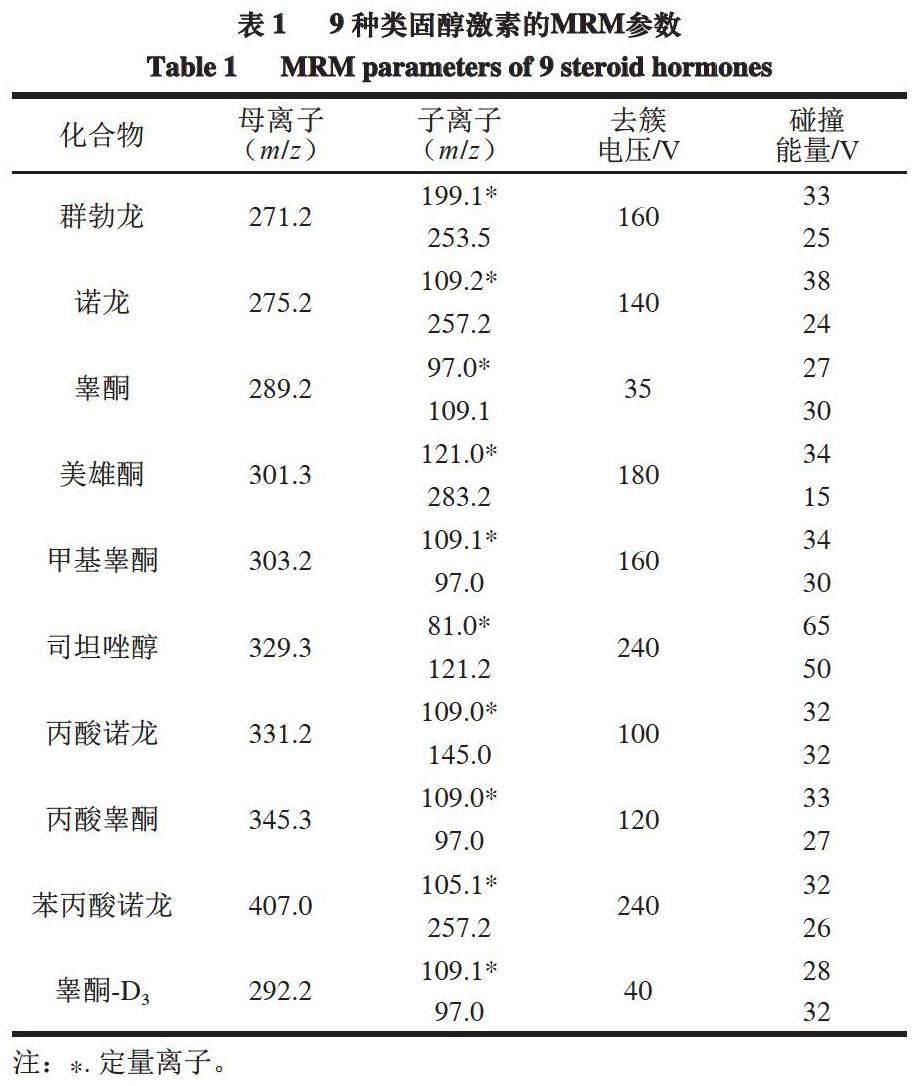
部分类固醇激素在动物体内以结合态存在,酶解可促进类固醇激素水解成游离态,从而提高样品中类固醇激素的提取效率。类固醇激素属于脂溶性化合物,极性较弱,难溶于水,易溶于极性有机溶剂。类固醇激素的常用提取溶剂为叔丁基甲醚、乙酸乙酯、乙腈、甲醇[26-30]等,考察上述4 种试剂对9 种类固醇激素的提取效果。
由图1可知,乙酸乙酯和叔丁基甲醚作为提取溶剂时的回收率较低,不及甲醇和乙腈。但甲醇作为提取溶剂时,提取溶液浑浊,乙腈作为提取溶剂时,可有效去除猪肉和牛肉基质中的蛋白质,故选用乙腈用作提取溶剂。
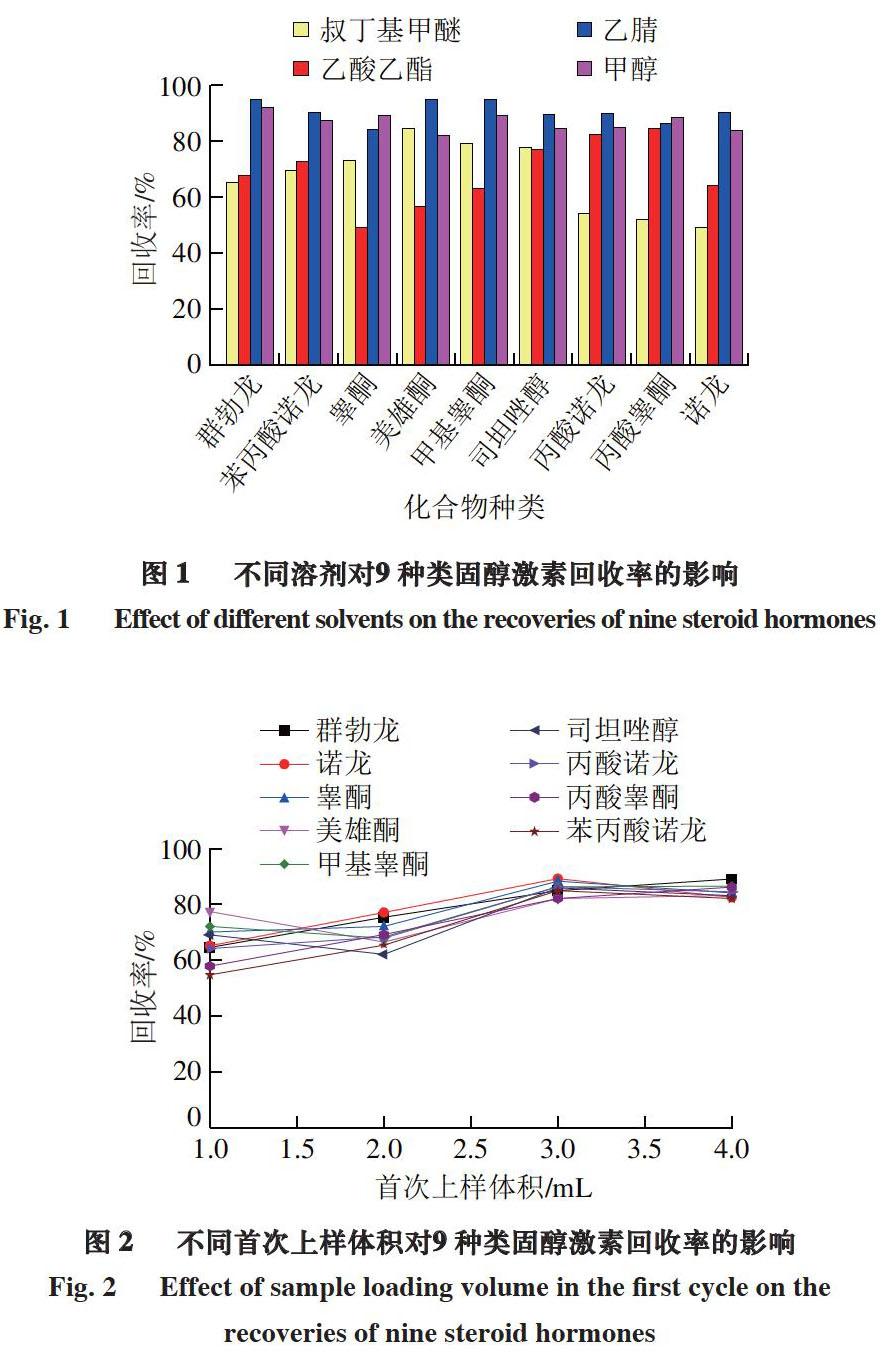
PRiME HLB通过式固相萃取小柱可以将猪肉和牛肉基质中的脂肪等干扰物去除,且操作简单,适用于大批量猪肉和牛肉样品中类固醇激素的检测。比较吸取不同体积(1、2、3、4 mL)上清液通过PRiME HLB固相萃取柱并弃去,再取1 mL上清液通过小柱并收集流出液的净化效果。
由图2可知:首次上样体积为1、2 mL时,再取1 mL上清液,收集得到的流出液中目标物回收率较低,这可能是由于此体积下,固相萃取小柱对分析物的吸附未达到饱和,小柱对分析物的吸附造成回收率偏低;首次上样体积为3、4 mL时,再取1 mL上清液,收集得到的流出液中目标物回收率大致相同。考虑到随着上样体积的增加,固相萃取小柱对样品的净化效果可能变差,故选择首次上样体积为3 mL。
2.2 色谱条件的优化
考察9 种类固醇激素在Waters Acquity BEH C18色谱柱(2.1 mm×100 mm,2.5 μm)、Thermo Accucorea Q C18色谱柱(2.1 mm×100 mm,2.6 μm)、Hypersil Gold C18色谱柱(2.1 mm×100 mm,1.9 μm)上的峰型,结果显示,采用Waters Acquity BEH C18色谱柱(2.1 mm×100 mm,2.5 μm)得到的9 种类固醇激素峰型最佳,尖锐且对称。故选择Waters Acquity BEH C18色谱柱(2.1 mm×100 mm,2.5 μm)。
考察水-甲醇、水-乙腈、体积分数0.1%甲酸水溶液-乙腈体系作为流动相时,9 种类固醇激素的色谱峰峰型和信号响应情况。结果表明:使用水-乙腈体系作为流动相得到的色谱峰峰型优于水-甲醇体系,且柱压较低;相比于水-乙腈体系,使用体积分数0.1%甲酸水溶液-乙腈体系作为流动相时9 种类固醇激素的峰面积变大,稳定性也较好。这是由于在正离子模式条件下,加入甲酸能促进待测物离子化,从而提高信号强度。故选用体积分数0.1%甲酸水溶液-乙腈作为流动相。
2.3 质谱参数的优化
通过流动注射泵连续进样的方式,将10 种化合物标准溶液(100 ng/mL)以5 μL/min的速率直接注入质谱仪中,分别采用正离子(ESI+)和负离子(ESI-)模式對目标物进行全扫描,最终确定采用正离子(ESI+)模式。在ESI+模式下对目标物进行Q1 MS一级全扫描,确定母离子,对母离子进行Production二级扫描,确定定量子离子和定性子离子,再选择MRM模式,优化去簇电压、碰撞能量等质谱参数。优化条件下目标物的MRM色谱图如图3所示。
2.4 方法的线性关系、检出限和定量限
准确吸取9 种激素混合标准中间溶液和内标中间溶液,用乙腈配制系列标准溶液,内标质量浓度为10 ng/L,采用空白基质加标的方法确定方法的检出限和定量限,信噪比RS/N=3和RS/N=10时对应的质量浓度分别作为检出限和定量限。
由表2可知,9 种类固醇激素在0.2~100.0 ng/mL质量浓度范围内线性关系良好,相关系数(R2)≥0.999 0,检出限为0.2~0.5 μg/kg,定量限为0.4~1.0 μg/kg。
2.5 加标回收率
在空白猪肉和牛肉基质中添加9 种类固醇激素进行加标回收率实验,共添加3 个水平,每个水平重复测定6 次。由表3可知,9 种类固醇激素在猪肉基质中加标回收率为84.5%~117.3%,相对标准偏差(relative standard deviation,RSD)为0.49%~6.29%,在牛肉基质中加标回收率为84.9%~112.9%,RSD为0.79%~7.01%。
2.6 实际样品测定
应用本研究建立的方法对市场采购的20 批次猪肉和牛肉样品进行检测,检测结果均为阴性。
3 结 论
本研究基于通过式固相萃取-超高效液相色谱-串联质谱技术,建立猪肉和牛肉中9 种类固醇激素的检测方法,酶解后的样品经乙腈提取后,采用PRiME HLB通过式固相萃取小柱净化,用超高效液相色谱-串联质谱结合内标法校正。结果表明,该方法前处理提取率高,条件易于控制,方法灵敏度高,重复性好,适用于猪肉和牛肉中9 种类固醇激素的检测,也可为其他动物源性食品及化妆品中类固醇激素含量的测定提供参考。
参考文献:
[1] 孙汉文, 康占省, 李挥. 凝胶渗透色谱-固相萃取净化-超快速液相色谱-串联质谱法检测牛肉中9 种类固醇激素残留[J]. 分析化学, 2010, 38(9): 1272-1276. DOI:10.3724/SP.J.1096.2010.01272.
[2] 蔡勤仁, 冯家望, 张毅, 等. 液相色谱-串联质谱结合谱库检索法同时测定猪组织中12 种类固醇激素[J]. 色谱, 2011, 29(8): 712-717. DOI:10.3724/SP.J.1123.2011.00712.
[3] 韩超男, 李秀琴, 逯海, 等. 同位素稀释超高效液相色谱-串联质谱法检测牛奶中类固醇激素[J]. 食品安全质量检测学报, 2018, 9(7): 1669-1675. DOI:10.3969/j.issn.2095-0381.2018.07.035.
[4] 孙利东, 许秀丽, 袁飞, 等. 高效液相色谱-串联质谱法测定牛奶和鸡肉中4 种激素本底值[J]. 食品科学, 2017, 38(22): 291-297. DOI:10.7506/spkx1002-6630-201722043.
[5] REGAL P, V?ZQUEZ B I, FRANCO C M, et al. Quantitative LC-MS/MS method for the sensitive and simultaneous determination of natural hormones in bovine serum[J]. Journal of Chromatography B, 2009, 877(24): 2457-2464. DOI:10.1016/j.jchromb.2009.06.025.
[6] KUSHNIR M M, ROCKWOOD A L, ROBERTS W L, et al. Liquid chromatography tandem mass spectrometry for analysis of steroids in clinical laboratories[J]. Clinical Biochemistry, 2011, 44(1): 77-88. DOI:10.1016/j.clinbiochem.2010.07.008.
[7] GRIPPA E, SANTINI L, CASTELLANO G, et al. Simultaneous determination of hydrocortisone, dexamethasone, indomethacin, phenylbutazone and oxyphenbutazone in equine serum by high-performance liquid chromatography[J]. Journal of Chromatography B, 2000, 738: 17-25. DOI:10.1016/S0378-4347(99)00478-8.
[8] AMENDOLA L, GARRIBA F, BOTRE F. Determination of endogenous and synthetic glucocorticoids in human urine by gas chromatography-mass spectrometry following microwave-assisted derivatization[J]. Analytica Chimica Acta, 2003, 489: 233-243. DOI:10.1016/S0003-2670(03)00703-7.
[9] 陈晓鹏, 顾采琴, 綦艳, 等. QuEChERS-UPLC-MS/MS同时测定牛奶和奶粉中42 种类固醇激素[J]. 食品科学, 2018, 39(8): 314-321. DOI:10.7506/spkx1002-6630-201808049.
[10] 王飞, 宓捷波, 葛含光. 超高压液相色谱-串联质谱法快速测定牛肉、牛肾中3 种甾类同化激素药物残留量[J]. 质谱学报, 2019, 40(1): 91-97. DOI:10.7538/zpxb.2018.0081.
[11] 邹红梅, 左舜宇, 黄东仁, 等. 高效液相色谱-串联质谱法同时测定水产品中雄激素和糖皮质激素残留[J]. 中国渔业质量与标准, 2016, 6(2): 45-50.
[12] 张学亮, 罗云敬, 路勇, 等. 超高效液相色谱-串联四极杆质谱法同时测定牛肉与牛奶中20 种性激素残留[J]. 分析测试学报, 2015, 34(4): 388-394. DOI:10.3969/j.issn.1004-4957.2015.04.003.
[13] TAN Xintong, LI Zengmei, DENG Ligang, et al. Analysis of 13 kinds of steroid hormones in raw milk using modified QuEChERS method combined with UPLC-QTOF-MS[J]. Journal of Integrative Agriculture, 2016, 15(9): 2163-2174. DOI:10.1016/S2095-3119(16)61386-2.
[14] GUO Ning, LIU Ping, DING Jun, et al. Stable isotope labeling-liquid chromatography/mass spectrometry for quantitative analysis of androgenic and progestagenic steroids[J]. Analytica Chimica Acta, 2016, 905: 106-114. DOI:10.1016/j.aca.2015.12.010.
[15] WOZNIAK B, MATRASZEK-ZUCHOWSKA I, ZMUDZKI J. LC-MS/MS fast analysis of androgenic steroids in urine[J]. Analytical and Bioanalytical Chemistry, 2012, 403(10): 2965-2972. DOI:10.1007/s00216-012-5859-0.
[16] KAKLAMANOS G, THEODORIDIS G A, DABALIS T, et al. Determination of anabolic steroids in bovine serum by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography B, 2011, 879(2): 225-229. DOI:10.1016/j.jchromb.2010.11.029.
[17] 牛晉阳, 孙焕, 李莹莹. 高效液相色谱-串联质谱法测定猪肉中10 种类固醇类激素残留[J]. 食品科学, 2010, 31(4): 230-232. DOI:10.7506/spkx1002-6300-201004053.
[18] 刘宏程, 李宁, 林涛, 等. 基质固相分散-超高效液相色谱-质谱检测器测定牛奶中9 种类固醇激素残留[J]. 色谱, 2015, 33(11): 1163-1168. DOI:10.3724/SP.J.1123.2015.06035.
[19] 徐锦忠, 张晓燕, 丁涛, 等. 高效液相色谱-串联质谱法同时检测鸡肉和鸡蛋中合成类固醇类激素和糖皮质激素[J]. 分析化学, 2009, 37(3): 341-346. DOI:10.3321/j.issn:0253-3820.2009.03.006.
[20] 张爱芝, 王全林, 沈坚, 等. 超高效液相色谱-串联质谱法同时测定鱼制品中残留的7 种性激素[J]. 色谱, 2010, 28(2): 190-196.
[21] GOYON A, CAI J Z, KRAEHENBUEHL K, et al. Determination of steroid hormones in bovine milk by LC-MS/MS and their levels in Swiss Holsterin cow milk[J]. Food Additives and Contaminants: Part A, 2016, 33(5): 804-816. DOI:10.1080/19440049.2016.1175186.
[22] GUO T, TAYLOR R L, SINGH R J, et al. Simultaneous determination of 12 steroids by isotope dilution liquid chromatography-photospray ionization tandem mass spectrometry[J]. Clinica Chimica Acta, 2006, 372(1): 76-82. DOI:10.1016/j.cca.2006.03.034.
[23] 北京市疾病预防控制中心, 中国疾病预防控制中心营养与食品安全所, 中国检验检疫科学研究院. 动物源性食品中激素多残留检测方法 液相色谱-质谱/质谱法: GB/T 21981—2008[S]. 北京: 中国标准出版社, 2008.
[24] 华中农业大学, 北京市食品安全监控中心, 河南省兽药监察所, 等. 动物源性食品中糖皮质激素类药物多残留检测 液相色谱-串联质谱法: 农业部1031号公告-2-2008[S]. 北京: 中国标准出版社, 2008.
[25] 华南农业大学, 上海市兽药饲料检测所, 北京市食品安全监控中心, 等. 动物源性食品中11 种激素残留检测 液相色谱-串联质谱法: 农业部1031号公告-1-2008[S]. 北京:中国标准出版社, 2008.
[26] 冯月超, 贾丽, 王建凤, 等. 超高效液相色谱-质谱联用法检测鱼肉中23 种性激素残留量[J]. 食品安全质量检测学报, 2018, 9(16): 4417-4426.
[27] 曾文灿, 关文瑜, 林应椿. 超高效液相色谱-串联质谱法分析测定鱼肉中性激素多残留的研究[J]. 海峡药学, 2013, 25(8): 51-55. DOI:10.3969/j.issn.1006-3765.2013.08.019.
[28] 杨帆, 莫文电, 段玉林, 等. 超高效液相色谱-串联质谱法测定水产品及其制品中3 种抗生素和14 种性激素残留量[J]. 食品安全质量检测学报, 2019, 10(8): 2247-2257. DOI:10.3969/j.issn.2095-0381.2019.08.025.
[29] 陈秋华, 张天闻, 傅红, 等. 超高效液相色谱-四极杆飞行时间质谱法快速筛查水产品中16 种激素残留[J]. 食品科學, 2018, 39(20): 337-343. DOI:10.7506/spkx1002-6630-201820049.
[30] 张云伟, 黄优生, 胡海山, 等. 液相色谱-串联质谱法快速测定乳制品中5 种激素残留[J]. 分析科学学报, 2018, 34(1): 119-122. DOI:10.13526/j.issn.1006-6144.2018.01.024.
