测定肉串源性成分的液相色谱-串联质谱与聚合酶链式反应方法对比研究
2020-09-14张颖颖李莹莹范维齐婧李慧晨王守伟
张颖颖 李莹莹 范维 齐婧 李慧晨 王守伟


摘 要:采用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)与聚合酶链式反应(polymerase chain reaction,PCR)方法分别对北京市场中的200 个烤肉串样品进行源性成分分析。其中PCR方法按照出入境标准进行操作,LC-MS/MS方法为自建方法,原理是基于测定物种的特异性多肽链进行物种鉴别。结果表明:2 种检测方法所得到的结果一致,肉串总体掺假比例为21%,其中羊肉串掺假比例为28%,牛肉串掺假比例为14%,主要掺假物种为猪和鸭;通过大批量样品实验对比,LC-MS/MS方法的准确性更高,实验操作也更为简便、耗时短、成本低,可用于日常食品的肉源性成分检测。
关键词:肉串;聚合酶链式反应;液相色谱-串联质谱;肉源性成分
Abstract: In this paper, liquid chromatography-tandem mass spectrometry (LC-MS/MS) and polymerase chain reaction (PCR) were comparatively used to analyze the animal species of 200 samples of meat skewer sold in the Beijing market. The PCR method was operated in accordance with the entry and exit inspection and quarantine standards, and the LC-MS/MS method was established in our laboratory based on the determined species-specific peptides. The results obtained by the two methods were exactly consistent with each other. The adulteration rate of the meat skewers was 21%, and 28% of lamb skewers and 14% of beef skewers were found to be adulterated. The main adulterants were pig- and duck-derived ingredients. This study further showed that the LC-MS/MS method had the advantages of higher accuracy, easier operations, shorter time consumption, and lower cost than PCR. It can be used for the detection of the animal species of common meat products.
Keywords: meat skewer; polymerase chain reaction; liquid chromatography-tandem mass spectrometry; animal species
DOI:10.7506/rlyj1001-8123-20200512-119
中圖分类号:TS207.3 文献标志码:A 文章编号:1001-8123(2020)07-0070-08
引文格式:
张颖颖, 李莹莹, 范维, 等. 测定肉串源性成分的液相色谱-串联质谱与聚合酶链式反应方法对比研究[J]. 肉类研究, 2020, 34(7): 70-77. DOI:10.7506/rlyj1001-8123-20200512-119. http://www.rlyj.net.cn
ZHANG Yingying, LI Yingying, FAN Wei, et al. Comparison of liquid chromatography-tandem mass spectrometry and polymerase chain reaction for determination of the animal species of meat skewers[J]. Meat Research, 2020, 34(7): 70-77. DOI:10.7506/rlyj1001-8123-20200512-119. http://www.rlyj.net.cn
目前,食品掺假已成为全球性问题,涉及多个食品种类,包括肉类食品[1]、血液[2]、阿胶[3]、乳制品[4]、水产品[5]等。最为常见的掺假方式是经济利益驱动的掺假,即用低价原料替代高价原料。烧烤如今已成为一种休闲娱乐方式,由于牛羊肉价格较高,商家常用鸭肉、猪肉、鸡肉来替代。掺假羊肉串多采用鸭肉,因其肉色更加接近羊肉,呈暗红色,将鸭肉在羊油中浸泡一段时间,可以得到与羊肉外观相似的假羊肉。也有部分商户用猪肉来炮制“假肉串”,但新鲜猪肉的色泽呈鲜红色,在造假过程中,商贩们会选择利用红曲红、番茄红等天然色素,甚至是胭脂红等合成色素来调配“假肉串”的外观颜色,而食用过量色素将会损害人体生殖系统和神经系统,对肝脏代谢也会造成阻碍。目前测定食品掺假的主要方法包括酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)、聚合酶链式反应(polymerase chain reaction,PCR)、质谱等方法。ELISA方法是基于抗原与抗体特异性结合进行测定[6-7],但由于蛋白质在加工过程中易发生变性,且物种间易产生交叉反应[8],因此该方法的准确性有待进一步提升。PCR方法是目前应用最广的肉类掺假检测方法,该方法通过扩增物种基因来进行判定,准确性高、灵敏度强。随着国内外大量研究的进行,PCR技术也在不断发展,如双重液滴数字PCR[9-10]检测技术可以同时识别和量化样品中所含的牛肉、猪肉等。此外,检测靶标基因也不断优化改进,已建立基于COⅠ基因[11]的基因条码检测技术,实现对肉制品中牛、猪、羊、鸭源性成分的鉴别。基于哺乳动物线粒体基因[12],构建了马、牛、猪、鸭四重PCR体系。但是PCR方法也存在一系列问题,如对于深加工肉制品而言,DNA易降解[13-14],易受环境污染等。质谱法通过测定不同物种的特异性多肽链进行物种鉴别,相比于DNA序列,蛋白质的氨基酸序列在肉制品加工过程中更加稳定[15],此外质谱法的操作性强、准确性高,可同时测定多个物种,在猪[16]、牛[17]、鸡[18]、马[19]、鸭[20]、羊[21]等加工产品中表现出更好的鉴别能力,因此在食品掺假检测方面被广泛研究与应用。Orduna等[22]使用四极杆轨道阱质谱测定肌红蛋白、肌球蛋白-1、肌球蛋白-2和β-血红蛋白中的标记肽,鉴别肉制品中的猪、马、牛、羊源性成分。Motta等[23]使用酪蛋白多肽作为生物标记物测定牛乳掺假。Yang等[24]使用高分辨率质谱分析溶解在碳酸氢铵缓冲液中并用胰蛋白酶酶解的明胶样品,通过结合使用高分辨质谱与串联质谱分析,检测和鉴定猪Ⅰ型胶原多肽,结果表明该方法灵敏度高,检出限低至0.1%。Prandi等[25]从α2-胶原蛋白链中提取出针对牛、猪的生物标记肽,利用超高效液相色谱-串联质谱技术测定肉酱中牛、猪源性成分的含量。Montowska等[26]建立了一种液体萃取表面分析质谱方法,用以测定肉制品中牛、猪、马、鸡和火鸡源性成分。
本研究针对当前肉串市场的掺假现象,分析北京烧烤市场中的大量样品,样品来源包括小吃店、餐厅、市场、超市等多个環节,涉及16 个区县、共200 份样品,对比采用2 种方法对所有样品进行肉串源性成分鉴别:基于蛋白质组学的液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)方法和基于相关标准的PCR检测方法。其中LC-MS/MS方法是本研究建立的物种鉴别方法,该方法先利用Thermo Q Exactive HF-X液相色谱四极杆静电场轨道阱高分辨质谱及Proteome Discoverer(PD)软件进行物种特异性多肽链的筛选,通过进一步数据转化分析,建立测定猪、牛、羊、鸡、鸭源性成分的LC-MS/MS方法。每份样品均采用2 种方法进行测定,通过对比实验操作过程及结果分析,进一步验证LC-MS/MS方法的准确性及可操作性。
1 材料与方法
1.1 材料与试剂
于北京市场购置羊肉串100 份、牛肉串100 份,涉及昌平区、大兴区、朝阳区、东城区、房山区、丰台区、海淀区、怀柔区、门头沟区、密云区、平谷区、石景山区、顺义区、西城区、延庆区、通州区16 个区县的农贸市场、超市、餐馆、小吃摊等多个流通领域,包括生、熟制品。样品购置后用均质器搅碎混匀,均分为2 批 ,一批用于PCR方法检测;另一批用于LC-MS/MS方法检测。
组织基因组DNA提取试剂盒 广州迪奥生物科技有限公司;2×PCR Premix Ex TaqTM 大连宝生物科技有限公司;2×Taq PCR MasterMix(含染料) 大连索莱宝生物科技有限公司;DNA Marker Ⅱ 天根生化科技(北京)有限公司;胰蛋白酶(测序级)、二硫苏糖醇(dithiothreitol,DTT)(生化级) 美国Promega公司;碘乙酰胺(iodoacetamide,IAA)、三氟乙酸(trifluoroacetic acid,TFA)(生化级) 美国Sigma公司;甲酸、乙酸、乙腈(色谱纯) 德国Merck公司;HLB固相萃取柱 美国Waters公司;尿素、硫脲、盐酸(分析纯) 国药集团化学试剂(上海)有限公司。
1.2 仪器与设备
FTC-3000P实时荧光PCR仪 加拿大Funglyn公司;TC-5000 PCR仪 北京瑞尔欣德科技有限公司;D30微量核酸蛋白测定仪 美国Bio-Tek公司;3-30K台式高速冷冻离心机 德国Sigma公司;DK-80恒温金属浴 上海一恒仪器有限公司;Thermostat plus振荡器、Q Exactive HF-X液相色谱四极杆静电场轨道阱高分辨质谱系统(配有电喷雾离子源)、TSQ超高效液相色谱-串联质谱仪(配有电喷雾离子源) 美国Thermo公司;固相萃取装置 美国Agilent公司;CR22N高速冷冻离心机 日本Hitachi公司。
1.3 方法
1.3.1 PCR方法
PCR检测方法采用现有标准方法。猪、牛、羊源性成分的测定:参照SN/T 2051—2008《食品、化妆品和饲料中牛羊猪源性成分检测方法 实时PCR法》[27];鸡源性成分的测定:参照SN/T 2978—2011 《动物源性产品中鸡源性成分PCR检测方法》[28];鸭源性成分的测定:参照SN/T 3731.5—2013《食品及饲料中常见禽类品种的鉴定方法 第5部分:鸭成分检测 PCR法》[29]。DNA提取按照试剂盒说明书进行;引物探针来自各标准,由上海英潍捷基科技有限公司合成。详细实验操作过程及反应程序见各标准。
1.3.2 LC-MS/MS方法
1.3.2.1 样品制备
根据前期实验[30-31],将样品前处理过程分为蛋白提取、酶解、净化3 个步骤,具体操作简述如下:准确称取2 g均质后样品,加入20 mL蛋白提取溶液(含7 mol/L尿素、2 mol/L硫脲、0.05 mol/L Tris-HCl,pH 8.0),均质,12 000 r/min离心20 min;取200 ?L上清液于4 mL离心管中,加入20 ?L 5 mmol/L DTT溶液,56 ℃反应1 h;加入23 ?L 100 mmol/L IAA溶液,暗处反应0.5 h;加入28 ?L 5 mmol/L DTT溶液,暗处反应15 min;加入1.8 mL稀释溶液(25 mmol/L Tris-HCl,pH 8.0),混匀后,加入50 ?L 1.0 mg/mL胰蛋白酶溶液,37 ℃过夜反应;酶解反应结束后,加入适量体积分数5%的TFA水溶液,使得溶液pH值小于2.0,以终止酶解反应;将样品上样至已活化的C18固相萃取柱(分别用乙腈、体积分数50%乙腈水溶液、体积分数0.1% TFA水溶液活化),分别用体积分数0.1% TFA水溶液、体积分数0.5%乙酸淋洗,用2 mL乙腈-0.5%乙酸(60∶40,V/V)洗脱,过0.22 ?m滤膜后上机。
1.3.2.2 LC-MS/MS分析
色谱条件:Hypersil GOLD C18色谱柱(2.1 mm×100 mm,1.9 μm);流速0.2 mL/min;柱温40 ℃;进样量10 ?L;流动相A:体积分数0.1%甲酸-水溶液,流动相B:体积分数0.1%甲酸-乙腈。梯度洗脱程序:0.0~0.2 min,97%~90%流动相A;0.2~16.0 min,90%~60%流动相A;16.0~17.0 min,60%~20%流动相A;17.0~17.5 min,20%流动相A;17.5~18.5 min,20%~97%流动相A;18.5~25.0 min,97%流动相A。
质谱条件:喷雾电压3 500 V;鞘气流速38 arb;辅助气流速15 arb;离子传输管温度275 ℃;离子源雾化温度380 ℃;碰撞气压力0.199 5 Pa(1.5 mTorr);Q1和Q3分辨率均为0.7。
利用TraceFinder软件进行数据处理,对各个样品进行多重反应监测(multiple reaction monitoring,MRM)模式扫描,通过比对各个物种的离子对信息,如保留时间、离子比率等,进行物种鉴别。为确保方法的准确性,每个物种选择3 条特异性多肽,每条多肽选择3 个子离子进行判定。该方法的离子对信息如表1所示。
2 结果与分析
2.1 PCR方法测定肉串源性成分的分析过程
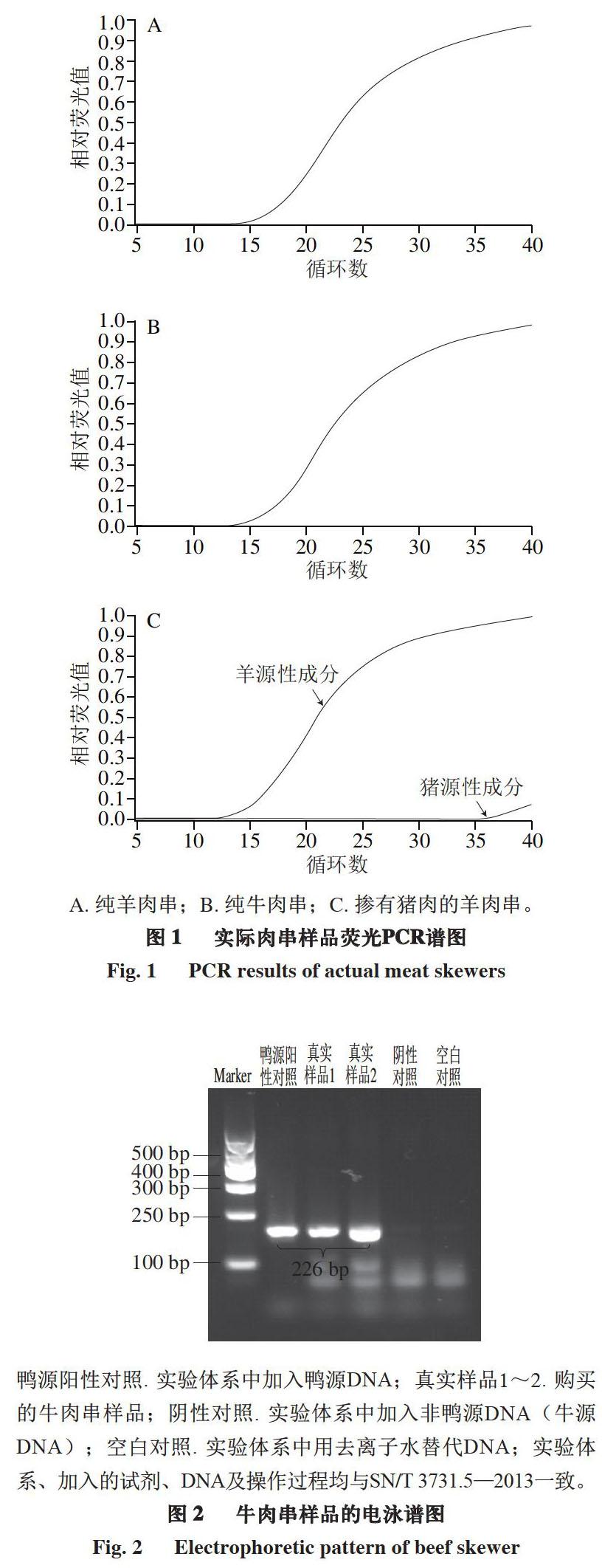
对于猪、牛、羊源性成分的检测,主要采用荧光定量PCR法,根据样品测定的循环阈(cycle threshold,Ct)值进行结果判定。由标准SN/T 2051—2008可知,在进行实时荧光定量PCR检测时,需设定阳性、阴性及空白对照。当满足质控标准时,才可进行样品结果判定。具体质控标准为:阴性对照:有HEX荧光信号检出,并出现典型扩增曲线,Ct值应小于28.0,无FAM荧光信号检出;阳性对照:有FAM和HEX荧光信号检出,并出现典型扩增曲线,Ct值应小于28.0。具体判定标准为:如果同时进行的阴性、阳性对照实验结果正常,检测样品时,不论HEX荧光信号是否检出,如果有FAM荧光信号检出,且Ct值≤35,判定为含有牛、猪、羊源性成分;如果Ct值>35,判定为不含有牛、猪、羊源性成分。部分实际样品检测结果见图1。
对于鸡、鸭源性成分检测,主要采用PCR法,根据样品凝胶电泳条带及PCR产物测序情况进行结果判定。由标准SN/T 2978—2011可知,在阳性对照组出现131 bp的条带,阴性对照组无该条带出现、空白对照组无条带出现时,视为该实验成立。在实验成立前提下,样品出现131 bp左右的扩增产物则判定为结果阳性,否则为阴性。将可疑阳性PCR扩增产物进行核酸系列测定,与GenBank中鸡线粒体DNA相对应片段的序列进行比对,同源性达到98%以上,则含有鸡源性成分。同理,标准SN/T 3731.5—2013规定,鸭源性成分对应条带为226 bp。牛肉串样品检测结果见图2,由电泳图可知,样品中只含有鸭源性成分。
鸭源阳性对照. 实验体系中加入鸭源DNA;真实样品1~2. 购买的牛肉串样品;阴性对照. 实验体系中加入非鸭源DNA(牛源DNA);空白对照. 实验体系中用去离子水替代DNA;实验体系、加入的试剂、DNA及操作过程均与SN/T 3731.5—2013一致。
2.2 LC-MS/MS方法測定肉串源性成分的分析过程
MS检测方法通过筛选各物种之间的差异蛋白质氨基酸序列,即各物种的相对特异性多肽链,转化为离子对信息后,进而应用至LC-MS/MS中进行样品检测。其中筛选物种特异性多肽链是检测的关键步骤,直接影响最终结果的准确性。
2.2.1 物种特异性多肽链的筛选
收集猪、牛、羊、鸡、鸭纯物种肉,经1.3.2.1节样品制备后,进行高分辨质谱分析。本研究采用Thermo Q Exactive HF-X液相色谱四极杆静电场轨道阱高分辨质谱进行数据采集,其液相色谱条件与1.3.2.2节LC-MS/MS分析时所采用的条件相同,质谱条件采用Full MS-ddMS2扫描方式,喷雾电压3 400 V,毛细管温度320 ℃,鞘气流速40 arb,辅助气流速15 arb,Full Scan分辨率120 000,扫描质量范围m/z 350~2 000,AGC值3×106,IT时间100 ms,二级扫描topN为10,分辨率30 000,AGC值2×105,IT时间50 ms,NCE设为30。
将质谱采集的数据导入至蛋白质组学处理软件Proteome Discoverer(PD)软件,通过该软件寻找各物种之间的多肽差异。PD软件处理数据有2 个工作流,分别为Processing step和Consensus step,2 个工作流中的参数均可按照默认参数进行设置。Processing step中需要上传所要筛选物种的蛋白质数据库,可通过搜索UniProt数据库(https://www.uniprot.org/),下载相应物种的蛋白质数据库fasta文件,导入至PD软件后,即可运行程序,得到各物种筛选的多肽数据。通过这种方式得到猪蛋白1 111 条、多肽2 437 条,牛蛋白1 173 条、多肽2 812 条,羊蛋白524 条、多肽2 150 条,鸡蛋白566 条、多肽2 107 条,鸭蛋白578 条、多肽2 419 条。由于这5 个物种是研究比较成熟的物种,所以蛋白质数据库信息比较完善、全面,由此所得到的物种蛋白信息比较繁杂,因此还需要对搜索参数进一步优化,从而能够快速寻找物种多肽序列之间的差异。
在寻找物种间多肽差异的过程中,以下几个因素对筛选结果有较明显的影响:1)肽段长度,肽段越短,物种多肽匹配的错误率就越高,故设置多肽长度>7;2)置信度,与物种多肽确定的可靠性有关,将筛选物种设置为High,其他物种设置为Not Found;3)响应强度,质谱在进行数据采集时,易出现离子抑制效应,因此响应强度高的多肽受到的影响相对较小,多肽的响应强度设置为>107,并选择响应强度最高的电荷下的母离子;4)覆盖率,表示由多肽匹配至蛋白质时的准确度,覆盖率越高,准确度越高,设置覆盖率>50%。通过上述参数的设置可以明显筛除90%的多肽序列,进一步简化后续筛选过程。再将所得到的多肽进行Blast序列匹配,进一步确保多肽的物种唯一性。最终得到猪蛋白35 条、多肽64 条,牛蛋白19 条、多肽35 条,羊蛋白15 条、多肽21 条,鸡蛋白18 条、多肽47 条,鸭蛋白17 条、多肽34 条。
2.2.2 筛选适用于LC-MS/MS分析的物种多肽标记物
高分辨质谱的分辨率较高,可精确测定至分子质量的小数点后4 位,能够准确推断分子的结构式,因此用高分辨质谱筛选物种特异性多肽。LC-MS/MS属于低分辨率质谱,但仪器的MRM扫描模式可通过准确测定一级离子与二级离子同时判定化合物的存在,这大大降低了基质干扰的影响,定性、定量更为准确,因此LC-MS/MS的适用性更广。在本研究中,将高分辨质谱所筛选的物种特异性多肽信息转换为离子对信息,应用至LC-MS/MS中,创建更为准确、便捷的方法。
高分辨质谱采集数据时,采用的是Full MS-ddMS2扫描模式,因此可以通过查看多肽的二级谱图,按照响应强度的大小选择每个母离子下的多个二级子离子,转化为相应的MRM信息,应用至LC-MS/MS中。但由于2 种质谱的分辨率、扫描速率、采集方式等参数存在差异,因此导入至LC-MS/MS中的多肽离子信息还需进一步筛选,通过对比每个子离子的峰形、保留时间、响应强度等参数,选择适用于LC-MS/MS的多肽信息。为确保物种判定的准确性,每个物种选择3 条特异性多肽,每条多肽保留3 个子离子信息进行判定。最终各物种所筛选的特异性多肽详细信息如表2所示。图3展示了部分实际样品的提取离子流图。
2.3 肉串测定结果及分析
分别采用PCR方法及LC-MS/MS方法对北京市场购置的200 个烤肉串样品进行源性成分检测,所得到的结果一致。由表3可知,共有42 个样品存在样品信息与测定结果不符的现象,掺假率为21%,其中羊肉串掺假28 例,占比28%,牛肉串掺假14 例,占比14%。其中26 例掺假样品中的掺假物种为猪,15 例掺假物种为鸭,1 例牛肉串的掺假物种为羊,所使用的掺假物种与物种本身的形态、气味、价格、易获取程度均有关系。
2.4 LC-MS/MS方法的灵敏度
业内普遍共识认为,物种掺假量低于1%时,不属于人为刻意摻假[32]。为确保该方法满足此条件,进行物种掺假实验设计。模拟样品1:分别准确称取0.1 g猪肉、牛肉、鸡肉、鸭肉及10 g羊肉,均质混匀;模拟样品2:分别准确称取0.1 g猪肉、羊肉、鸡肉、鸭肉及10 g牛肉,均质混匀。经上述LC-MS/MS方法测定。由图4可知,所有掺入物种均不受其他物种基质的影响,因此该方法适用于测定物种掺假量低于1%的食品。
3 讨 论
基于靶标多肽进行物种真伪鉴别的方法是近年来的研究热点,目前国内针对物种鉴定的标准所采用的方法绝大多数是PCR方法,仅在《中国药典》(2015年版)鉴定阿胶真伪中增加了肽图分析,采用高相液相色谱-质谱联用检测离子m/z 539.8,对阿胶进行定性鉴别[33]。
此外,分析总结国内外相关研究,该类方法均采用的是鸟枪法蛋白组学方法,整个实验方法流程如图5所示,纯物种样品经蛋白提取、酶解等处理过程,经高分辨质谱及相应软件进行靶标多肽的筛选,转换为相应的离子信息应用至LC-MS/MS中进行物种鉴别。在分析过程中,不同实验室采用了不同方式进行最终物种鉴别。Montowska等[32]针对牛肉汉堡中添加的功能性粉末制剂进行鉴别,利用高分辨质谱对大豆、豌豆、牛乳及甜菜根中的靶标多肽进行筛选,并对市场中的熟牛肉汉堡进行检测。相对而言,LC-MS/MS的抗基质干扰能力使其在定量方面可测出更低的源性成分,且普及度更高,因此采用LC-MS/MS方法进行物种鉴别更为方便,相关研究也较多。部分研究针对某一特定蛋白进行明确的多肽分析,Magdalena等[34]利用环境解吸电喷雾质谱和液相萃取表面分析质谱对原料肉中骨骼肌蛋白质进行鉴定分析,通过物种特异性多肽可以明确区分牛肉、马肉、猪肉、鸡肉和火鸡肉。Giaretta等[35]以肌红蛋白作为标记蛋白,利用超高效液相色谱技术区分牛、猪、鸡、马等多个物种,并且可以测定肉糜中质量分数5%的猪肉或牛肉。此外,关于源性成分的研究也扩展至其他的非肉物种鉴别,Hoffmann等[36]针对肉类食品中使用的植物蛋白羽扇豆、豌豆及大豆进行测定,每个物种筛选3~4 个标记物,建立相应的高效液相色谱-串联质谱法,该方法的检出限为豌豆蛋白约5 mg/kg、大豆蛋白约4 mg/kg、羽扇豆蛋白约2 mg/kg。Montowska等[37]利用液相色谱串联四极杆飞行时间质谱对肉制品中的大豆、牛乳及蛋清蛋白进行分析,分别选取43 个大豆多肽、9 个牛乳多肽及12 个蛋清多肽作为标记物,以鉴别禽肉产品中是否存在大豆、牛乳、蛋清等过敏性蛋白。
本研究利用鸟枪蛋白组学方法,首先通过高分辨质谱及相应的蛋白组学软件筛选猪、牛、羊、鸡、鸭5 个物种的特异性多肽信息,经相应的信息转化及进一步筛选,最终建立可以准确测定物种源性成分质量分数低于1%的LC-MS/MS方法,并通过大量的市场样本进行方法验证,且同时采用目前成熟的PCR方法进行验证比对,2 种方法所得到的结果一致,也进一步证明LC-MS/MS方法鉴别物种的准确性较高。从实验操作方面考虑,在测定大批量实验样品时,相对于PCR方法,LC-MS/MS方法的实验过程更为简便,可通过一次性实验操作测定多个物种,耗时更短,操作更为便捷,并且成本更低,可用于日常食品的掺假检测。
4 结 论
分别通过PCR方法及LC-MS/MS方法对北京市场中的200 个肉串进行源性成分分析。其中PCR方法采用出入境标准进行测定,LC-MS/MS方法通过测定物种特异性多肽链信息进行物种鉴别。结果表明:2 种方法所得到的结果一致,肉串掺假比例为21%,其中羊肉串掺假比例为28%,牛肉串掺假比例为14%,掺假物种主要为猪、鸭。通过大批量样品实验对比,LC-MS/MS方法的准确性较高,且实验操作更为简便,方法更为省时、耗费更低,可用于日常食品检测。
参考文献:
[1] WANG Guiji, ZHOU Guangyun, REN Haowei, et al. Peptide biomarkers identified by LC-MS in processed meats of five animal species[J]. Journal of Food Composition and Analysis, 2018, 73: 47-54. DOI:10.1016/j.jfca.2018.07.004.
[2] STADER C, JUDAS M, JIRA W. A rapid UHPLC-MS/MS screening method for the detection of the addition of porcine blood plasma to emulsion-type pork sausages[J]. Analytical and Bioanalytical Chemistry, 2019, 411(25): 1-13. DOI:10.1007/s00216-019-02043-2.
[3] 张静娴, 胡青, 董洪霜, 等. 超高效液相色谱-三重四极杆质谱法用于阿胶糕类食品中阿胶的鉴别及马、牛、羊、猪皮源成分的检测[J]. 世界中医药, 2019, 14(4): 59-63. DOI:10.3969/j.issn.1673-7202.2019.04.008.
[4] CHEN Q, KE Xing, ZHANG Jingshun, et al. Proteomics method to quantify the percentage of cow, goat, and sheep milks in raw materials for dairy products[J]. Journal of Dairy Science, 2016, 99: 9483-9492. DOI:10.3168/jds.2015-10739.
[5] 孟佳, 古淑青, 方真, 等. 高效液相色谱-串联质谱法测定肉制品和调味料中7 种水产品过敏原[J]. 色谱, 2019, 37(7): 712-722. DOI:10.3724/SP.J.1123.2019.01042.
[6] MARTINEZ-ESTESO M J, NORGAARD J, BROHEE M, et al. Label-free proteomic analysis of wheat gluten protein and their immunoreactivity to ELISA antibodies[J]. Cereal Chemistry, 2017, 94(5): 820-826. DOI:10.1094/CCHEM-11-16-0266-R.
[7] ZVEREVA E A, KOVALEV L I, IVANOV A V, et al. Enzyme immunoassay and proteomic characterization of troponin I as a marker of mammalian muscle compounds in raw meat and some meat products[J]. Meat Science, 2015, 105: 46-52. DOI:10.1016/j.meatsci.2015.03.001.
[8] HSIEH Y H, SHEU S C, BRIDGMAN R C. Development of a monoclonal antibody specific to cooked mammalian meats[J]. Journal of Food Protection, 1998, 61(4): 476-481. DOI:10.4315/0362-028x-61.4.476.
[9] CAI Yicun, HE Yuping, L? Rong, et al. Detection and quantification of beef and pork materials in meat products by duplex droplet digital PCR[J]. PLoS One, 2017, 12(8): e0181949. DOI:10.1371/journal.pone.0181949.
[10] SHEHATA H R, LI J P, CHEN S, et al. Droplet digital polymerase chain reaction (ddPCR) assays integrated with an internal control for quantification of bovine, porcine, chicken and turkey species in food and feed[J]. PLoS One, 2017, 12(8): e0182872. DOI:10.1371/journal.pone.0182872.
[11] 田晨曦, 周巍, 王爽, 等. 基于DNA條形码技术常见肉类掺假鉴别技术的研究[J]. 现代食品科技, 2016, 32(8): 295-301. DOI:10.13982/j.mfst.1673-9078.2016.8.045.
[12] 钟文涛, 王芳妹, 李白玉, 等. 四重PCR反应体系的建立及在牛肉掺假检测中的应用[J]. 现代生物医学进展, 2016, 16(18): 3574-3577. DOI:10.13241/j.cnki.pmb.2016.18.045.
[13] MUSTO M, FARAONE D, CELLINI F, et al. Changes of DNA quality and meat physicochemical properties in bovine Supraspinatus muscle during microwave heating[J]. Journal of the Science of Food and Agriculture, 2014, 94(4): 785-791. DOI:10.1002/jsfa.6441.
[14] ULCA P, BALTA H, ?AGIN ?, et al. Meat species identification and Halal authentication using PCR analysis of raw and cooked traditional Turkish foods[J]. Meat Science, 2013, 94(3): 280-284. DOI:10.1016/j.meatsci.2013.03.008.
[15] BUCKLEY M. Species identification of bovine, ovine and porcine type 1 collagen; comparing peptide mass fingerprinting and LC-based proteomics methods[J]. International Journal of Molecular Sciences, 2016, 17(4): 445-461. DOI:10.3390/ijms17040445.
[16] 張颖颖, 赵文涛, 李慧晨, 等. 液相色谱串联质谱对掺假牛肉的鉴别及定量研究[J]. 现代食品科技, 2017, 33(2): 230-237. DOI:10.13982/j.mfst.1673-9078.2017.2.035.
[17] MARCHIS D, ALTOMARE A, GILI M, et al. LC-MS/MS identification of species-specific muscle peptides in processed animal proteins[J]. Journal of Agricultural and Food Chemistry, 2017, 65(48): 10638-10650. DOI:10.1021/acs.jafc.7b04639.
[18] SENTANDREU M A, FRASER P D, HALKET J, et al. A proteomic-based approach for detection of chicken in meat mixes[J]. Journal of Proteome Research, 2010, 9(7): 3374-3383. DOI:10.1021/pr9008942.
[19] VON BARGEN C, DOJAHN J, WAIDELICH D, et al. New sensitive high-performance liquid chromatography-tandem mass spectrometry method for the detection of horse and pork in halal beef[J]. Journal of Agricultural and Food Chemistry, 2013, 61(49): 11986-11994. DOI:10.1021/jf404121b.
[20] KIM G D, SEO J K, YUM H W, et al. Protein markers for discrimination of meat species in raw beef, pork and poultry and their mixtures[J]. Food Chemistry, 2017, 217: 163-170. DOI:10.1016/j.foodchem.2016.08.100.
[21] 李莹莹, 张颖颖, 丁小军, 等. 液相色谱-串联质谱法对羊肉中鸭肉掺假的鉴别[J]. 食品科学, 2016, 37(6): 204-209. DOI:10.7506/spkx1002-6630-201606037.
[22] ORDUNA A R, HUSBY E, YANG C T, et al. Assessment of meat authenticity using bioinformatics, targeted peptide biomarkers and high-resolution mass spectrometry[J]. Food Additives and Contaminants, 2015, 32(10): 1709-1717. DOI:10.1080/19440049.2015.1064173.
[23] MOTTA T M C, HOFF R B, BARRETO F, et al. Detection and confirmation of milk adulteration with cheese whey using proteomic-like sample preparation and liquid chromatography-electrospray-tandem mass spectrometry analysis[J]. Talanta, 2014, 120: 498-505. DOI:10.1016/j.talanta.2013.11.093.
[24] YANG C T, GHOSH D, BEAUSRY F. Detection of gelatin adulteration using bioinformatics, proteomics and high-resolution mass spectrometry[J]. Food Additives and Contaminants: Part A, 2018, 35(4): 599-608. DOI:10.1080/19440049.2017.1416680.
[25] PRANDI B, LAMBERTINI F, FACCINI A, et al. Mass spectrometry quantification of beef and pork meat in highly processed food: application on Bolognese sauce[J]. Food Control, 2017, 74: 61-69. DOI:10.1016/j.foodcont.2016.11.032.
[26] MONTOWSKA M, ALEXANDER M R, TUCKER G A, et al. Authentication of processed meat products by peptidomic analysis using rapid ambient mass spectrometry[J]. Food Chemistry, 2015, 187: 297-304. DOI:10.1016/j.foodchem.2015.04.078.
[27] 中華人民共和国辽宁出入境检验检疫局, 宝生物工程(大连)有限公司, 中国检验检疫科学研究院. 食品、化妆品和饲料中牛羊猪源性成分检测方法 实时PCR法: SN/T 2051—2008[S]. 北京: 中国标准出版社, 2008: 1-16.
[28] 中华人民共和国国家质量监督检验检疫总局. 动物源性产品中鸡源成分PCR检测方法: SN/T 2978—2011[S]. 北京: 中国标准出版社, 2011: 1-7.
[29] 中国检验检疫科学研究院, 中华人民共和国深圳出入境检验检疫局, 深圳市检验检疫科学研究院. 食品及饲料中常见禽类品种的鉴定方法 第5部分: 鸭成分检测 PCR法: SN/T 3731.5—2013[S]. 北京: 中国标准出版社, 2013: 1-7.
[30] LI Yingying, ZHANG Yingying, LI Huichen, et al. Simultaneous determination of heat stable peptides for eight animal and plant species in meat products using UPLC-MS/MS method[J]. Food Chemistry, 2018, 245: 125-131. DOI:10.1016/j.foodchem.2017.09.066.
[31] ZHANG Yingying, WANG Shouwei, MA Yanhong, et al. Identification and absolute quantification of animal blood products by peptide markers using an UPLC-MS/MS method[J]. European Food Research and Technology, 2020, 246: 581-589. DOI:10.1007/s00217-019-03421-x.
[32] MONTOWSKA M, FORNAL E. Label-free quantification of meat proteins for evaluation of species composition of processed meat products[J]. Food Chemistry, 2017, 237: 1092-1100. DOI:10.1016/j.foodchem.2017.06.059.
[33] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015: 189.
[34] MAGDALENA M, RAO W, ALEXANDER M R, et al. Tryptic digestion coupled with ambient desorption electrospray ionization and liquid extraction surface analysis mass spectrometry enabling identification of skeletal muscle proteins in mixtures and distinguishing between beef, pork, horse, chicken, and turkey meat[J]. Analytical Chemistry, 2014, 86(9): 4479-4487. DOI:10.1021.ac5003432.
[35] GIARETTA N, DI GIUSEPPE A M A, LIPPERT M, et al. Myoglobin as marker in meat adulteration: a UPLC method for determining the presence of pork meat in raw beef burger[J]. Food Chemistry, 2013, 141(3): 1814-1820. DOI:10.1016/j.foodchem.2013.04.124.
[36] HOFFMANN B, MUNCH S, SCHWGELE F, et al. A sensitive HPLC-MS/MS screening method for the simultaneous detection of lupine, pea, and soy proteins in meat products[J]. Food Control, 2017, 71: 200-209. DOI:10.1016/j.foodcont.2016.06.021.
[37] MONTOWSKA M, FORNAL E. Detection of peptide markers of soy, milk and egg white allergenic proteins in poultry products by LC-Q-TOF-MS/MS[J]. LWT-Food Science and Technology, 2018, 87: 310-317. DOI:10.1016/j.lwt.2017.08.091.
