内质网应激对非酒精性脂肪性肝病细胞线粒体凋亡影响研究*
2020-09-14吴鹏波吴晓曼俞媛洁郭一天谭诗云
吴鹏波,吴晓曼,俞媛洁,郭一天,李 明,谭诗云
(武汉大学人民医院消化内科,湖北武汉 430060)
非酒精性脂肪性肝病(NAFLD)是发病率较高的消化系统疾病,目前尚无安全有效的治疗手段[1]。既往研究一致表明NAFLD患者肝细胞过度凋亡,但细胞凋亡的调控机制仍不明了[2-3]。多种病理生理过程参与细胞凋亡的调控,其中内质网应激在多种疾病细胞凋亡的调控过程中发挥重要作用[4-5]。部分研究报道内质网应激通过影响线粒体参与NAFLD发病[6-7],本研究着重探讨内质网应激对NAFLD细胞模型凋亡特别是线粒体途径凋亡的影响。
1 材料与方法
1.1一般资料 HepG2细胞购于中国科学院上海生命科学院细胞库。
1.2仪器与试剂
1.2.1主要仪器 正置荧光显微镜购于日本Olympus公司;流式细胞仪购于Beckman公司;Western Blot电转仪购于Invitrogen。
1.2.2主要试剂 油酸、4-苯基丁酸(4-PBA)购于Sigma公司;BODIPY 493/503荧光染料购于Invitrogen公司;Hoechst 33258染料、Annexin V-FITC/PI双染料、荧光探针JC-1均购于上海碧云天生物技术有限公司;葡萄糖调节蛋白78(GRP78)及C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白(CHOP)及线粒体途径凋亡相关蛋白半胱氨酸天冬氨酸蛋白酶-3(caspase-3)、B淋巴细胞瘤-2基因(Bcl-2) 、Bcl-2相关X蛋白(Bax)的以及细胞质细胞色素C(CytC)抗体购于Sigma公司。
1.3方法
1.3.1细胞培养 在含有10%胎牛血清的培养基中培养HepG2细胞至对数生长期。油酸诱导构建NAFLD细胞模型进行造模[4]。实验细胞分为4组:对照组、造模12 h组、造模16 h组、4-PBA组(细胞接种过夜后加入油酸和内质网应激抑制剂4-PBA培养16 h,其中4-PBA工作浓度为1 mmol/L)。
1.3.2BODIPY 493/503染色 细胞分组处理后磷酸盐缓冲溶液(PBS)充分洗涤,甲醛固定后PBS再次充分洗涤,再加入适量的BODIPY 493/503荧光染料,工作浓度为0.1 mg/L,充分摇匀后常温下染色6 min,荧光显微镜观察细胞中的荧光强度。
1.3.3Hoechst 33258染色 细胞分组处理后PBS充分洗涤,甲醛固定后PBS再次充分洗涤,再加入适量的Hoechst 33258染料,室温下充分摇匀避光染色5 min,吸干含有染料的培养液后充分洗涤细胞,晾干后在352 nm的激发波长下荧光显微镜观察HepG2细胞中的荧光强度。Hoechst 33258染料可穿透细胞,当细胞核或细胞质内可见浓染致密的颗粒块状荧光即判定细胞凋亡。
1.3.4Annexin V-FITC/PI双染色 细胞分组处理后充分洗涤,用胰蛋白酶消化各组细胞,离心洗涤悬浮细胞经过过滤再次离心后加入Annexin V-FITC和PI染液,常温下避光孵育20 min,加入缓冲液悬浮细胞,上机检测各组细胞凋亡率。
1.3.5JC-1法检测线粒体膜电位(MMP) 细胞分组处理后充分洗涤,制成悬浮液后加入荧光探针JC-1,工作浓度为5 μmol/L,常温下孵育15 min后荧光显微镜观察细胞红、绿色荧光强度。以红色与绿色荧光强度的比值来衡量线粒体去极化程度,比值越高提示线粒体膜电位越高。
1.3.6免疫蛋白印迹(Western blot)检测蛋白表达 细胞经过消化离心裂解后采用水煮法制作蛋白样品,蛋白样品在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离胶中分离,将分离胶中蛋白转至聚偏氟乙烯(PVDF)膜上,根据各个目标蛋白分子量参照内参切膜,经过洗涤、封闭后加入GRP78、CHOP、Bax、Bcl-2、Caspse-3以及细胞质CytC抗体孵育12 h,次日清晨充分洗涤加入辣根过氧化物酶标记的二抗后孵育2 h,经过显影定影根据灰度判定各蛋白的相对表达量。

2 结 果
2.1各组细胞脂肪变性情况 采用BODIPY 493/503染色,可见对照组细胞内较为稀少的绿色荧光,造模12 h及16 h后HepG2细胞绿色荧光呈时间依赖性增加;4-PBA组HepG2细胞内绿色荧光相比造模16 h组显著减少。见图1。
2.2Hoechst 33258染色 对照组中较少细胞出现凋亡,造模12 h和16 h后细胞凋亡呈时间依赖性增加,相比造模16 h组,加用4-PBA后细胞凋亡明显减少,见图2。
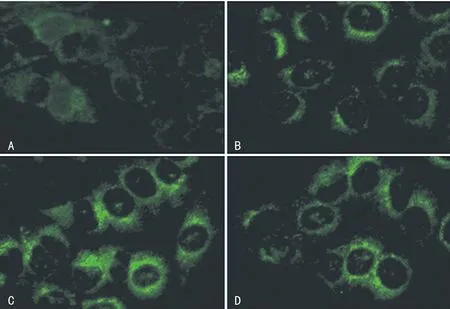
注:A为对照组;B为造模12 h组;C为造模16 h组;D为4-PBA组。

注:A为对照组;B为造模12 h组;C为造模16 h组;D为4-PBA组。
2.3Annexin V-FITC/PI检测凋亡情况 对照组细胞较少出现凋亡[(1.31±0.12)%],造模12 h和16 h后细胞凋亡率明显上升[(1.91±0.13)%、(5.11±0.16)%],相比造模16 h组,加用4-PBA组细胞凋亡率下降[(2.87±0.15)%]。见图3。

注:A为对照组;B为造模12 h组;C为造模16 h组;D为4-PBA组。
2.4MMP变化 与对照组比较,经造模后HepG2细胞MMP逐步降低,以造模16 h组最为明显,相比造模16 h组加用4-PBA后细胞MMP升高。见图4。

注:A为对照组;B为造模12 h组;C为造模16 h组;D为4-PBA组。
2.5内质网应激、自噬相关蛋白表达 造模2 h组和造模6 h组细胞Bax、Caspse-3、GRP78、CHOP、胞质CytC蛋白表达增加,而Bcl-2表达降低;4-PBA抑制内质网应激后细胞GRP78、CHOP、Bax、Caspse-3、胞质CytC蛋白表达降低,而Bcl-2蛋白表达增加。见图5。
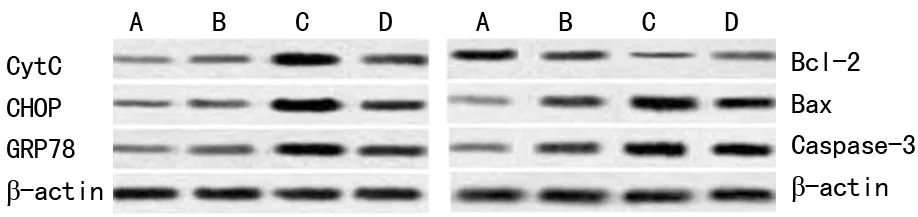
注:A为对照组;B为造模12 h组;C为造模16 h组;D为4-PBA组。
3 讨 论
内质网是真核细胞内重要的细胞器,它参与蛋白加工、钙离子储存、脂代谢和细胞解毒,对维持细胞内环境稳态具有至关重要的作用[8]。肝细胞中存在较多的内质网,当肝细胞长期受到油酸等有害刺激时,内质网会出现功能紊乱即内质网应激[8]。国内外学者对内质网应激在NAFLD中的作用进行研究,多数结果认为内质网应激对NAFLD具有促进其发病的作用[9],本研究通过染色发现抑制细胞内质网应激后肝细胞脂肪沉积明显缓解,结果与既往研究结论一致。
细胞凋亡是细胞在受到内源性或者外源性信号刺激下为维持细胞内环境稳态而启动的多种信号通路和基因调控的生理性死亡[10-11]。既往研究发现凋亡在NAFLD发生及发展过程中具有重要的作用[10]。凋亡启动途径有线粒体途径、死亡受体途径及内质网途径[11]。本研究着重研究的是线粒体途径凋亡。生理状态下, Bcl-2和Bax蛋白通过保持线粒体膜的完整性维持正常的线粒体功能[12-13]。病理生理状态下线粒体出现膜通透性改变,随之出现MMP改变,CytC被释放至胞质中[10-11]。因此,Bcl-2和Bax是线粒体途径凋亡关键的启动因子,膜电位改变是线粒体途径凋亡的特征性改变,CytC释放至细胞质是线粒体途径凋亡的关键环节。本研究JC-1法检测结果显示造模后细胞MMP下降,Western blot结果显示Bax、Caspse-3、胞质CytC蛋白表达增加,Bcl-2表达降低提示线粒体途径凋亡可能参与NAFLD的发生及发展。
本研究发现在NAFLD中内质网应激和凋亡率均升高。为探讨内质网对细胞的影响,4-PBA抑制内质网应激后细胞膜电位下降,Caspse-3、细胞质CytC蛋白表达降低,而Bcl-2蛋白表达增加,提示内质网应激对NAFLD细胞凋亡具有促进作用。既往有学者针对内质网应激与凋亡在NAFLD中的关系进行了研究,认为改善内质网应激可以抑制细胞凋亡[14]。内质网应激可诱导细胞内钙离子稳态失衡,细胞内异常的钙离子水平促使线粒体钙离子超载的发生,线粒体内钙离子的大量增加会打开膜渗透转换孔,膜渗透转换孔开放后引起线粒体膜变化,诱发CytC释放启动线粒体途径凋亡[15-16]。
4 结 论
本研究发现在NAFLD细胞凋亡和内质网应激增加,减轻内质网应激后可降低线粒体途径凋亡率,结果提示内质网应激对NAFLD的发病有影响。但细胞内质网应激通过何种分子机制诱导细胞线粒体途径凋亡仍有待进一步探讨。
