长链非编码RNA RAB1A-2在胃癌中的表达及作用
2020-09-14章烈王向阳王辉
章烈,王向阳,王辉
(华中科技大学同济医学院附属武汉中心医院 胃肠外科 ,湖北 武汉 430014)
胃癌是全球癌症相关死亡的第二大原因,每年约951 600例新发和723 100例死亡病例[1]。胃癌治疗方法包括手术、放化疗和生物治疗等,但其高复发和转移的特点是导致患者生存率较低的主要原因[2-3]。长链非编码RNA(long non-coding RNAs,lncRNA)是一类RNA分子,长度约200 nt,参与细胞增殖和凋亡、周期控制、细胞发育和分化等生物学过程[4-5]。lncRNA失调与人类多种疾病密切相关[6]。lncRNA RAB1A-2(RAB1A-2)最早在小鼠胚胎发育过程中发现和鉴定[7],定位于染色体2p14,是一种mTORC1激活剂,其与肺癌细胞DNA异常扩增和细胞增殖及侵袭密切相关[8]。然而,RAB1A-2在胃癌中的表达及作用尚未见报道,本研究旨在探讨胃癌患者中RAB1A-2的表达及作用。
1 材料与方法
1.1 组织样本
本研究收集在武汉市中心医院胃肠外科行胃癌切除术的胃癌患者组织标本68例。患者纳入标准:(1) 经病理确诊为胃腺癌;(2) 胃癌的治疗按NCCN指南标准治疗;(3)患者不存在除胃癌之外其他恶性肿瘤;(4) 患者具有完整的随访资料。排除标准:不符合上述纳入标准者。根据国际癌症控制联盟(UICC)和美国癌症联合委员会(AJCC)胃癌TNM分期系统推荐的肿瘤淋巴结转移(TNM)分类系统(第8版)[9]对病理切片进行再评估以达到准确分期目的。收集组织样品并在液氮中快速冷冻并储存在-80 ℃直至分析。本研究征得医院伦理委员会同意实施。
1.2 患者临床资料收集和随访
采集患者年龄、性别、肿瘤大小等临床资料。总生存时间定义为术后至随访结束或死亡时间。经门诊或电话方式随访,每半年随访1次,随访内容包括患者生存情况,共2例失访。
1.3 主要实验仪器和试剂
3种人胃癌细胞系(SGC-7901、MKN-45和BGC-823)和正常胃黏膜细胞系(GES-1)购自中国科学院细胞库(中国上海)。RABA-2 沉默序列(si-RAB1A-2)、RAB1A-2过表达序列(mimic-RAB1A-2)和阴性对照序列(si-NC)由上海吉玛生物公司合成。MTT试剂盒购于美国Invitrogen公司、细胞培养基RPMI 1640购于美国Gibco 公司,LipofectamineTM3000购于美国Invitrogen 公司,qPCR引物由广州锐博生物公司设计并合成。
1.4 实验方法
1.4.1 细胞培养及分组培养基为含10% 胎牛血清的Eagle 培养基,培养条件为:37 ℃、含5%CO2,取对数期生长良好的SGC-7901 细胞系在六孔板上生长至汇合时用LipofectamineTM3000 将si-RAB1A-2(RAB1A-2 干扰组)、RAB1A-2 模拟物(RAB1A-2 模拟物组)和阴性对照序列(阴性对照组)分别转染细胞。转染后48 h 收获细胞,采用qRT-PCR 检测确定转染效率。
1.4.2 细胞增殖和凋亡检测采用MTT 试剂盒测定细胞增殖能力,于450 nm 处测定每孔吸光度,细胞活力=(OD 样本/OD 对照)×100。根据制造商方案,使用膜联蛋白-V-Fluos(Annexin-VFluos)和碘化丙啶(propidium iodide,PI)凋亡检测试剂盒通过流式细胞仪测定细胞凋亡率。
1.4.3 Transwell 实验将3 组细胞分别种植于Transwell 小室的上部室中,采用无血清培养基200 μL 孵育,下室填充采用含FBS 的培养基600 μL,待24 h 后,采用多聚甲醛固定细胞,用0.1% 结晶紫染色,在400× 显微镜下,取10 个视野计数穿膜细胞数并计算平均值。
1.4.4 实 时 定 量RT-PCR(qRT-PCR)按RNA 试剂提取说明书提取组织和细胞总RNA 后,反转录成cDNA,在ABI-7500 平台上采用SYBR Premix Ex Taq TM II 试剂盒行PCR 扩增,GAPDH作为内参。qRT-PCR 引物序列如下:RAB1A-2 序列:正向:5'-GCT AGT TGG ACT GGA GAT TTG G-3', 反向:5'-TTA TTA CCA CAG GAG GGA GCA C-3';GAPDH 序列:正向:5'-GCA CCG TCA AGG CTG AGA AC-3', 反向:5'-TGG TGA AGA CGC CAG TGG A-3'。 扩增条件是:95 ℃5 min,95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共40个循环,反应结束后行熔解曲线分析,采用 2-ΔΔCt法计算细胞系及组织中RAB1A-2 相对表达水平。
1.5 统计学处理
2 结 果
2.1 RAB1A-2 在胃癌组织和细胞系中的表达
qRT-PCR结果显示,胃癌组织中RAB1A-2相对表达量高于癌旁组织(P<0.05)(图1A)。3种胃癌细胞系(MKN-45、BGC-823和SGC-7901)中RAB1A-2相对表达量高于正常胃黏膜细胞系GES-1(均P<0.05)(图1B)。
2.2 RAB1A-2 的表达与胃癌患者临床病理因素的关系
以6 8例胃癌组织RABA-2 表达的中位值为界,将患者分为AB1A-2 高表达组(34例)和RAB1A-2低表达组(34例)。RAB1A-2表达与肿瘤大小、T分类、N分类和TNM分期明显有关(均P<0.05),而与年龄、性别、分化程度无明显关系(均P>0.05)(表1)。

图1 qRT-PCR 检测RAB1A-2 表达 A:RAB1A-2 在胃癌组织与癌旁组织中的表达;B:RAB1A-2 在胃癌细胞系与胃黏膜细胞系中的表达Figure 1 RAB1A-2 expression determined by qRT-PCR A: The expressions of RAB1A-2 in gastric cancer tissue and adjacent tissue; B: The expressions of RAB1A-2 in gastric cancer cell lines and normal gastric mucosa cell line

表1 RAB1A-2 的表达与胃癌患者临床病理因素的关系 [n(%)]Table 1 Relations of RAB1A-2 expression with clinicopathologic factors of gastric cancer patients [n (%)]
2.3 RAB1A-2 的表达与胃癌患者总生存率的关系
生存分析结果显示,RAB1A-2高表达组3年总生存率为63.2%,RAB1A-2低表达组3年总生存率为87.5%,RAB1A-2高表达组3年总生存率低于RAB1A-2低表达组(P<0.001);RAB1A-2高表达组5年总生存率为27.5%,RAB1A-2低表达组5年总生存率为68.2%,RAB1A-2高表达组5年总生存率低于RAB1A-2低表达组(P<0.001)(图2)。
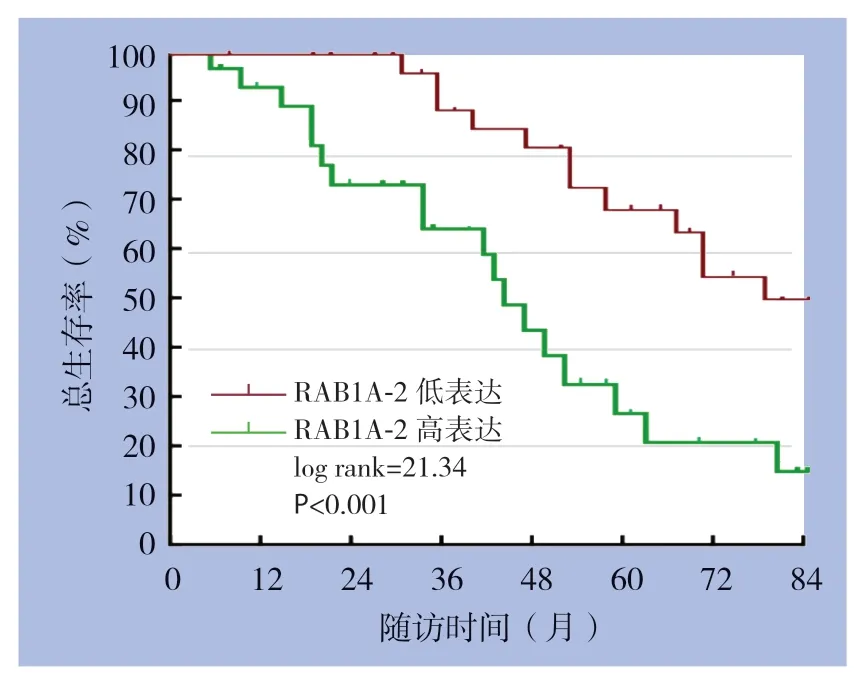
图2 RAB1A-2 高低表达组患者总生存曲线Figure 2 The overall survival curves of the patients with high and low RAB1A-2 expression
2.4 转染效率检测
RAB1A-2模拟物组RAB1A-2相对表达量高于阴性对照组,RAB1A-2干扰组RAB1A-2相对表达量低于阴性对照组(均P<0.01)(图3),提示转染效果可,可行下一步试验。
2.5 RAB1A-2 对胃癌细胞增殖的影响
MTT结果示:RAB1A-2模拟物组A450nm值高于阴性对照组(P<0.0 1);RAB1A-2干扰组 A450nm值低于阴性对照组(P<0.01)(图4)。
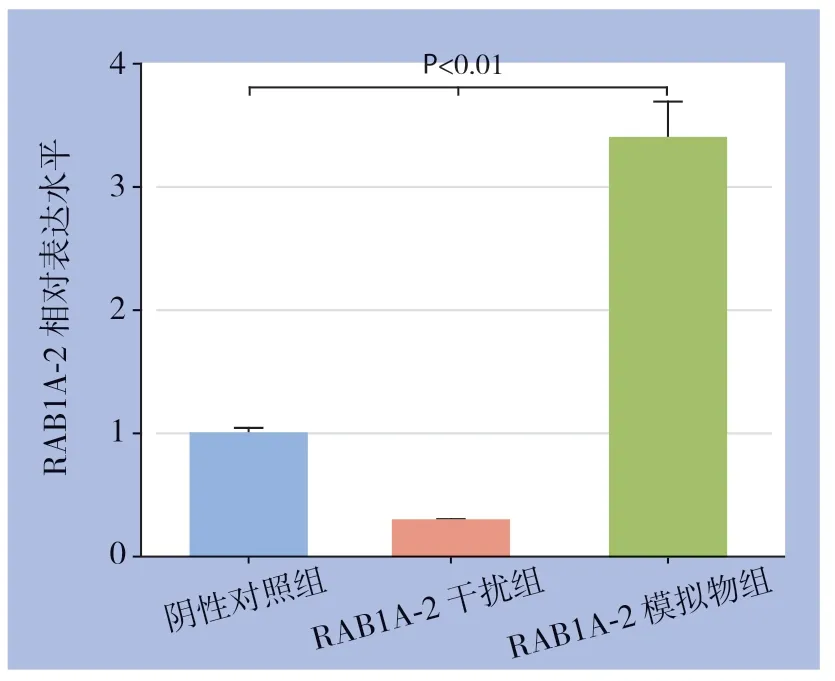
图3 qRT-PCR 测定转染效率Figure 3 Transfection efficiency determination by qRT-PCR
2.6 RAB1A-2 对胃癌细胞凋亡的影响
流式细胞术检测结果显示,阴性对照组细胞凋亡率为(8.3±0.8)%,RAB1A-2模拟物组细胞凋亡率为(5.2±0.6)%,RAB1A-2干扰组细胞凋亡率为(15.4±2.4)%;RAB1A-2模拟物组细胞凋亡率低于阴性对照组,RAB1A-2干扰组细胞凋亡率高于阴性对照组(均P<0.01)(图5)。

图4 各组细胞的增殖曲线Figure 4 The proliferation curve of each group of cells
2.7 RAB1A-2 对胃癌细胞侵袭能力的影响
Transwell实验结果显示,RAB1A-2模拟物组侵袭细胞数多于阴性对照组[(80±13)个vs.(45±8)个,P<0.01];RAB1A-2干扰组侵袭细胞数少于阴性对照组[(20±4)个vs.(45±8)个,P<0.01](图6)。

图5 RAB1A-2 对胃癌细胞凋亡的影响 A:流式细胞术检测结果;B:细胞凋亡率比较Figure 5 The effect of RAB1A-2 on apoptosis of gastric cancer cells A: Flow cytometry analysis; B: Comparison of apoptosis rates
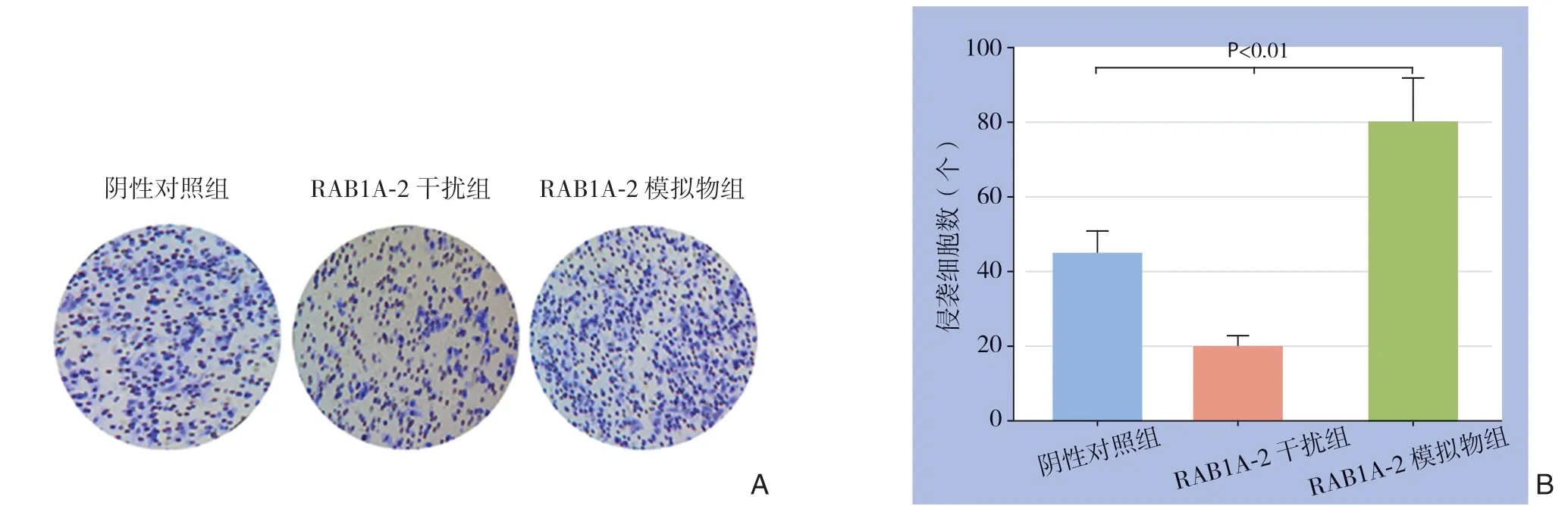
图6 RAB1A-2 对胃癌细胞侵袭 A:Transwell 实验结果;B:侵袭细胞数比较Figure 6 Effect of RAB1A-2 on invasion of gastric cancer cells A: Transwell assay; B: Comparison of numbers of invading cells
3 讨 论
在我国,胃癌是高发肿瘤,致癌因素包括饮食结构的改变、工作压力增大及幽门螺杆菌感染等。胃癌患者预后较差,严重危及我国人民健康[10]。癌症发生和发展是多分子参与的多步骤过程,深入研究胃癌发病的分子机制对胃癌治疗尤为重要[11-12]。文献报道许多miRNA及lncRNA参与了胃癌细胞增殖、迁移、侵袭和转移过程[13-14],是胃癌发生发展的重要调节分子[15-16]。
本研究发现胃癌组织及细胞系中RAB1A-2表达量高于胃癌旁组织及细胞系,提示RAB1A-2可能参与胃癌进展。文献[17]报道在非小细胞肺癌中,RAB1A-2表达显著上调,这与上述报道存在一致性,提示RAB1A-2为潜在的肿瘤促进因子。RAB1A-2高表达与胃癌患者肿瘤大小、T分类、N分类及TNM分期均显著相关,提示RAB1A-2高表达代表着肿瘤恶性程度较高的表型,参与胃癌进展。本研究发现RAB1A-2 高表达组患者术后总生存率低于RAB1A-2低表达组患者,提示lncRAB1A-2与患者预后不良相关。
lncRNA是胃癌发生和进展的重要调节分子[18-19],多个lncRNA参与胃癌发生和进展,且与胃癌预后相关。长链非编码RNA 如OXA11-AS[20]和HOTAIR[21]均参与胃癌发生和进展,在胃癌组织中表达异常,且与胃癌患者预后不良密切相关,而最近研究发现lncRNA MALAT1是胃癌的分子标志物[22]。体外功能研究中,通过干扰RNA分别沉默和上调胃癌细胞系中RAB1A-2表达,结果显示RAB1A-2高表达促进胃癌细胞增殖和侵袭,抑制细胞凋亡。在胃癌细胞系中,多个不同的长链非编码RNA可影响癌细胞增殖和侵袭,比如lncRNA PVT1即可在体外抑制胃癌细胞系的凋亡[23]。研究显示RAB1A-2高表达在小鼠胚胎发育过程中可导致细胞内DNA组装和细胞分裂异常[8,24],促进细胞不受控增殖。上述研究结果也提示RAB1A-2过表达通过促进癌细胞增殖、侵袭并抑制凋亡而导致胃癌患者预后不佳。
成纤维细胞生长因子1 是成纤维细胞生长因子家族成员之一,其在细胞增殖、生存、迁移、侵袭、分化及血管生成中起重要作用[25]。研究表明低浓度得成纤维细胞生长因子1可促进肿瘤新生血管形成[26],并有抗凋亡作用。成纤维细胞生长因子1激活PI3K/Akt/mTOR信号通路,可促进肿瘤发生和肿瘤侵袭转移[27]。在卵巢癌中[28],成纤维细胞生长因子1上调表达促进肿瘤新生血管形成,并与预后不良相关。在肺癌[17]中,RAB1A-2可能通过影响成纤维细胞生长因子1表达,调控PI3K/Akt/mTOR信号通路,进而影响肺癌细胞增殖。在胃癌中,RAB1A-2是否也通过此信号通路影响胃癌细胞增殖、凋亡及侵袭,值得进一步研究,此外本研究存在如下不足:(1) 纳入病例数目较少,尚未分析胃癌组织RAB1A-2表达对胃癌患者是否存在诊断价值;(2) 本研究尚未在模式动物中探讨RAB1A-2表达与肿瘤进展的关系,值得进一步研究。
总之,本研究发现胃癌组织和细胞系中RAB1A-2表达上调,RAB1A-2高表达是胃癌患者预后不良的分子标志物,体外实验证实RAB1A-2高表达可促进胃癌细胞增殖、侵袭并抑制凋亡。RAB1A-2在胃癌中起促癌作用,可能是胃癌的潜在治疗靶点。
