实时动态超声造影在肝癌射频消融治疗中的价值分析
2020-09-14邹瑞王一尧彭旭李铎
邹瑞, 王一尧, 彭旭,李铎
(海南省肿瘤医院 肝胆胰外科,海南 海口 570312)
近年来,微创治疗、精准治疗理念不断推广[1],射频消融(radiofrequency ablation,RFA)治疗作为肝癌治疗中行之有效的微创治疗模式被广泛应用于肝癌,尤其是小肝癌的治疗[2-7]。因此,高效的RFA引导方式成为影响肝癌预后的重要因素。超声造影可实时动态地观测组织的微血流灌注情况,显示肿瘤内的血管形态分布,相对于常规超声明显提高了诊断的敏感性和特异性[8-9],尤其可以在动脉期、门静脉期、延迟期不同时相动态观察血流的变化,对肝癌的RFA治疗具有重要指导作用[10],本文回顾性分析我院超声造影引导和常规超声引导RFA治疗肝癌的临床疗效,并进行统计学分析,为临床诊疗提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2017年2月—2019年2月期间住院诊断为原发性肝癌行RFA治疗的患者40例,男29例,女11例;年龄46~76岁,平均年龄(54.2±10.6)岁;其中肿瘤位于肝II段4例,III段6例,IV段8例,V段11例,VI段6例,IIV段3例,VIII段2例;22例为常规超声引导组(常规组),18例为超声造影引导组(造影组)。纳入标准:(1) 所有患者均临床或病理诊断为原发性肝癌,单发肿瘤直径≤5 cm;或肿瘤数目≤3且最大直径≤3 cm;(2) 无血管癌栓及邻近器官侵犯,无远处脏器转移;(3)肝功能Child-Pugh分级A或B级; (4) 治疗前1个月内无食管胃底静脉曲张破裂出血病史;(5) 凝血功能正常;⑹ 无严重的心脑肺肝肾等重要脏器功能障碍;⑺ 无腹水、肝性脑病; ⑻ 无胆道系统感染及全身其他部位的活动性感染[11]。排除标准:(1) 缺乏典型原发性肝癌影像学“快进快出”特征且无病理诊断的患者;(2) 已经做过手术、介入、靶向、免疫等治疗的患者;(3)肿瘤外缘距离肝包膜小于1 cm的患者。
1.2 手术方法
所有患者术前完善影像CT、MRI检查,制定合理的进针路径和治疗方案,术前禁食8 h,术中予静脉镇静、镇痛,监测患者血压、心率、呼吸等生命体征的变化,根据肿瘤具体位置选择合适体位,常规消毒、铺单。常规组患者检查采用超声飞利浦CX50 行肝肿瘤病灶定位,确定消融范围,进针点予2%利多卡因局部逐层浸润麻醉至肝包膜,使用LDRF-120S多极射频消融仪,配套手术电极LDDJC1-0100404,在超声引导下行RFA治疗,肿瘤≤3 cm使用单针消融,>3 cm采用多针消融,避免反复穿刺,消融范围需完全覆盖肿瘤超出边界0.5~1 cm范围(其中对于无包膜病例消融范围达到1 cm),消融完毕后针道模式退针,术后超声检查肝周围有无出血。造影组患者采用飞利浦Q7超声诊断仪,超声定位病灶后,切换至实时灰阶谐波造影双副显像模式,肘静脉注射超声造影剂(Bracco公司的SonoVue)并同时计时,连续观察病灶的动脉、门脉、延迟期的造影剂灌注模式(图1),最后快速扫描全肝筛查可疑病灶,确定病灶后行RFA治疗(方法同常规组患者),RFA后再次行超声造影明确肿瘤灭活情况,如局部残留,给予再次行RFA治疗。

图1 超声造影实时动态评估肝肿瘤情况
1.3 观察指标
术后1个月复查增强CT或MRI或超声造影,评估RFA治疗完全消融率。(1) 完全消融:肿瘤消融病灶动脉期未见强化,提示肿瘤完全坏死;(2) 不完全消融:肿瘤消融病灶内动脉期局部有强化,提示有肿瘤残留、术后并发症(感染、胆汁漏、出血、针道种植转移、坏死性肝脓肿、肝衰竭、皮肤灼烧坏死)发生率、平均住院时间、住院费用等;RFA后超声造影鉴别肿瘤残留与凝固性坏死,分析肿瘤残留率。
1.4 统计学处理
采用SPSS 23.0软件进行统计学分析,定量资料采用±s 进行描述,组间比较采用方差分析,定性资料采用绝对数和频率描述,组间比较使用χ2检验,采用强迫引入法进行多因素非条件Logistic回归分析RFA疗效的影响因素,P<0.05为差异有统计学意义。
2 结 果
两组患者一般资料具有可比性,性别、年龄、肿瘤大小、病灶数等差异无统计学意义(P>0.05)。常规组完全消融率68.2% ,造影组94.0%,差异有统计学意义(P<0.05)(表1)。
造影组患者行超声造影后发现新病灶2例(11.1%);造影后病灶总体较前增大8例,(46.0%);两组的患者手术后均未见感染、胆漏、出血、针道种植转移、坏死性肝脓肿、肝衰竭、皮肤灼烧坏死等并发症,平均住院时间,住院费用等差异无统计学意义(P>0.05)(表2)。

表1 常规组与造影组一般情况的统计
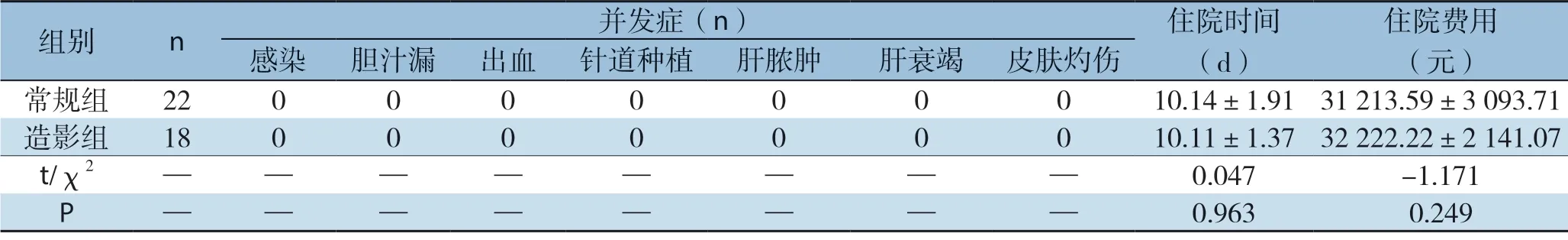
表2 常规组与造影组围手术期情况比较
多因素Logistic分析,自变量为肿瘤大小、年龄、性别、是否超声造影,是否单发病灶,因变量为是否完全消融,结果显示肝内单发病灶、是否肝内存在子灶、是否实时动态引导是影响RFA疗效的独立因素(表3)。
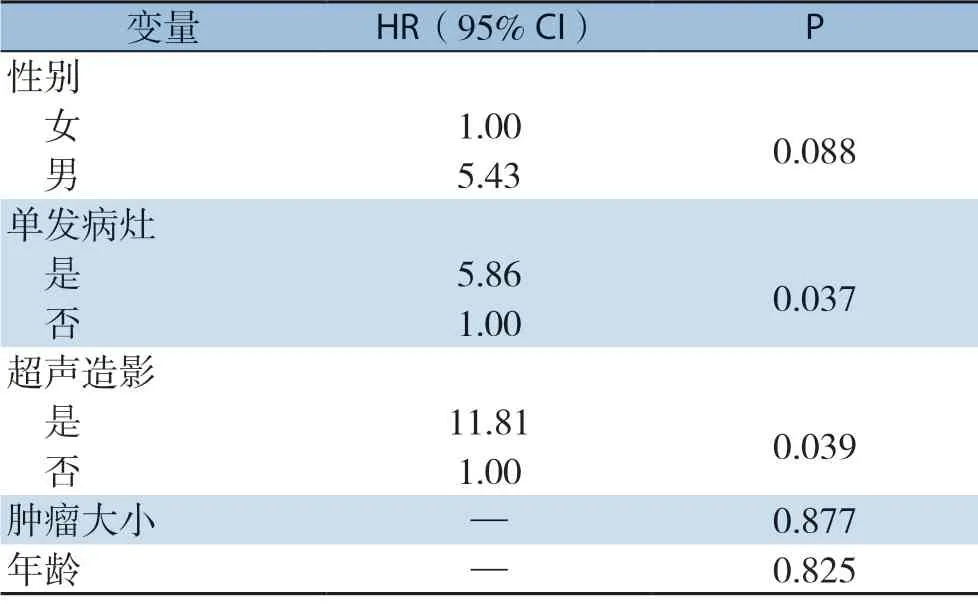
表3 RFA 疗效的多因素Logistic 回归分析
3 讨 论
RFA作为治疗原发性肝癌的重要治疗手段之一[12],具有疗效好、创伤小、恢复速度快、并发症少、可重复性强、对机体基本条件要求不高等优点,多项研究已表明,RFA治疗小肝癌可获得与手术切除相同的根治效果[13-15],目前临床应用广泛。然而多项研究也报道了RFA术后复发率较高,导致复发的重要原因是术前病灶的漏诊和术后病灶的残留[16]。
专家共识[11]指出:对子病灶的数量大于3个的肝癌患者,单纯RFA疗效不理想。然而由于术前漏诊,很多病灶数量>3个的患者使用了RFA治疗,对疗效产生了很大影响。本研究显示相比常规超声,超声造影后约11.1%的患者发现术前漏诊病灶,说明超声造影在判断肿瘤数目方面优于常规超声和增强CT,这与Bondar等[17-18]研究一致。与增强CT检查相比,超声造影具有较高的灵敏度及特异性,检查时血流信号信噪比更高,能反映出肿瘤组织中的低血流[19],可以减少术前漏诊率。
有研究[20-22]指出:肿瘤直径>5 cm的病灶,肿瘤内血流会带走部分热量,使得局部温度不能达到目标温度,从而不能完全消融。陈敏华[23]研究发现大约10%患者超声造影后因卫星灶多和周围浸润广泛而被确认不符合RFA的适应证。本研究提示,造影后病灶直径较前增大8例,约占44.4%。严昆等[24]也有相似结论,说明超声造影较常规造影更能准确诊断肿瘤浸润范围,常规超声检查对于边界不清晰、形态不规则肿瘤的测量存在误差,而术中对于肿瘤病灶浸润范围的确定,是预防RFA术后的病灶残留的关键性因素。超声造影第二代造影剂SonoVue是一种血池显像剂,直径约2.5 μm,小于红细胞,可通过肺循环,不会弥散到组织间隙,静脉注入后通过肺毛细血管进入左心,再经体循环到达全身微小血管,增强微小血管的信号强度,使肿瘤新生血管及微小病灶也得以完全显示[25],因此超声造影可以显示由周围微血管的浸润范围勾画出的肿瘤形状,对病灶大小及浸润情况提供合理参考,不仅可以精准评估肿瘤大小、指导RFA的精准治疗、降低复发概率,还可以作为有效的诊断手段用于排除不适合RFA治疗的病例,指导治疗方案的选择。
CT、MRI是术后RFA评效的主要手段,由于场地、仪器安装使用繁杂等原因导致无法术后实时评效,这种滞后性评效导致患者只有治疗结束后才能再次检查,CT由于存在辐射短期内也不宜多次检查,另外部分肝癌患者合因肝肾功能损伤较大无法行碘造影;MRI虽没有辐射,但检查时间过长、费用高,也无法实时引导;常规超声虽然可实时引导,但对RFA后的残存活性的部分病灶鉴别能力差,无法评估治疗效果;CT、MRI、常规彩超其局限性导致对肿瘤的控制率低,进一步增加了肿瘤的漏诊、漏治率[26-28]。而超声造影可以及时评效及补充治疗,准确鉴别射频消融导致的凝固性坏死和肿瘤残留,造影剂无肝肾毒性,不良反应发生率低,进入人体后随呼吸道排出,不经过肝肾代谢,可多次重复使用,较CT、MRI造影剂更安全[29]。本研究显示:超声造影和常规超声对于术后并发症、住院费用、住院时间上均无统计学差异(P>0.05)。超声造影可以减少术中漏诊及术后病灶残留情况,对于患者来说,漏诊及病灶残留也意味着增加住院时间及费用,更有可能错过最佳治疗时机导致疾病进展。
本研究通过对比超声造影和常规超声引导下RFA治疗原发性肝癌的临床数据,在漏诊和病灶残留两个维度说明了超声造影的优势,但存在数据量少、长期生存随访时间不够等不足,仍需要后续大样本、长时间的数据追踪随访进一步佐证。
综上,超声造影对肝癌RFA的诊断和治疗具有重要意义,可进一步减少漏诊、误诊,延长生存期的同时也提高了生存质量。其操作简便,副作用极少,具有重要的临床应用价值。
