术前/术后中性粒细胞-淋巴细胞比值与格拉斯哥预后评分对胆囊癌预后的预测价值
2020-09-14朱振成罗昆仑谢伟选祝梦娇朱庆洲柏杨李福利刘伟伟
朱振成,罗昆仑,谢伟选,祝梦娇,朱庆洲,柏杨,李福利,刘伟伟
(安徽医科大学无锡临床医学院/中国人民解放军联勤保障部队第九〇四医院 肝胆外科,江苏 无锡 214044)
胆囊癌(gallbladder carcinoma,GBC)是预后极差的恶性疾病,发病率在胃肠道肿瘤中排名第五,病死率近年来逐年升高,5年生存率难以突破10%,探究快速、有效的预后指标有助于早期发现肿瘤进展,及时调整治疗方案[1-3]。炎症与GBC发生发展相关,已有多个研究报道外周血炎症相关参数在评估GBC预后上存在价值,其中以中性粒细胞-淋巴细胞数比值(neutrophillymphocyte ratio,NLR)相关性最强[4-6]。近来有研究[7-8]报道术前/术后中性粒细胞-淋巴细胞比值(preoperative plus postoperative neutrophillymphocyte ratio,PP-NLR)与格拉斯哥预后评分(Glasgow prognostic score,GPS)在肝癌、胃癌等肿瘤中与患者生存相关,较单纯的术前或术后NLR更为全面有效,但相关研究在GBC中较少。本研究旨在通过回顾性分析明确PP-NLR及GPS是否在预测GBC预后上存在价值,并分析比较其预测效能。
1 资料与方法
1.1 一般资料
收集中国人民解放军联勤保障部队 第九〇四医院自2005年1月—2015年12月收治并行手术治疗的140例GBC患者临床资料,电话随访其生存(截止2018年12月)。其中男49例,女91例;年龄36~85岁,中位年龄64岁,平均(62.9±10.7)岁。血型中A型53例,B型34例,AB型18例,O型35例。实验室检查见术前白细胞(7.02±3.93)×109/L,术前CRP(4.90±22.60)g/L,术前白蛋白(39.19±5.48)m g/L,术前中性粒细胞(5.35±3.70)×109/L,术前淋巴细胞(1.46±0.58)×109/L,术后中性粒细胞(4.76±3.64)×109/L,术后淋巴细胞(1.59± 0.61)×109/L。肿瘤大小(2.97±2.20)cm。纳入标准:(1) 经外科治疗,术后病理确认为GBC;(2) 具有完整的术前及术后(术前1周、术后1个月)的实验室检查及影像学检查资料;(3)术后规律随访。排除标准:(1) 术后1个月内或围术期死亡; (2) 合并其他肿瘤病史;(3)术前1周或术后1个月合并感染性疾病(如肺部感染)或自身免疫性疾病[7]。
1.2 观察指标
一般资料:性别、年龄。病理学特征:肿瘤分化程度、肿瘤突破浆膜/侵犯肝脏、淋巴结转移。外周血参数:术前白细胞水平、术前CRP、术前及术后中性粒细胞和淋巴细胞绝对值、术前血小板等。肿瘤标志物:癌胚抗原(CEA)、CA19-9。预后情况:以患者总体生存期(OS)作为评价预后的指标,定义为手术到患者死亡的时间,以月为单位。计算手术前后NLR:(1) 术前NLR定义为术前1周中性粒细胞绝对值与淋巴细胞绝对值之比[7]; (2) 术后NLR定义为术后1个月中性粒细胞绝对值与淋巴细胞绝对值之比[7]。
1.3 赋值
根据ROC曲线界值决定手术前后NLR界值,升高则分别赋值为1,反之则为0,PP-NLR定义为两者赋值之和,分别为0、1、2[7];将术前血清白蛋白<35 g/L和术前CRP>10 g/L分别赋值为1,否则为0,GPS定义为两者赋值之和,分别为0、1、2[9]。
1.4 统计学处理
采用SPSS 23.0统计软件进行分析。建立受试者工作曲线(ROC曲线)确定手术前后NLR界值。符合正态分布的定量资料用均数±标准差(±s)表示,组间比较采用t 检验或方差分析(ANOVA);偏态分布的定量资料用中位数±四分位间距表示,组间比较采用Mann-Whitney U检验或Kruskal-Wallis秩和检验;定性资料通过χ2检验或Fisher精确检验分析。通过Kaplan-Meier法进行生存分析并绘制生存曲线,Log-rank检验进行组间差异性对比;Cox风险比例模型进行多因素分析。通过Spearman相关性分析研究因素间相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 ROC 曲线确定界值
分别取患者手术前后NLR值建立ROC曲线,敏感度和特异度最大值点为其界值,作为术前、术后NLR的界值。结果显示术前NLR的界值为2.51,此时的敏感度为0.961,特异度为0.788(图1A);术后NLR的界值为2.38,此时的敏感度为0.745,特异度为0.712(图1B)。
2.2 PP-NLR 及GPS 与患者生存之间的关系
纳入研究的共1 4 0例G B C 术后患者中,至今存活有1 9例,1、2、3、5年生存率分别为5 5.0%、3 5.7%、2 2.1%、1 7.9%,平均生存期(24.2±23.6)个月,中位生存期12.0 个月(图2 A)。PP-NLR=0、1、2 的3组患者1年生存率分别为97.6%、62.5%、16.9%;3年生存率分别为5 8.5%、1 7.5%、0%;5年生存率为4 1.5%、1 0.0%、0%,均显示逐渐降低趋势,Kaplan-Meier生存分析显示差异存在统计学意义(P <0.0 5),生存曲线见各组间生存情况存在显著差异(P<0.05)(图2B)。GPS=1和GPS=2的两组患者生存曲线未见显著差异,但GPS=0和GPS=1或2的两组患者之间生存差异有统计学意义(均P<0.05)(图2C)。Kaplan-Meier生存分析显示GPS=0和GPS=1+GPS=2两组1年生存率分别为81.0%和23.5%;3年生存率分别为35.4%和4.9%;5年生存率为30.4%和1.6%,差异存在统计学意义(P<0.05)(图2D)。
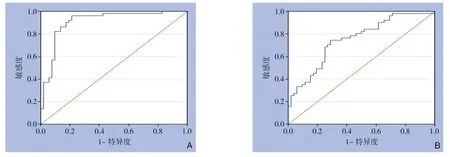
图1 不同时期NLR 的ROC 曲线 A:术前NLR;B:术后NLRFigure 1 ROC curves of NLR in different time periods A: Preoperative NLR; B: Postoperative NLR
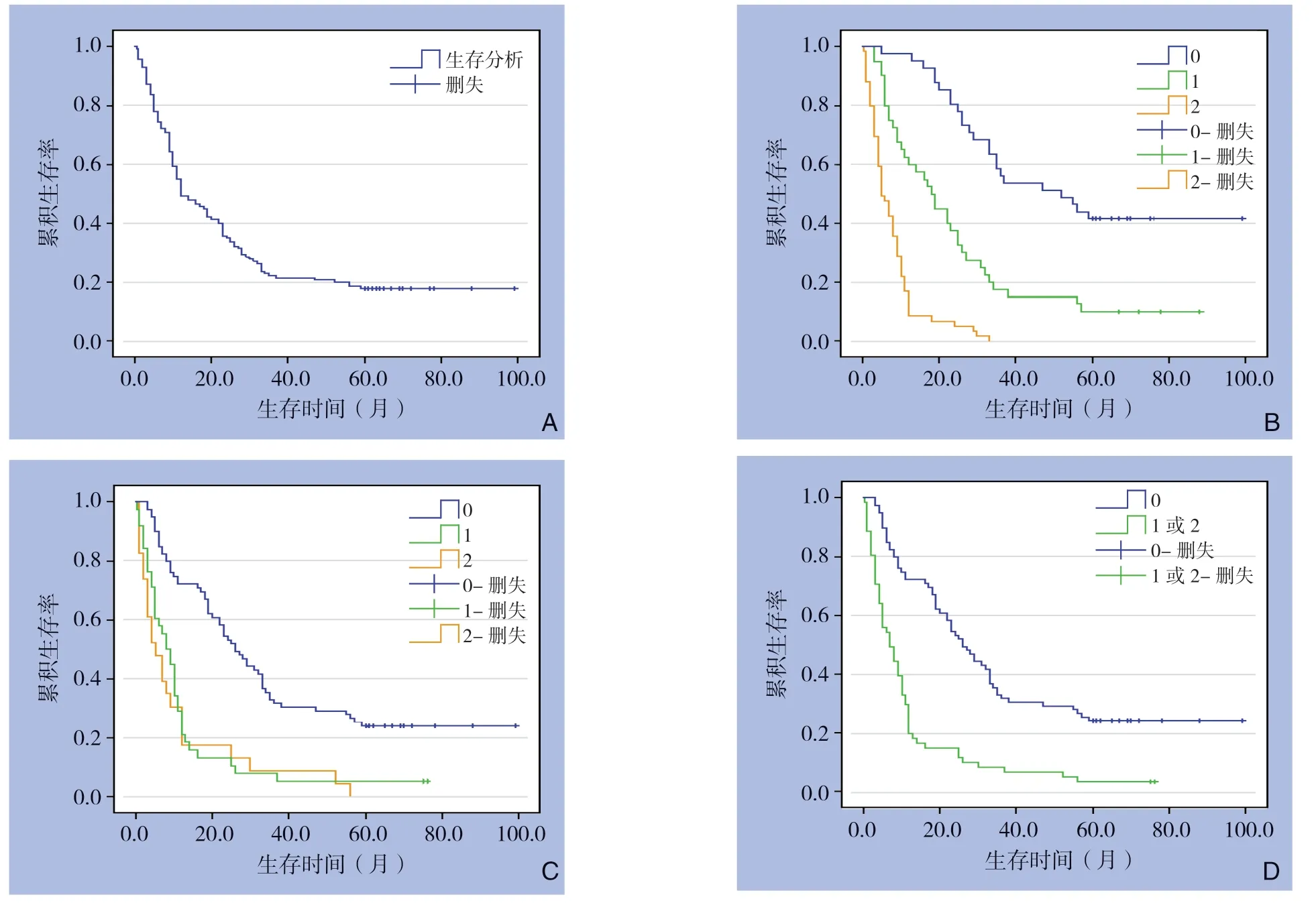
图2 生存曲线分析 A:140例GBC 患者总体生存曲线;B:不同PP-NLR 值(PP-NLR=0、PP-NLR=1,PP-NLR=2)患者的生存曲线;C:不同GPS 值(GPS=0、GPS=1、GPS=2)GBC 患者的生存曲线;D:不同GPS 值(GPS=0、GPS=1 或2)患者生存曲线Figure 2 Survival curve analysis A: The overall survival curve of the 140 GBC patients; B: The survival curves of patients with different PP-NLR values (PP-NLR=0, PP-NLR=1, PP-NLR=2); C: The survival curves of patients with different GPS values (GPS=0, GPS=1, GPS=2); D: The survival curves of patients with different GPS values (GPS=0, GPS=1 or 2)
2.3 不同PP-NLR 分组下患者临床资料对比
根据PP-NLR赋值分组的3组患者在性别、年龄、病理类型、血小板、胆碱酯酶方面比较,差异无统计学意义(均P>0.05)。在低根治率、原发灶突破浆膜/侵犯肝脏、淋巴结转移、远处转移、低分化程度、浸润性生长模式、晚期肿瘤、黄疸、高白细胞水平、肿瘤指标等方面差异存在统计学意义(均P<0.05)(表1)。
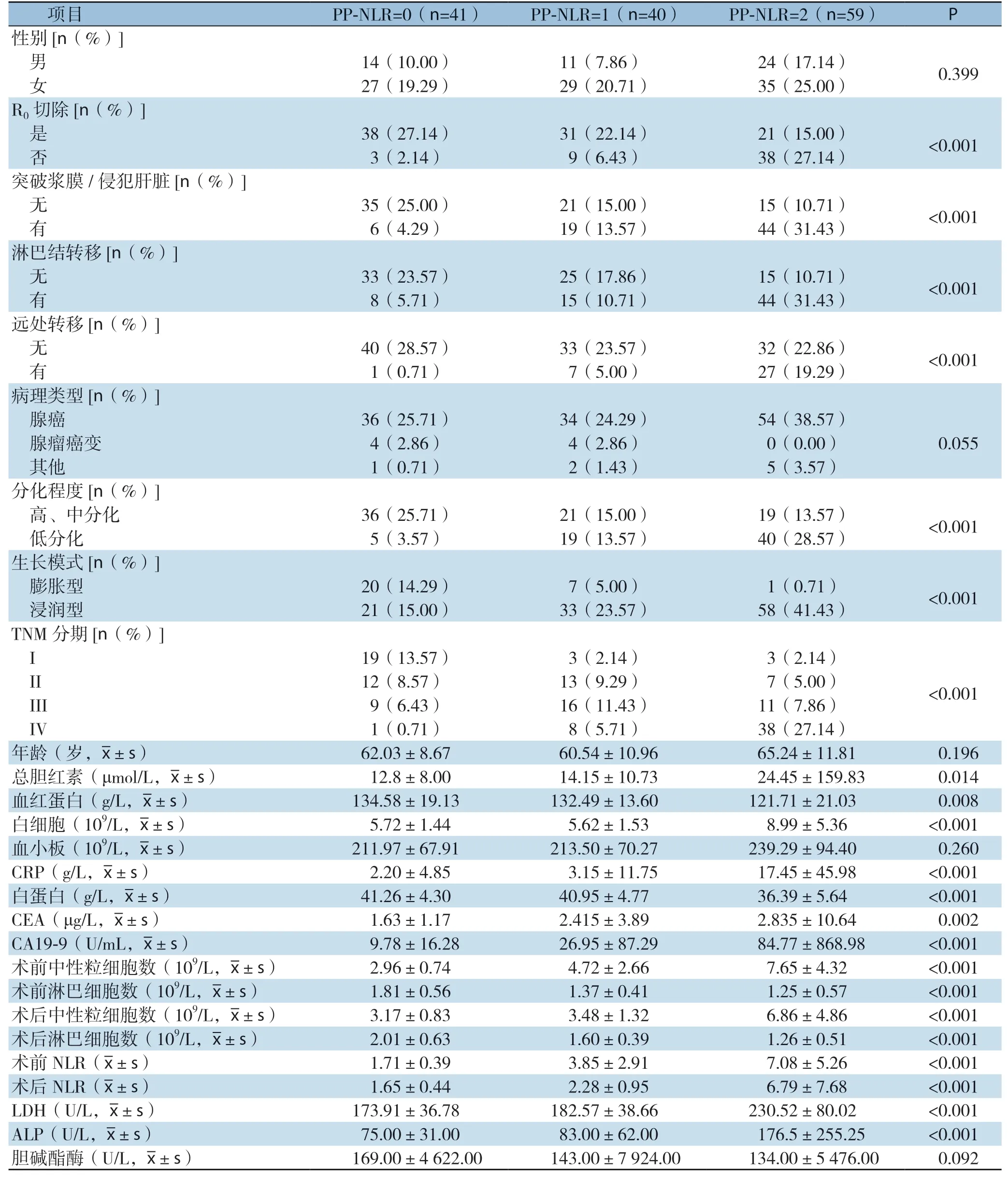
表1 不同PP-NLR 患者的临床资料比较Table 1 Comparison of the clinical data of patients with different PP-NLR
2.4 不同GPS 分组下患者临床资料对比
GPS=1和GPS=1+GPS=2两组患者在性别、年龄、术前胆红素水平、术前及术后淋巴细胞计数、CEA、LDH中差异无统计学意义(均P>0.05)。 在低根治率、原发证突破浆膜/侵犯肝脏、淋巴结转移、远处转移、低分化程度、浸润性生长模式、晚期肿瘤、高CRP水平、CA19-9等方面差异存在统计学意义(均P<0.05)(表2)。
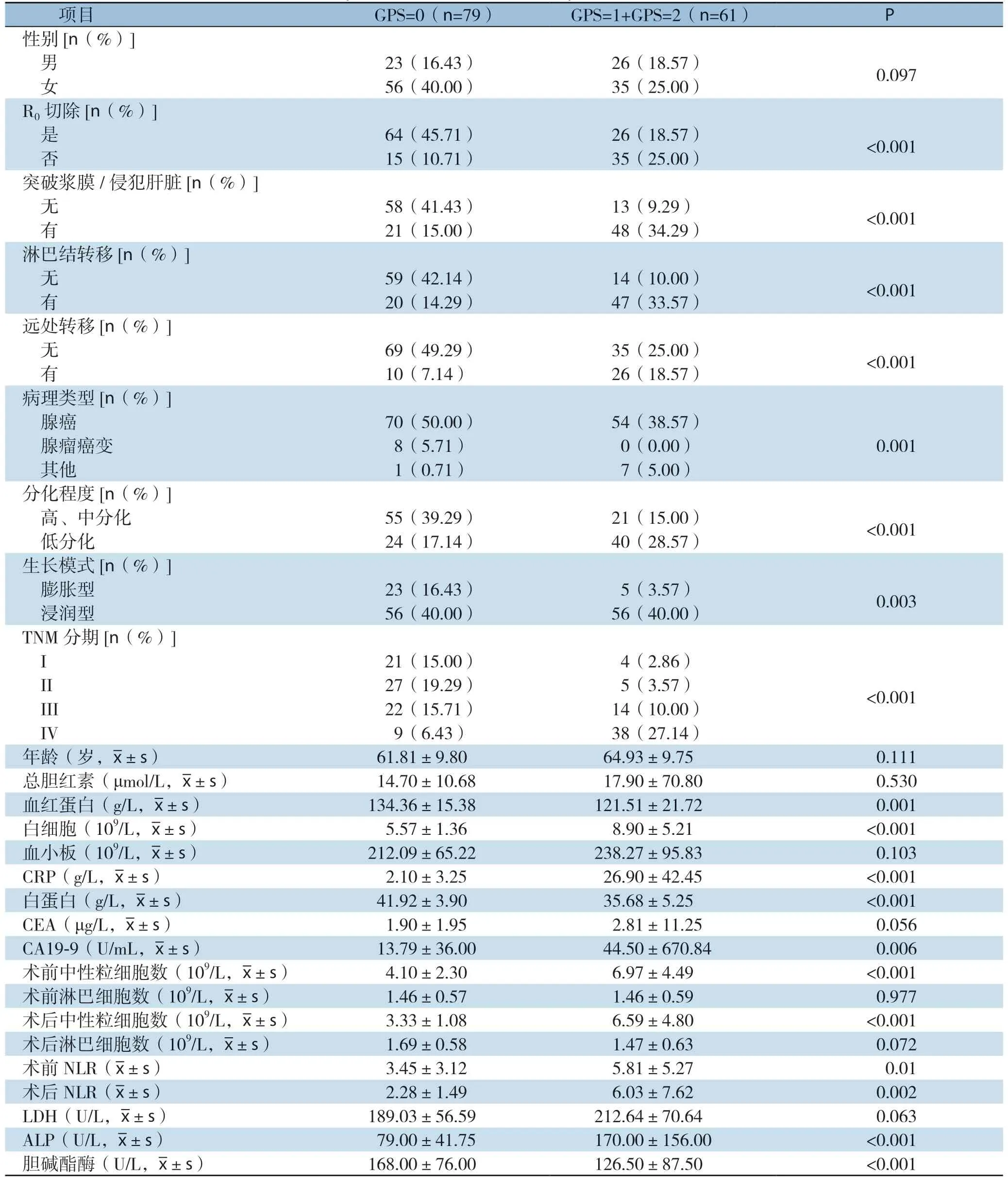
表2 不同GPS 分组患者的临床资料对比Table 2 Comparison of the clinical data of patients with different GPS
2.5 PP-NLR 及GPS 与病理特征之间的相关性分析
相关性分析提示,PP-NLR 与GPS的升高与手术根治率和分化程度负相关,与原发灶突破浆膜/侵犯肝脏、淋巴结转移、远处转移、肿瘤TNM分期、CEA及CA19-9正相关,且与肿瘤浸润型生长的出现呈正相关(均P<0.05)。此外,在根治率、远处转移、肿瘤分期、肿瘤分化程度与生长模式、以及肿瘤标志物CEA和CA19-9方面PP-NLR的相关性较GPS更强(表3)。
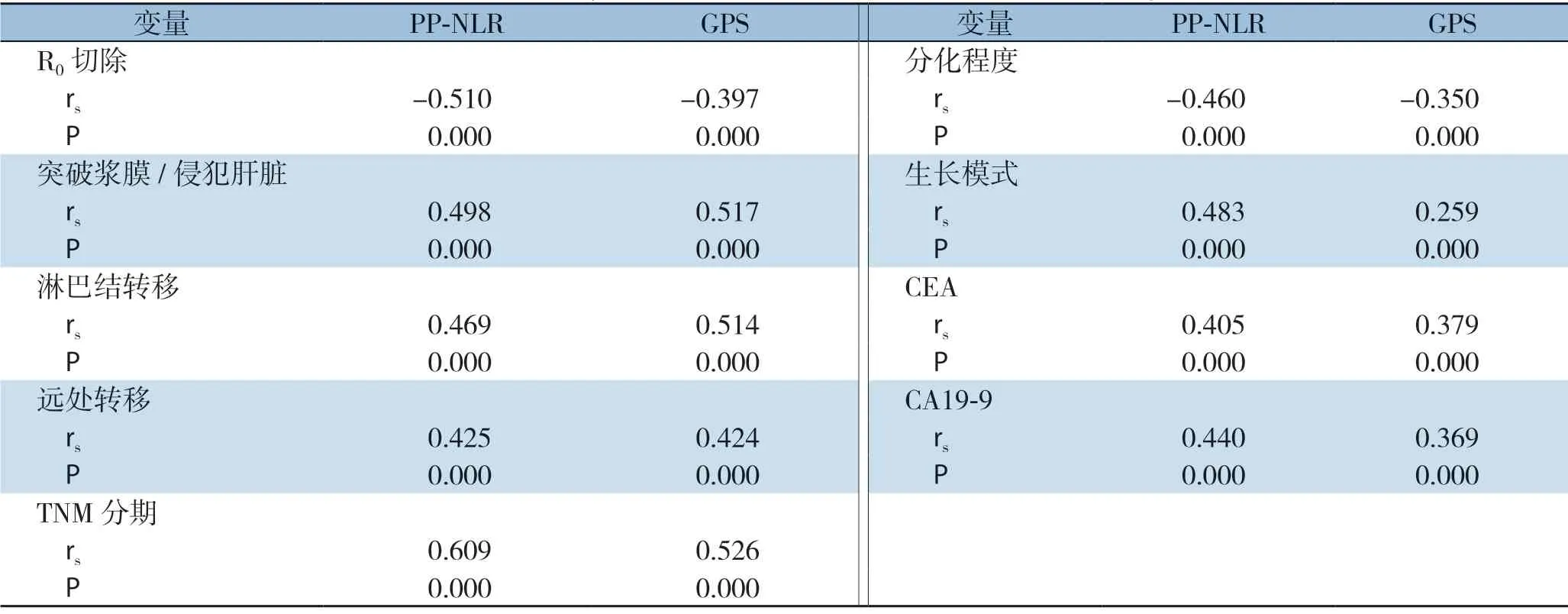
表3 PP-NLR 及GPS 与临床病理特征之间的相关性分析Table 3 Correlation analysis of PP-NLR and GPS with the clinicopathologic features
2.6 外周血炎症相关指标与病理特征对患者预后影响的单因素分析
单因素分析显示PP-NLR、术前GPS、术前NLR、术后NLR、术前总胆红素水平、术前CRP、术前白蛋白水平、术前血红蛋白、术前CEA及CA19-9、肿瘤分化程度、原发灶突破浆膜/侵犯肝脏、淋巴结转移均会影响GBC术后生存;而年龄、性别、术前白细胞水平对预后的影响差异无统计学意义(均P>0.05)(表4-5)。
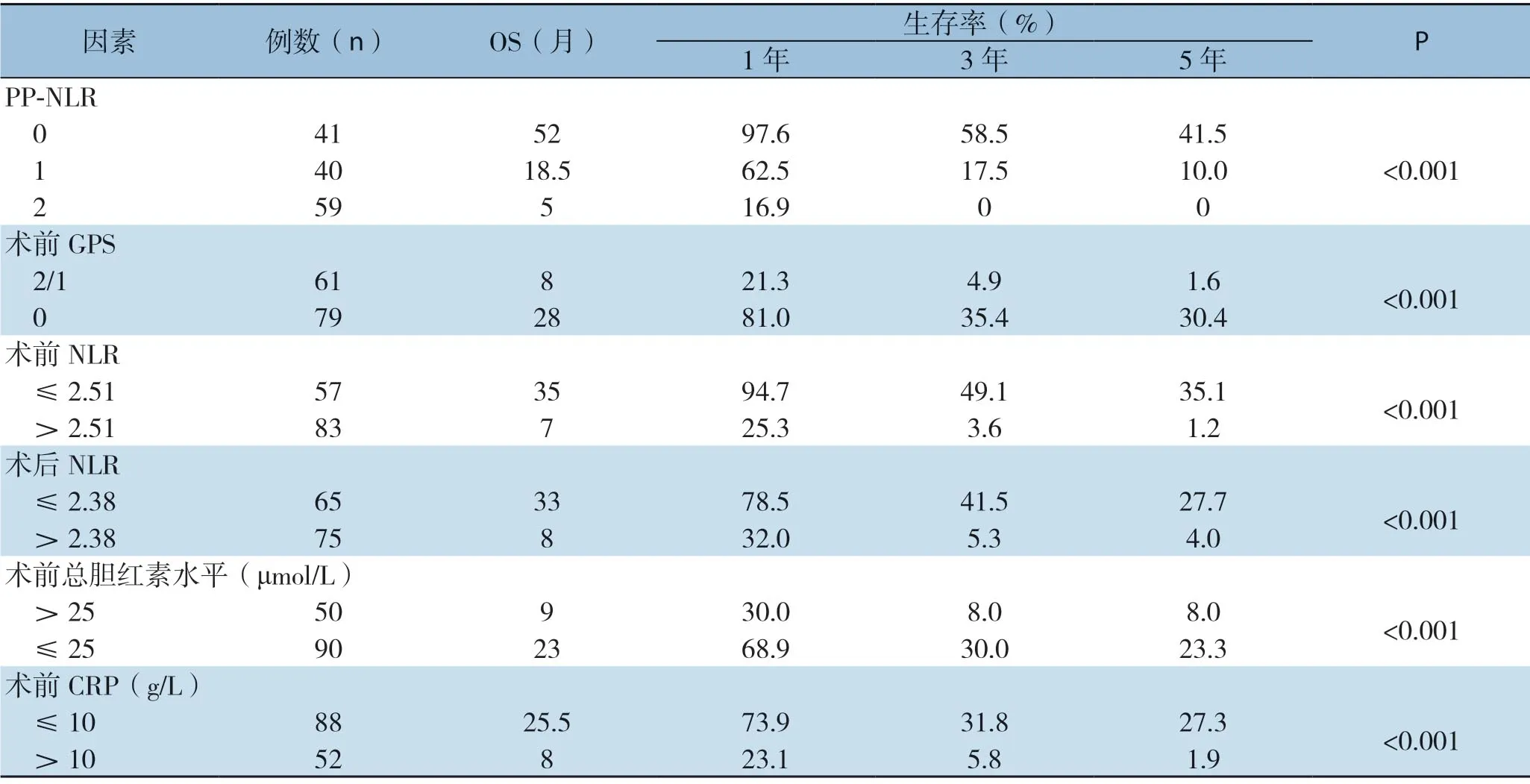
表4 140例GBC 患者外周血相关参数与总体生存的单因素分析Table 4 Univariate analysis of peripheral blood-related parameters and overall survival in the 140 GBC patients
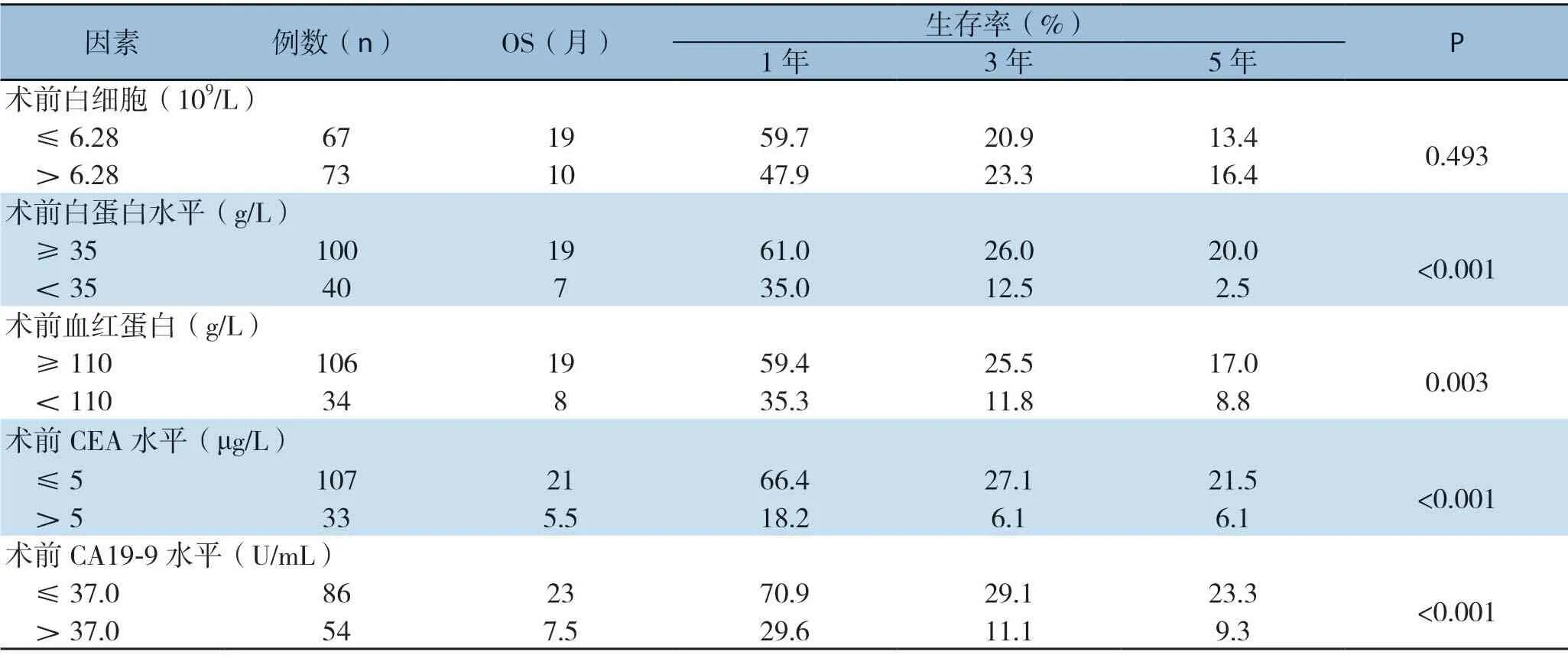
表4 140例GBC 患者外周血相关参数与总体生存的单因素分析(续)Table 4 Univariate analysis of peripheral blood-related parameters and overall survival in the 140 GBC patients (continued)
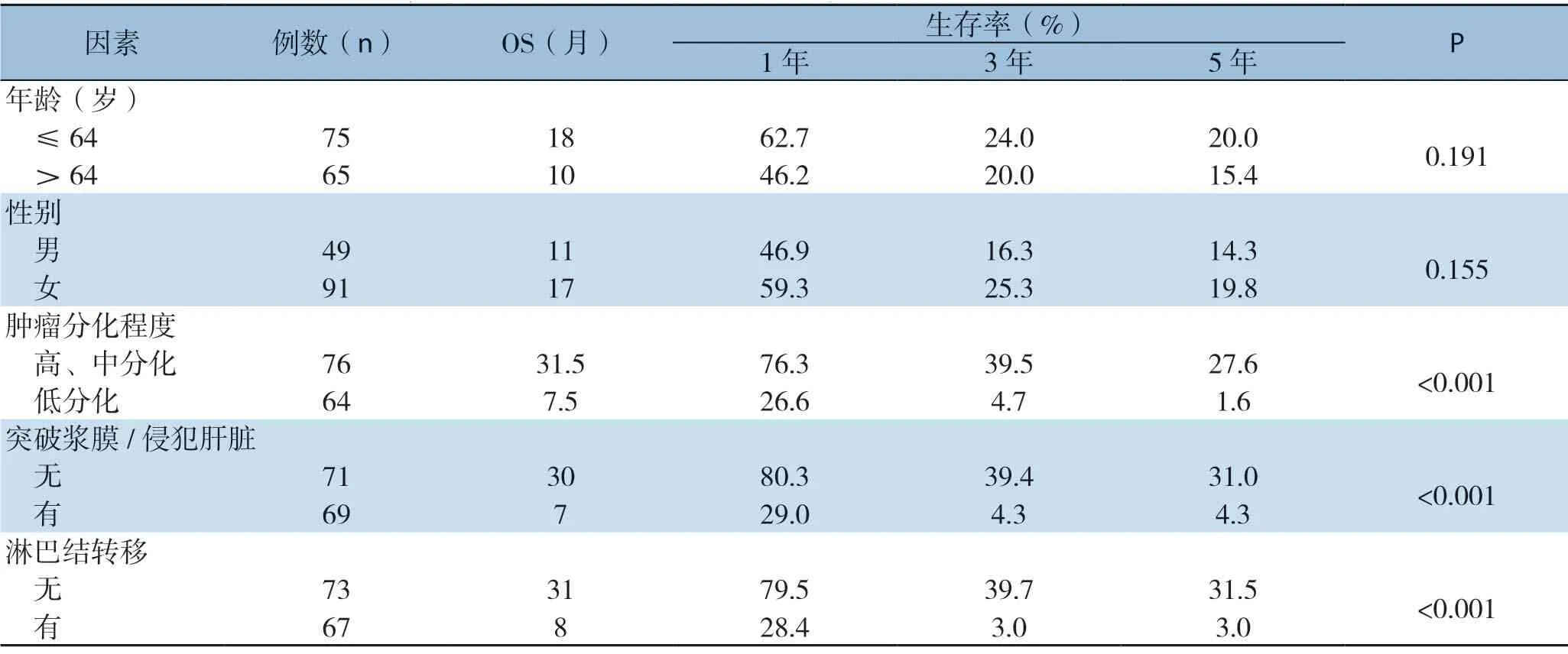
表5 140例GBC 患者临床病理因素对总体生存影响的单因素分析Table 5 Univariate analysis of the impact of clinicopathologic factors on overall survival in the 140 GBC patients
2.7 影响患者生存的Cox 多因素分析
Cox多因素分析结果显示PP-NLR=1(HR=0.143,95% CI=0.079~0.261,P<0.05)和PP-NLR=2(HR=0.357,95% CI=0.221~0.575,P<0.05)、淋巴结转移(HR=3.278,95% CI= 2.063 ~5.209,P <0.0 5)、肿瘤分化程度(HR=2.329,95% CI=1.466~3.699,P<0.05)为影响GBC术后生存的独立危险因素(表6)。
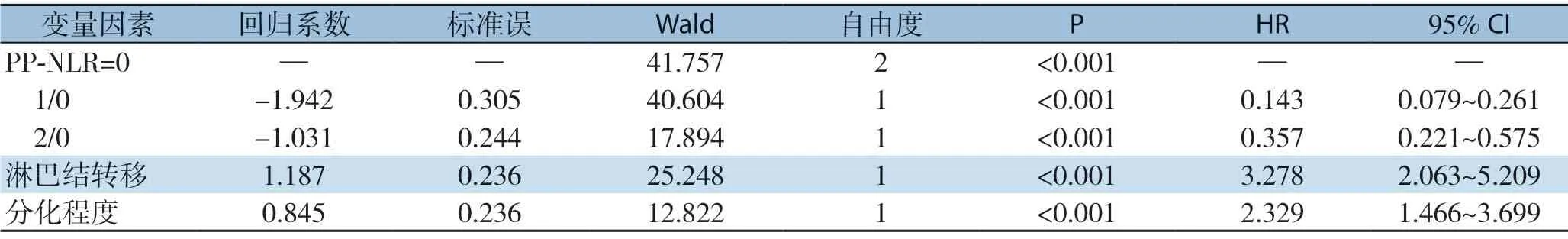
表6 影响GBC 患者预后的外周血参数及病理特征的Cox 多因素分析Table 6 Cox multivariate analysis of peripheral blood parameters and pathological characteristics that affect the prognosis of patients with gallbladder cancer
3 讨 论
GBC患者术后肿瘤病理特征及TNM分期常被用作评估预后和疗效的重要因素,具有理论和实践的依据。但在临床实际工作中,很多情况下往往无法准确分期,如术前、复发肿瘤和姑息性手术的患者等,为制定GBC患者手术及术后辅助治疗方案带来了不确定性。近年来随着对炎症、免疫微环境的研究不断深入,GBC与炎症、免疫之间的密切关系已经广泛被学者所认可[10-16]。中性粒细胞和淋巴细胞是构成免疫反应的重要部分,在肿瘤形成后,外周血中性粒细胞会在趋化因子的作用下聚集在肿瘤组织中,转变为肿瘤相关中性粒细胞(tumor-associated neutrophils,TANs),通过分泌弹性蛋白酶、MMP-9及活性氧等多种因子促进肿瘤增殖,同时,术后淋巴细胞的明显下降常与免疫抑制相关,其数值的及时恢复提示预后较好[17-20]。CRP和白蛋白反映了系统炎症与营养状态,研究[21-23]表明外周血CRP的升高和白蛋白的降低与不良预后相关。外周血参数具有快速简便、可复性高的特点,利用外周血参数评估患者预后有助于及时掌握患者肿瘤进展,为临床手术和辅助治疗提供参考。
尽管有研究[24-26]证明外周血中性粒细胞、淋巴细胞、CRP和白蛋白等与肿瘤预后相关,但是单一指标受外界影响变化较大,通过建立多变量模型共同考虑有助于提高准确性。已有一系列研究报道术前NLR、血小板-淋巴细胞比值(plateletlymphocyte ratio,PLR)、单核-淋巴细胞比值(monocyte-lymphocyte ratio,MLR)等外周血参数与GBC、肝癌等多种肿瘤预后相关,其中以术前NLR相关性最强。Wu等[9]在新近的研究中发现术前GPS也与GBC患者预后相关,且较NLR预测效能更高。尽管术前外周血参数指标可以在手术之前快速判定肿瘤大致预后,为手术治疗提供一定参考,但是较为片面的关注术前指标而忽视术后炎症免疫状态可能无法准确预测患者预后,影响后续辅助治疗的疗效。Ohno等[27]在研究肾癌时提出术前NLR及术后NLR均未升高者预后明显较好,结合术前及术后的NLR可能有助于观测肿瘤患者术后疗效。李坚等[28]在研究NLR与结肠癌预后关系时发现,动态监测NLR变化有助于观测患者疗效,为精准化治疗提供参考。吴美龙等[7]在研究肝癌预后因素时提出PP-NLR可以全面监测患者术前及术后整个治疗过程的炎症免疫平衡状态,与肿瘤预后相关性显著(P<0.05)。目前关于GPS在预测GBC预后中作用的报道极少,更无研究在GBC中结合术前及术后NLR评估预后,值得探究其有 效性。
本研究在建立ROC曲线后,通过其界值确定术前及术后的NLR临界值分别为2.51及2.38,与其他相关研究大致相符[3,29-30]。通过外周血指标计算得出PP-NLR及GPS,生存分析显示PP-NLR=0、1、2各组间均存在差异(P<0.05),而GPS=1和2组间生存无显著差异、GPS=0组较GPS=1和2组生存期明显延长(P <0.0 5)。单因素分析提示PP-NLR及术前GPS均为影响GBC预后的因素,且Cox多因素分析结果显示PP-NLR、淋巴结转移、肿瘤分化程度为影响G B C 预后的独立危险因素(P<0.05),较术前GPS预测效能更高。相关性分析显示PP-NLR与GPS与肿瘤分期分化、侵犯及转移程度和肿瘤指标等多种临床病理因素相关,且以PP-NLR总体相关度更强,进一步支持了PPNLR具有更强的预测能力。术前联合术后NLR评估患者预后不仅考虑了术前患者的系统炎症免疫状态,还考虑了术后患者免疫抑制的程度,综合考量了患者术前及术后整个治疗过程,较单一片面的观测术前指标预测效能更高,可以在术后肿瘤分期之外为评估患者疗效提供一定的辅助。此外,动态检测患者不同时期的NLR值有助于实时观测患者炎症、免疫微环境变化,可能有助于早期发现肿瘤进展和复发,及时予以相应的辅助放、化疗;同时,对于NLR异常提示有免疫抑制的患者,可考虑在放化疗之前予以治疗增强免疫,以避免进一步的免疫抑制出现。然而对于还未行手术治疗的患者,PP-NLR的预测能力有限,此时术前GPS也可起到一定的评估作用,为手术治疗提供参考。
综上所述,炎症及免疫微环境变化会对GBC的预后产生影响,系统炎症免疫状态相关指标PPNLR和GPS在预测GBC患者预后上均存在价值,具有快速简便的优点,与肿瘤侵袭、进展相关。其中PP-NLR综合考虑了患者术前及术后的系统炎症状态,观测全面,预后判定效能较GPS更高。对于暂未手术的患者,GPS结合术前NLR、影像学相关资料有助于确定手术范围,达到精准切除,提高根治率。然而本研究也存在着一些不足,单中心及样本量的不足可能会对结果产生一定偏倚,鉴于PP-NLR及术前GPS的简便易取和高度可复性,进一步多中心、大样本的研究以明确其灵敏度可能是需要的,以期为改善GBC的不良预后提供新的思路。
