氮、磷共掺杂碳点在Fe3+检测和细胞多色成像中的应用
2020-09-14李晓峰李林石利红董川双少敏
李晓峰,李林,石利红*,董川*,双少敏
(1.太原学院,山西 太原 030032;2.山西大学 化学化工学院,山西 太原 030006)
0 引言
荧光碳点(CDs)是一种粒径小于10 nm的新型荧光纳米材料,由带有羧基、羟基等基团的氧化碳壳和sp2杂化碳的无定形或结晶形的碳核组成[1]。与传统的量子点相比,CDs成本比较低、粒径相对较小、水溶性较好、易制备,并且绿色环保[2-8]。碳点这些优异的性质使其应用于诸多领域,如光催化[9-10]、重金属离子检测[11-15]、化学和生物传感器[16-21]、生物成像[22-24]、药物传送等[25]。
近年来,研究者们在制备CDs的方法上不断探索创新,将CDs和各种杂原子掺杂,从而增强碳点荧光并拓宽其应用。Wang等[26]用柠檬酸为碳源、乙二胺为氮源,制备了量子产率高达41.3%的氮掺杂荧光碳点。Gong等[27]用南瓜和磷酸在90℃下反应1 h得到了氮、磷共掺杂的黄色荧光碳点。Xu等[28]将柠檬酸钠溶液和氯化锌溶液混合,通过水热反应合成了锌掺杂碳点。以上方法利用不同碳源和掺杂剂合成了杂元素掺杂的碳点,提高了碳点的荧光性能。但是,上述报道的方法制备过程烦琐,掺杂剂多为有毒化学试剂,不利于碳点在生物方面的应用。所以开发一种成本低、绿色环保、简单的掺杂碳点的制备方法是一个具有挑战性的课题。
铁作为人体内含量最丰富的必需过渡金属元素,在氧运输、转录调控、氧代谢和电子传递等许多生物学过程中都发挥着重要的作用[29-30]。铁摄入量不足和过量都会导致一些疾病,甚至危及生命。例如,过量的铁摄入由于自由基的形成会导致组织损伤。但铁的缺乏也会导致各种疾病,如胰腺、心脏、阿尔茨海默病、潘金森病和肝病等[31-33]。因此,测定铁离子对这些疾病的早期识别和诊断具有重要意义。目前铁离子测定的方法主要有高效液相色谱法、伏安法和荧光光谱法等。而荧光光谱法由于具有低成本、易操作和快速检测等优势,受到了研究者们的更多青睐。近年来,碳点作为荧光探针已被用于铁离子检测[31,34-37]。我们课题组开发了未掺杂[38]和氮掺杂[39-40]的荧光碳点铁离子探针。
本研究选择杏仁为碳源,通过热解-水热法无须表面修饰或表面钝化直接合成了氮、磷共掺杂的荧光碳点(N,P-CDs)。采用杏仁为原料制备荧光碳点的优点在于:原料成本低廉、绿色环保;本方法是在不添加任何其他化学试剂的情况下,仅采用杏仁为单一碳源就实现了氮、磷共掺杂,得到了具有较高荧光量子产率的碳点。合成的N,P-CDs具有好的生物相容性、高的光稳定性和低的毒性,并且对Fe3+表现出高度选择性。基于这些特性,我们将N,P-CDs应用于活细胞中Fe3+传感及细胞多色成像。
1 实验部分
1.1 主要试剂与仪器
杏仁(山西,中国);NaH2PO4、Na2HPO4、浓HNO3、浓HCl、MnCl2、NaCl、NiCl2和 ZnCl2、AlCl3、BaCl2、CaCl2、CdCl2、CoCl2、CuCl2、FeCl3、HgCl2、KCl、MgCl2;硫酸奎宁;3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)。所有试剂为分析纯,实验用水为去离子水。
透射电子显微镜(JEOL JEM-2100);紫外-可见分光光度计(普析TU-1901);荧光分光光度计(F-280);X射线光电子能谱仪(AXIS ULTRA DLD);荧光光谱仪(FLS920);激光共聚焦仪(Olympus)。
1.2 实验过程
1.2.1 碳点的制备
用杏仁作为碳材料,采用热解-水热法合成N,P-CDs。具体步骤如下:将盛有6 g杏仁的坩埚放在马弗炉中,于300℃下热解2 h。然后将热解产物研细成粉。称取0.1 g该粉末将其分散于20 mL的去离子水中,搅拌制得混合液,再转移到水热反应釜中,在200℃,4 h的条件下水热反应。待冷却至室温后,将悬浊液体用离心机离心,将离心得到的溶液放入透析袋(截留分子量为500~1 000 Da)在去离子水中纯化48 h,最终得到荧光碳点水溶液。最后冷冻干燥得到N,P-CDs固体粉末。
1.2.2 量子产率的计算
通过将标准物质硫酸奎宁溶于0.1 mol/L硫酸中(量子产率为54%)作为参比溶液,来计算碳点溶液的量子产率。
1.2.3 Fe3+的检测
Fe3+选择性检测在Tris-HCl缓冲液中进行。操作如下:在500 μL Tris-HCl缓冲液中加入50 μL碳点水溶液(1.6 mg/mL),然后分别加入2 μL浓度为 0.1 mol/L的不同金属离子溶液(CoCl2、CuCl2、KCl、AlCl3、FeCl3、HgCl2、MgCl2、BaCl2、CaCl2、CdCl2、MnCl2、NaCl、NiCl2和 ZnCl2),设定激发波长为350 nm,测定荧光发射光谱。重复测试3次。
知行合一是习总书记非常重视,多次强调的教育理念。习总书记曾经指出:“贵在坚持知行合一、坚持行胜于言,在落细、落小、落实上下功夫。要注意把社会主义核心价值观日常化、具体化、形象化、生活化,使每个人都能感知它、领悟它,内化为精神追求,外化为实际行动,做到明大德、守公德、严私德。”而将思政教育纳入学科竞赛体系正是以知行合一精神贯彻社会主义核心价值观的重要举措。对于文科学生而言,知行合一重在行,很多文科生的知识被停留在课堂上和课本上,而不是运用到生活和工作实践中,而学科竞赛为文科学生提供了学以致用的舞台。
Fe3+的灵敏度检测的步骤如下:在500 μL Tris-HCl缓冲液中加入50 μL碳点水溶液(1.6 mg/mL),然后再加入2 μL不同浓度的Fe3+标准溶液,设定激发波长为350 nm,测定荧光发射光谱。重复测试3次。
1.2.4 细胞成像
首先,在 37℃、体积分数5% CO2的条件下,含质量分数10%胎牛血清(FBS)的 DMEM 中培养人肝细胞癌(HepG2)细胞12 h。再将碳点水溶液(300 μL, 1.6 mg/mL)用移液枪慢慢加入培养液(1.0 mL)中,培养 1 h。选取pH为7.4的Tris-HCl缓冲液洗涤细胞3次,并保持在Tris-HCl缓冲液中使用激光共聚焦仪进行细胞成像。
2 结果与讨论
2.1 碳点的制备
用杏仁作为碳源通过热解-水热法成功制备了N,P-CDs(如图1)。杏仁经热解后获得的碳点呈现出较弱的蓝色荧光,为增强其荧光,需要进一步进行水热处理。我们推测在高温高压下水热处理可能有助于碳点的粒径均匀和表面官能团增加,从而表现出更好的荧光性能[41]。使用硫酸奎宁作为参比,测得经热解和水热处理制得的碳点的荧光量子产率分别为12.3%和20.4%。
2.2 碳点的表征
2.2.1 碳点的形貌表征
图2为使用TEM对N,P-CDs的粒径分布和形貌进行表征。图2A、2B、2C分别为不同比例尺下(100、50和20 nm)N,P-CDs的TEM图。从图中可看出,N,P-CDs呈球形且分散均匀。图2A的插图表明N,P-CDs的粒径分布窄,大多集中在3~9 nm范围内。对上百个碳点进行统计分析,得出N,P-CDs的平均粒径为(5.47±0.60) nm。图2D为N,P-CDs的高分辨TEM(HRTEM)图,从图中可看出N,P-CDs有明显的晶格结构,晶格间距大约为0.2 nm,可归于石墨的102晶面。图3为使用AFM对N,P-CDs表面的高度和分布情况进行分析。从AFM的表征结果可看出,N,P-CDs的高度主要集中在2 nm附近。

图1 碳点的制备过程示意图Fig.1 Schematic illustration for the preparation of N, P-CDs from pyrolysis of apricot kernel and the PL enhancement by hydrothermal treatment
2.2.2 碳点的结构特征

图2 (A)N,P-CDs的TEM图(比例尺为100 nm),插图:N,P-CDs的粒径分布图;(B)N,P-CDs的TEM图(比例尺为50 nm);(C)N,P-CDs的TEM图(比例尺为20 nm);(D)N,P-CDs的HRTEM图(比例尺为2 nm)Fig.2 TEM images of N,P-CDs with scale bar of 100 nm (A) (Inset: corresponding size distribution histogram);scale bar of 50 nm (B); scale bar of 20 nm (C);(D) HRTEM of N,P-CDs with scale bar of 2 nm

图3 N,P-CDs的AFM 图(A) N,P-CDs (5 μm×5 μm)的平面图;(B) N,P-CDs (5 μm×5 μm)的三维图像;(C) N,P-CDs (5 μm×5 μm)的平面图。(D) 图3c中直线N,P-CDs的高度分布Fig.3 AFM images of N,P-CDs(A) flat view of N,P-CDs (5 μm×5 μm);(B) 3D image of N,P-CDs (5 μm×5 μm);(C) flat view of N,P-CDs (5 μm×5 μm); (D) the altitude distribution of N,P-CDs of straight line in Fig. 3C
2.2.3 碳点的紫外-可见吸收和荧光发射光谱
为了考察N,P-CDs的光学性质,我们做了紫外吸收光谱和荧光光谱。从N,P-CDs的紫外-可见吸收光谱图(图5A)可看出,没有明显的吸收峰。从N,P-CDs的荧光发射光谱图中可看出:在 350 nm 激发下,在 440 nm 处出现荧光峰。从图5B可看出:当激发波长逐渐增加的时候,N,P-CDs荧光峰强度呈现先增加后降低,同时荧光峰位置发生红移。
2.2.4 碳点的荧光寿命和稳定性
荧光寿命是碳点返回基态之前在激发态停留的时间,以纳秒计量。图6A为N,P-CDs的荧光衰减曲线,通过拟合、计算可知N,P-CDs荧光寿命为6.307 3 ns。我们还对N,P-CDs的光学稳定性进行了研究。图6B为pH值对N,P-CDs荧光峰强度的影响,从图中可看出,pH值在3.0到10.0的范围内,N,P-CDs的荧光峰强度变化不大。说明所制得的N,P-CDs具有强的抗酸碱性。为了将该碳点应用于实际,还考察了在紫外灯下照射1.5 h和贮存放置3个月过程中N,P-CDs的荧光强度(图6C和图6D)。从图中可看出:紫外辐射时间和贮存时间对N,P-CDs的荧光峰强度几乎没有影响。说明所制得的N,P-CDs的稳定性良好。
2.3 碳点的应用
2.3.1 水溶液中N,P-CDs的Fe3+传感
Fe3+可以猝灭荧光,因此我们可以基于N,P-CDs荧光猝灭法检测Fe3+。pH 7.4时,在N,P-CDs的溶液中加入不同的离子(Co2+、 Cd2+、Cu2+、Ni2+、Ca2+、Fe3+、Ba2+、Mg2+、Zn2+、Mn2+、K+、Al3+、Hg2+和 Na+),观察荧光强度的变化。如图7A所示,Fe3+对N,P-CDs表现出明显的荧光猝灭效应,其他金属离子对N,P-CDs的荧光强度影响不大,说明我们合成的N,P-CDs对Fe3+有很好的选择性,可将其设计成Fe3+荧光探针。FTIR和XPS显示制备的N,P-CDs表面含有羧基和氨基,这种猝灭可能是由于Fe3+与N,P-CDs表面的羧基络合作用导致的。

图4 (A)为N,P-CDs的XPS谱图;(B)、(C)、(D)和(E)分别为N,P-CDs的 C1s O1s,N1s和P2P谱图;(F)为N,P-CDs的 FTIR 谱图Fig.4 (A) XPS spectrum of N,P-CDs, (B) C1s , (C) O1s, (D) N1s和(E) P2p spectra of N,P-CDs, (F) FTIR spectrum of N,P-CDs

图5 (A)N,P-CDs的吸收光谱图、荧光激发和荧光发射光谱图。(B)不同激发波长下的荧光发射光谱图。插图为相对应的归一化光谱图Fig.5 (A) UV-vis absorption, PL excitation and emission spectra of N,P-CDs,(B) PL spectra of N,P-CDs at different excitation wavelength.Inset: corresponding normalized spectra.
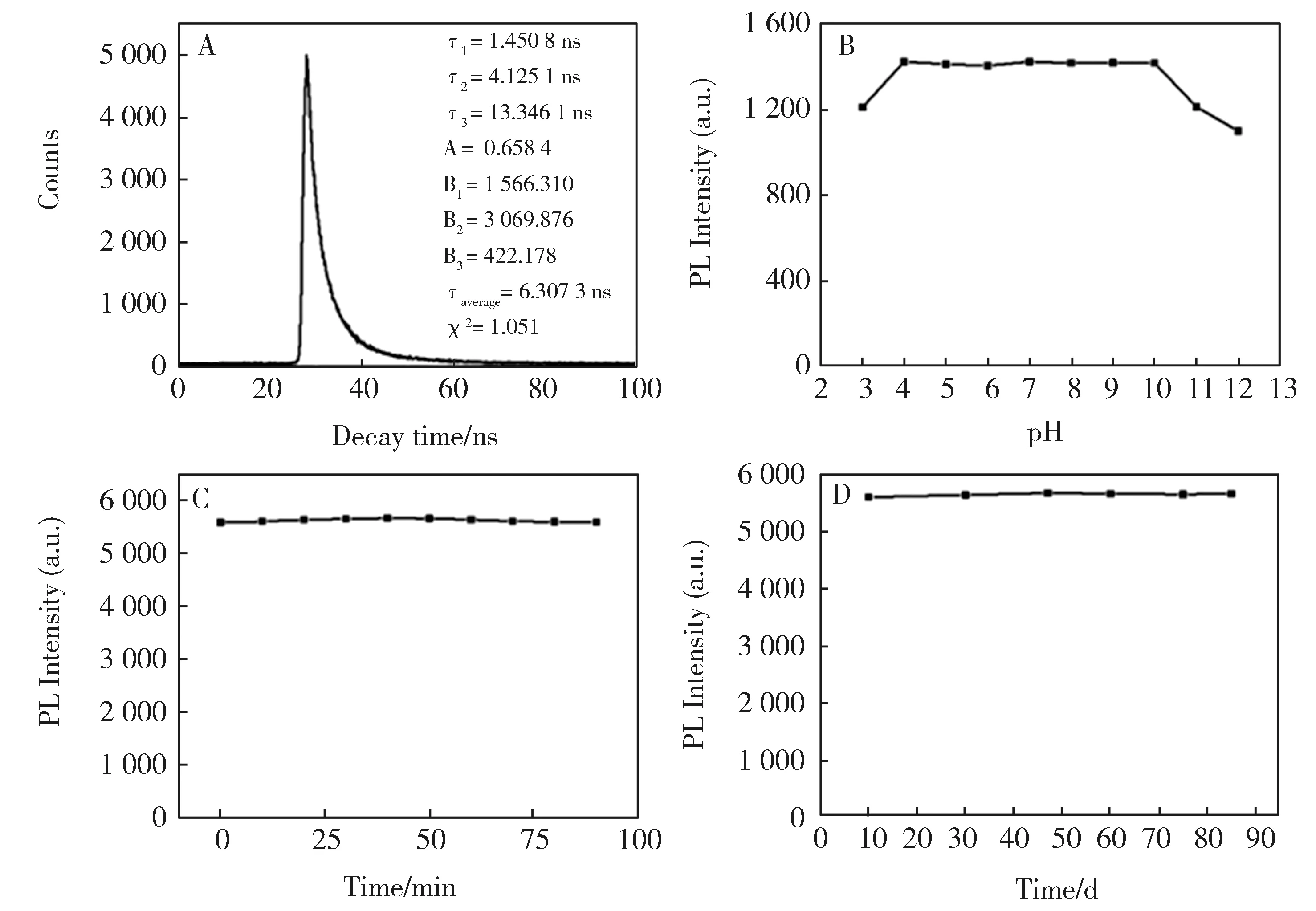
图6 (A)N,P-CDs的荧光衰减曲线,(B)pH对N,P-CDs荧光强度的影响,(C)紫外辐射时间和(D)贮存时间对N,P-CDs 荧光强度的影响。Fig.6 (A) Fluorescence decay of N,P-CDs (excitation at 340 nm, emission at 438 nm).Influence of pH (B),excitation time (C) and storage time (D) on the PL intensity of N,P-CDs
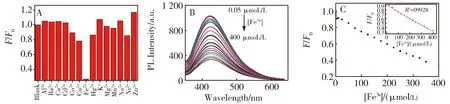
图7 (A)金属离子对N,P-CDs在438 nm处的荧光强度比值F/F的影响,(B)N,P-CDs在不同浓度Fe3+ (0.05~400 μmol/L)存在下的荧光光谱图。(C)N,P-CDs荧光强度比值F/F与Fe3+浓度的线性关系图(插图:10~400 μmol/L的线性图)。Fig.7 (A) Effect of different metal ions on F/F0 of N,P-CDs solution at 438 nm.(B) Fluorescence emission spectra of N,P-CDs with different concentrations of Fe3+ (0.05~400 μmol/L);(C) The relationship between F/F0 and Fe3+(0.05~400 μmol/L).Inset: the good linearity in the range of 10~400 μmol/L
我们还考察了不同浓度的Fe3+对N,P-CDs荧光强度的影响。图7B是荧光滴定曲线,图7C是相对荧光强度(F/F)和Fe3+浓度之间的关系。结果表明:随着Fe3+浓度的增加,N,P-CDs的荧光强度逐渐降低,在10~400 μmol/L范围内,N,P-CDs的荧光强度与Fe3+浓度呈现很好的线性关系,线性范围较文献中的更宽(表1)。并且在信噪比为 3的情况下,计算可得检出限为3.3 μmol/L。
2.3.2 活细胞中N,P-CDs的Fe3+传感
我们通过激光共聚焦来研究HepG2细胞内Fe3+的荧光成像。用N,P-CDs孵育的细胞呈现明亮的蓝色荧光,当加入Fe3+之后,细胞的荧光强度降低。由此表明,我们可以将该N,P-CDs应用于细胞内的Fe3+的监测(图8)。
2.3.3 细胞多色成像
图9为HepG2细胞的共聚焦荧光显微图像。图9A、9B和9C分别为HepG2细胞在405、488和514 nm激发下的荧光场照片,收集的荧光发射区域分别为 425~475 nm、500~540 nm和620~700 nm;图9D为图9A和图9B的叠加;图9E为图9B和图9C的叠加;图9F为图9A和图9C的叠加。从图中可看出:N,P-CDs可以很好地标记HepG2细胞。分别用405 nm、488 nm和514 nm激光激发,细胞分别呈现明亮的蓝色、绿色和红色荧光,实现了细胞的多色成像。因此,这种荧光碳点可作为优良的荧光探针应用于生物成像。
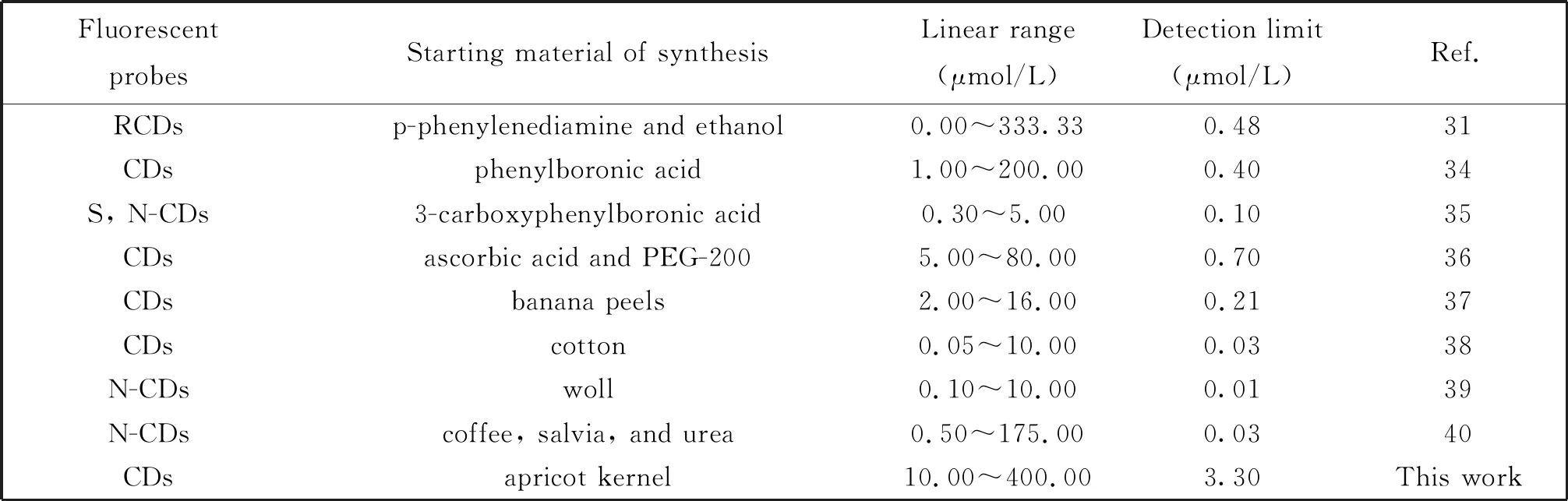
表1 基于不同荧光CDS的Fe3+检测的比较
3 结论
本文使用杏仁为原料通过热解-水热法合成了N,P-CDs。制得的N,P-CDs具有水溶性高、光稳定性好、抗酸碱的性质。在水溶液中,N,P-CDs对Fe3+有很高的选择性和灵敏度。基于N,P-CDs细胞毒性低和生物相容性好的优点,成功将其应用于细胞中Fe3+传感和细胞多色成像。因此,我们提供了一种用广泛易得的绿色碳源用来制备氮、磷共掺杂荧光碳点的方法,并将所制得碳点应用于生物领域。

图8 HepG2细胞的共聚焦荧光成像(A)无Fe3+,(B)有Fe3+ (400 μmol/L)Fig.8 Laser scanning confocal microscopyimages of HepG2 cells in the absence (A)and presence (B) of Fe3+ (400 μmol/L)

图9 (A)405 nm激发,(B)488 nm激发和(C)514 nm激发下标记有N,P-CDs的HepG2细胞的激光扫描共聚焦显微镜图像;(D)A和B的合并图像;(E)B和C的合并图像;(F)A和C的合并图像Fig.9 Laser scanning confocal microscopy image of HepG2 cells labelledwith the N,P-CDs under (A) 405 nm, (B) 488 nm, and (C) 514 nm excitation.(D) The merged image of A and B. (E) The merged image of B and C. (F) The merged image of A and C
