间充质干细胞培养物对巨噬样细胞分化和极化的影响
2020-09-14王国霖王丽清李洁王谢东叶进培吴长新
王国霖,王丽清,李洁,王谢东,叶进培,吴长新
(山西大学 生物医学研究院,山西 太原030006)
0 引言
人脐血间充质干细胞存在于人脐带血中,具有旺盛自我更新能力以及向多胚层分化的潜能,参与组织修复,包括修复心肌、胰、肾、肝、肺、支气管、血管、皮肤、骨等组织或器官的损伤[1-2]。在炎性病症的研究中,间充质细胞(mesenchymal stem cells, MSCs)调节巨噬细胞(macrophage,MΦ) 功能已有研究。通过与MSCs的共培养,MΦ的白细胞介素-10(IL-10),IL-4的表达增加且减少了促炎细胞因子,如肿瘤坏死因子-α (TNF-α),IL-6,IL-12,IL-1β的产生[3];MSCs条件培养基还对内皮细胞炎性损伤具有保护作用[4]。MSC产生的效应分子驱动抗炎功能,并且MSCs可以减弱炎症,在减轻促炎网络和放大抗炎信号中的核心作用[5]。这表明MSCs对机体内巨噬细胞调节朝向抑炎表型。
MΦ是一群异质性免疫细胞,在机体进行非特异性吞噬杀伤多种病原微生物,是机体中重要的非特异性免疫防御保障之一,是可塑程度较高的细胞,容易从一种功能表型转换为另一种功能表型以响应新的微环境信号[6-7]。为了研究体外巨噬细胞活化,使用各种刺激来诱导特定的巨噬细胞活化表型。通常,MΦ可以通过γ-干扰素(IFN-γ)和脂多糖(LPS)“经典地”激活导致促炎(classically activated ma-crophage, M1)表型和白细胞介素(IL-4/IL-13),免疫复合物或糖皮质激素,以诱导“替代”活化(alternatively activated macrophage,M2)表型[8-10]。M1和M2间功能分化轴的平衡表明机体促炎和抑炎两种免疫功能的相对形式变化。巨噬细胞集落刺激因子(Macrophage colony stimulating factor, M-CSF)诱导的单核细胞所形成的M2表型,不仅增加CD163水平,也通过IL-10或IL-4的额外极化进一步调节[8]。粒细胞巨噬细胞集落刺激因子(GM-CSF)诱导分化的巨噬细胞表达上调CD68、CD80、CD86以及MHCⅡ;IL-6、IL-8、IL-12、IL-23等是促炎性的细胞因子,它们在M1中表达较高[8,11]。
THP-1 (Human acute monocytic leukemia cell line),常用作体外MΦ的生物学特性和免疫功能研究,这归功于它的永生增殖特性。因为原代单核细胞或单核细胞衍生的巨噬细胞没有良好增殖和寿命短的特性,因此它们用于体外MΦ模型和功能研究的用途受到限制。另外,THP-1可在PMA或VD3刺激下诱导成巨噬细胞样细胞(MΦ-like)[12-13]。
在体内MSCs及其效应因子对MΦ免疫调节均倾向于炎症的抑制,那么在体外由THP-1分化的MΦ模型中MSCs培养物中的效应因子是否也会使其朝抑炎表型方向发展?我们的研究通过将THP-1分化成的MΦ直接暴露于MSCs条件培养基中,经FACS以及qRT-PCR分析,以明确MSCs条件培养基中的效应物对体内外MΦ免疫分化模型上的一致性。
1 材料与方法
1.1 细胞培养
THP-1(人急性白血病单核细胞)购自国家实验细胞资源共享服务平台,由中国医学科学院基础医学研究所细胞资源中心提供复苏。细胞均在加湿的37℃含体积分数5% CO2培养箱中培养,并在补充有体积分数10% FBS和质量分数1%青霉素-链霉素双抗的RPMI+谷氨酰胺中悬浮生长。按Beeravolu等方法从脐带与胎盘连接处分离获得和培养MSCs[14]。第5代原代MSCs在补充有体积分数20% FBS和质量分数1%青霉素-链霉素双抗的DMEM:F12中贴壁生长并每2 d收集一次MSCs培养基上清,用作THP-1培养或分化的补充材料。MSCs培养图片通过Zeiss荧光显微镜(型号: Axiocam 506 color)观察(图1)。

图1 脐带与胎盘MSCs分离后培养与鉴定。a.MSCs体外成软骨、成骨和成脂定向分化染色。茜素红染色为橙红色即为成骨细胞,阿尔辛蓝染色为蓝绿色即为软骨细胞,油红O染色为红色或粉红色即为脂肪粒。b.MSCs的表面标记分子表达情况。PE表示MSCs不表达的表面标记,包括:CD34、CD11b、CD19、CD45和HLA-DR。FITC表示CD90,PerCP-Cy5表示CD105,APC表示CD73Fig.1 Culture and identification of CPJ(cord-placenta junction)-MSCs after isolationa. MSCs were induced to differentiate into cartilage,osteogenesis and adipogenic differentiations in vitro.Alizarin red staining is orange red, which is osteoblast,Alcian blue staining is blue-green,which is chondrocyte,and oil red O is red or pink, which is fat.b. Expression of surface marker molecules of MSCs.PE indicates surface markers not expressed by MSCs,including: CD34, CD11b, CD19, CD45, and HLA-DR.FITC stands for CD90, PerCP-Cy5 stands for CD105, and APC stands for CD73
将THP-1按2×105个细胞数/孔在24孔细胞培养板培养,以RPMI-1640 培养基和DMEM:F12培养基半数混合培养作为对照,以RPMI-1640 培养基和MSCs培养物半数混合培养液, 含10 ng·mL-1的RPMI-1640培养基和MSCs培养物半数混合培养液, 以及含10 ng·mL-1的RPMI-1640 培养基和MSCs培养上清半数混合培养液(10 ng·mL-1PMA首先刺激THP-1 24 h,之后换掉含PMA的培养基,在各个实验组中加入含有经半数稀释的MSCs培养物培养基,简称pMSC)。每两天补充培养基1次。待培养至96 h,加入1 μg·mL-1的LPS 极化细胞至120 h,收集细胞做FACS分析。测定细胞因子表达:以相同的方式对细胞进行培养,但在细胞培养114 h时,各个实验组中加入1 μg·mL-1LPS,LPS刺激6 h后开始收集细胞提取RNA以进行细胞因子实时定量反转录聚合酶链式反应(qRT-PCR)分析。
1.2 相关试剂

1.3 细胞总RNA提取及反转录
细胞总RNA 使用经典Trizol提取法得到RNA后,再用反转录试剂将mRNA反转录为 cDNA,并稀释5倍。利用qRT-PCR检测IL-6、IL-8、IL-10、IL-12、IL-23的mRNA相对表达。引物序列见表1。
1.4 MSCs染色
按Fernandes的方法通过细胞染色观察对MSCs进行分化鉴定[15]。成骨分化通过碱性磷酸酶染液分析;成软骨分化通过阿尔辛蓝染色分析;成脂分化通过碱性磷酸酶染液分析油红O染色分析(如表2)。

表1 相关细胞因子的引物

表2 MSCs分化检测试剂
1.5 流式分析
MSCs鉴定:按照Fernandes等[15]的方法通过FACS分析对MSCs进行鉴定。使用以下标记对细胞进行染色:PE-CD34、CD11b、CD19、CD45和HLA-DR、 FITC-CD90、PerCP-Cy5-CD105、APC-CD73。通过FACS Canto(BD Biosciences)和FlowJo软件(Tree Star,Ashland,OR,USA)分析。
MSCs诱导分化:按照Marc Daigneault等方法通过FACS分析对细胞进行表型分型[13]。使用PE-Cy7-Hu CD80,PE-Hu CD86,FITC-Hu MHCII和APC-Hu CD163标记对细胞进行染色,与相应的同种型对照。用FACS Canto和FlowJo软件分析表型。通过在正向和侧向散射上设置门,显示活细胞的光散射特性的细胞,从分析中排除细胞碎片。对每个样品分析最少1×104个细胞。
1.6 统计
OriginPro 8.5软件作图和SPSS数据统计分析,不同组数据间进行ANOVA方差分析,以P<0.05为差异有显著性。
2 结果
2.1 脐带与胎盘MSCs分离后培养与鉴定
MSCs的增殖速度较快,培养后均呈现典型成纤维样、纺锤形。从图1a可以看到MSCs分化成软骨、成骨和成脂。经检测MSCs细胞表面阴性标志物(0.2%)和3个阳性标志物(CD73 99.3%/CD90 95.8%/CD105 98%),且细胞表面阳性标记物表达不低于95%,阴性标记物表达不高于2%(图1b)。结果显示,从脐带与胎盘连接处的细胞被分离培养后具有较好的分化能力,可以判定是MSCs。
2.2 MSCs培养分泌物诱导巨噬样细胞向M2进一步分化
采取CD80/MHCⅡ/CD86 MFI值与CD163 MFI值的大小比较鉴定MΦ分化趋势(巨噬细胞Ⅰ型, M1和巨噬细胞Ⅱ型,M2)。通过流式细胞仪分析了MΦ-like在MSCs培养物诱导细胞表面标志CD80、CD86、MHCⅡ和CD163的表达情况。
如图2a-2d所示,THP-1直接经LPS作用24 h后,其CD80和CD163表达均没有显著变化,CD86和MHCⅡ的表达则轻微升高。而MSC预处理THP-1 96 h后,其CD80、CD86、MHCⅡ和CD163表达均未明显改变,表明MSCs培养物短时间内未能对THP-1分化有明显影响。
THP-1在PMA诱导形成MΦ-like后,PMA处理的THP-1的 CD86 MFI为3 993,稍微大于其CD163(3 336), 表明10 ng·mL-1PMA刺激使MΦ-like表现出较轻的M1偏移。MΦ-like被MSCs诱导(pMSC)的细胞,MSCs培养物极显著提高CD163的表达,其MFI值13 668, 但其他MΦ表面标志表达较低,其MFI分别是 CD80(-1 870)、CD86(2 698)、MHCⅡ(208),显示在MSC效应分子的作用下,pMSC处理组的细胞分化趋于M2表型(图2a, 2b, 2c, 2d)。PMA单独处理THP-1后CD86、MHCⅡ和CD163的表达程度都较高,显示PMA的刺激作用使人源单核细胞系THP-1很好地分化为MΦ-like。
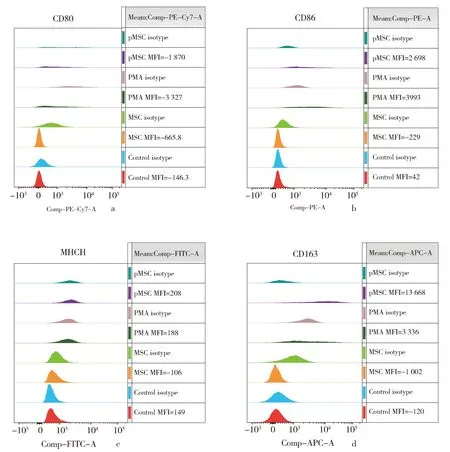
a,b,c,d分别显示的是对照/MSC/PMA/pMSC处理细胞的CD80、CD86、MHCⅡ、CD163的MFI(Mean fluorescence intensity,平均荧光强度)值。对照是DMEM:F12与PRIM-1640半数混合培养基培养的THP-1细胞;“isotype”均为对应实验组同型抗体对照;MSC处理组表示MSCs细胞培养物(培养基上清)与PRIM-1640半数混合培养的THP-1细胞;PMA表示在PMA (10 ng·mL-1)存在下DMEM:F12与PRIM-1640半数混合培养基培养的THP-1细胞;pMSC表示在PMA (10 ng·mL-1)处理24 h后更换MSC细胞培养物(培养基上清)与PRIM-1640半数混合培养液。MFI(Mean Fluorescence Intensity)=实验组平均值-同型组平均值。图2结果是3次独立实验的1次实验结果图2 MSCs培养物诱导THP-1及巨噬样细胞表面标志CD80、CD86、MHCⅡ、CD163表达的FACs分析。a, b, c, and d show the MFI (mean fluorescence intensity) values of CD80, CD86, MHCII, and CD163 in the Control/MSC/PMA/pMSC treated THP-1, respectively. Control is THP-1 cells cultured in DMEM: F12 and PRIM-1640 half mixed medium; "isotype" is the antibody isotype; pMSC represents MΦ-like cells cultured in mix medium of 50% MSCs culture supernatant and 50% PRIM-1640 for 96 h after PMA treatment for 24 h (pMSC).PMA represents THP-1 cells cultured in 50% DMEM:50% F12 and PRIM-1640 mixture medium with 10 ng·mL-1 PMA for 24 h, and then cultured without PMA for 96 h. MFI=experimental group mean value-homotype group mean value. Results in the figures above represent one of three independent experimentsFig.2 FACs analysis of the expression of cellular surface markersof CD80,CD86,MHCⅡ,CD163 on THP-1 and MΦ-like.
2.3 LPS的极化对MSCs培养基上清诱导的MΦ-like表面标志物CD80、CD86、MHCⅡ和CD163的影响
为了研究LPS在MSCs条件培养基诱导MΦ分化后对其极化的影响,在96 h加入LPS。在第120 h FACS分析CD80、CD86、MHCⅡ和CD163极化后的变化(图3)。
与对照组(Control组)相较,极化后(Control+LPS)MHCⅡ的平均值表达上调,CD80、CD86、CD163表达无变化(图3a)。在添加LPS的MSCs培养基培养THP-1(MSC+LPS),与未极化(MSC组)相较,CD86、MHCⅡ表达上调,CD80、CD163表达无变化(图3b)。结果表明,在无PMA刺激,LPS的加入只上调表达了M1细胞表面标志物MHCⅡ和CD86,而M2细胞表面标志物CD163却始终没有或极弱表达。另外, 添加LPS的MSCs培养基上清诱导THP-1(MSC+LPS)和LPS极化的对照组(Control+LPS)两者间CD80、CD86、MHCⅡ和CD163的表达差异较小(图3a和3b),这表明无PMA刺激时,LPS的极化作用对单核细胞的分化在细胞标志物表达上无影响或极弱影响。 PMA分化THP-1获得的MΦ-like经LPS极化(PMA组)表达CD80(MFI=17 798),同时CD86(MFI=5 885)、MHCⅡ(MFI=1 235)的MFI值均高于CD163(MFI=747),指示MΦ-like朝M1分化。LPS下调CD163表达使原本在未极化前向M1分化的MΦ更加趋于成熟(图3c)。MΦ-like被MSCs诱导且于LPS的极化下(pMSC+LPS),CD80(MFI=9 272)和CD86(MFI=3 149)的MFI值上要高于CD163(MFI=2805)(图3d),这表明MΦ-like经MSCs培养物的诱导和LPS的极化使MΦ-like由M2样向M1型极化方向偏移。CD163在pMSC处理组有明显的峰图位移,而LPS的加入抑制了CD163表达(图3d)。在LPS极化作用影响下,MSCs培养物诱导MΦ-like具有明显M1特征(图3d)。

a. Control和Control+LPS (Control+L)及其各自同型组;b. MSC和MSC+LPS (MSC+L)及其各自同型组;c. PMA和PMA+LPS (PMA+L)及其各自同型组;d. pMSC和pMSC+LPS (pMSC+L)及其各自同型组。图中值均为MFI值。进行三次独立实验图3 MSCs分泌物影响LPS对MΦ的极化a. Control and Control+LPS (Control+L) and their respective isotypes; b. MSC and MSC+LPS (MSC+L) and their respective isotypes; c. PMA and PMA+LPS (PMA+L) and individual isotypes;d. pMSC and pMSC+LPS (pMSC+L) and their respective isotypes.The values in the figure are all mean values.Results in the figures above represent one of three independent experimentsFig.3 Effect of supernatant of MSCs culture on the polarization of MΦ by LPS
2.4 MSCs培养物对巨噬样细胞表达的细胞因子的影响
MSCs分泌可以使MΦ IL-10的表达水平提高。pMSC组与PMA分化获得MΦ-like和未分化THP-1比较,MSCs培养物不仅显著提升IL-10的mRNA表达水平,且mRNA表达量相较对照组高出93.6倍。MSCs培养物同样显著上调IL-8的mRNA的表达(图4a)。LPS极化后,IL-8表达都较高。pMSC组中,IL-6表达仅次于IL-8(图4b)。有趣的是,IL-12则在细胞中的表达在LPS极化下提升较小(图4b)。pMSC组的免疫应答反应中,炎性细胞因子(IL-6、IL-8)mRNA表达上调。

a. MSCs效应物对巨噬样细胞产生IL-10和IL-8的变化;b. MSCs培养物诱导MΦ-like分化响应与LPS极化后的免疫应答;通过计算2(无LPS处理-LPS处理) 得到数据。每个条形代表一式三份样品的平均值±SD。NS (No significant difference)表示无显著差异,P<0.05显著性差异图4 MSCs效应物在LPS极化作用下的免疫应答a. qRT-PCR analysis of the effect of MSCs supernantant on the expression of IL-10 andIL-8 in macrophage-like cells; b. qRT-PCR analysis of effect of MSCs supernantant on the expression of IL-10 and IL-8 in macrophage-like cells after LPS polarization.Relative expression is obtained by calculation using 2Δno LPS treat-ΔLPS treat. Each bar representsthe mean ± SD of triplicate samples.NS means no significant difference, P<0.05 denotes significantly differentFig.4 Effect of MSCs supernatant on the polarization of MΦ-like by LPS
3 讨论
许多研究表明MSCs被作为许多疾病,特别是慢性疾病治疗手段,并具有较高的安全性和有效性,主要是因为MSCs具有显著免疫调节特性,及其良好的造血支持作用[16]。尽管骨髓是获得MSCs的最常见来源,但脐带血代表了另一种来源,可以方便地收集,而且没有重大的伦理问题[17]。MSCs驻留在组织中旁分泌效应因子可以局部浸润MΦ以适应更多的调节特性[18]。MSCs从脐带与胎盘连接处获得,经过其分化能力、特染色测定以及表面标志物分析,证实获得了状态较好并具有典型表型MSCs。
MSCs所分泌的细胞因子较为丰富,在我们之前的粒细胞巨噬细胞集落刺激因子(GM-CSF)诱导单核细胞及MΦ分化的研究中,GM-CSF可以诱导单核细胞以及体外的巨噬样细胞朝M1方向分化,而MSCs分泌的GM-CSF含量很高(ELISA测定稀释1 000倍后OD值仍超出检测范围),故我们直接将MSCs培养基进行半数稀释去诱导单核细胞及巨噬样细胞的分化,但结果显示经过诱导后没有得到GM-CSF预期诱导的M1 巨噬细胞,而是向着M2方向发展(图2)。由于MSCs培养物中效应因子繁杂,未知其诱导THP-1细胞用量及效力如何,故在实验中将MSCs培养物与THP-1细胞培养基进行半量混加的方式进行培养。
体内MSCs对炎症调节主要表现为抑制。在本研究中,MSCs培养物可诱导MΦ-like的抗炎表型,同时也增加了IL-10的表达。流式分析发现,LPS对M1的成熟具较强促进作用。MSCs的效应物诱导MΦ-like的分化作用也会在LPS极化后表现出炎性调节趋势,表明LPS的极化作用要强于MSCs的诱导作用,这暗示了分化环境被病原微生物入侵,MSCs所分泌效应物的抑炎免疫调节可能受到影响,抗炎作用会下调。
据报道,早期THP-1具有不同于单核细胞的基因表达模式,并且当用PMA处理时,在MΦ中诱导的某些基因,例如载脂蛋白-E也在PMA中被诱导,但这是单核衍生的MΦ中相反调节的基因[19]。尽管MΦ-like的某些形态和其他特征与MΦ相似,但从转录组学的角度看,两者并不相同。这可以解释LPS对MSCs培养物诱导的MΦ-like的免疫应答中IL-12低变化现象,但是否MSCs培养物中的某一种效应因子参与并抑制了LPS极化MΦ-like里IL-12 mRNA的表达量?这有待进一步研究。
综上所述,通过体内微环境分化的MΦ与体外构建的MΦ分化模型,尽管二者在转录水平上存在差异,但MSCs培养物可体外调节MΦ免疫功能分化的方向,使MΦ-like分化朝向抑制炎症的M2发展,这与体内的免疫调节研究相符。需要注意的是,在巨噬细胞功能性研究上,要据实验需求慎重选择巨噬细胞模型。
