人工合成抗菌肽生物信息学分析及其抑菌活性研究
2020-09-12练家惠陈向东陈全顺
练家惠,陈向东,汪 辉,陈全顺
中国药科大学生命科学与技术学院微生物学教研室,南京210009
随着抗生素的广泛使用,抗生素滥用现象逐渐增多,耐药菌的种类和数量也越来越多,给临床治疗带来极大的挑战,因此,迫切的需要新型抗菌药物的研发来解决这一难题。抗菌肽(AMPs)是机体(动物、植物或微生物)在外界刺激诱导下,由特定基因编码、合成的一类具有广谱抗菌活性的阳离子多肽,是机体非特异性宿主防御系统的重要组成部分[1]。通过对AMPs 构效关系和作用机理的深入研究,结合生物信息学对天然抗菌肽进行定向优化或者从头设计,有望设计出抗菌活性强、溶血性低、更优药代动力学的AMPs。
Temporin-1Dra(HFLGTLVNLAKKIL-NH2)是一种从美国加利福尼亚红腿蛙Rana draytonii 皮肤分泌物中提取分离出来的抗菌肽,对大肠杆菌、金黄色葡萄球菌、白色念珠菌具有较好的抑菌作用,但其较强的溶血性限制了临床使用[2]。
本文主要对Temporin-1Dra 进行氨基酸替换,对改造之后的多肽序列进行生物信息学分析,以期获得低毒性、对白色念珠耐药菌株具有抑菌活性的AMPs,为解决临床抗生素耐药的新型抗菌药物研发提供理论依据。
1 材 料
1.1 受试菌株
标准菌株:白色念珠菌(Canidia albicans ATCC 98001)、耐氟康唑(FLC)白色念珠菌均由中国药科大学微生物学教研室提供。10 株Canidia albicans耐药菌株,来自南方医院临床检验室所分离。
1.2 药品和试剂
多肽[G4、T5、N8K]Temporin-1Dra 委托常州康龙生物科技有限公司采用化学固相合成法而得,纯度(HPLC)>95%;氟康唑(FLC,南京森贝伽生物科技有限公司);Mueller-Hinton 琼脂、肉汤培养基、Sabouraud Dextrose 琼脂、肉汤培养基(北京三药科技有限公司)。
1.3 仪器设备
KD20001A 电子天平(南京凯德计量仪表有限公司);GHX-9080B 恒温培养箱(上海福玛实验设备有限公司);96 孔板 (Thermo Fisher Scientific 公司);高压灭菌锅(日本Hirayama 公司);洁净工作台(吴江市净化设备总厂);数显恒温水浴锅(国华电器有限公司)。
2 方 法
2.1 多肽的生物信息学分析
抗菌肽的抑菌活性受其所带电荷数的影响,有文献报道,抗菌肽magainin 2 的电荷数从+3 增加到+5 时,对革兰阴性菌和革兰阳性菌的抑菌活性有所提高,若继续增加正电荷数则会使其溶血性增加而抑菌活性却没有提高[3]。氨基酸的螺旋程度影响着抗菌肽的体内稳定性,人体可识别并且降解天然的L 型氨基酸,用D 型氨基酸对L 型氨基酸进行替换可以保护抗菌肽免受体内蛋白酶的识别和降解。研究表明,将天然抗菌肽 Temporin -1Dra(HFLGTLVNLAKKIL-NH2)第4、5、8 位的氨基酸分别用D 型K(赖氨酸)替换,改造之后的三条多肽序列均显示出对白色念珠菌标准菌株有明显抑菌活性,且溶血性有所降低[2],但对耐药菌株无作用。加之抗菌肽对细菌和真菌的抑菌机制大致相同,均可通过与带负电荷的细胞膜相互作用发挥抑菌作用,因此对天然抗菌肽Temporin-1Dra(HFLGTLVNLAKKIL-NH2)进行了如下改造:将其4、5、8 位的氨基酸同时用D-赖氨酸进行替换,得到含有5 个正电荷的多肽序列:[G4、T5、N8K]Temporin-1Dra(HFLKKLVKLAKKIL-NH2)。
运用生物信息学分析软件CAMPR3、Prot-Param、SOPMA 分别对多肽序列[G4、T5、N8K]Temporin-1Dra 的抗菌肽形成概率预测,理化性质、二级结构进行预测[4,5]。
2.2 合成多肽溶血性测定
将无菌脱纤维羊血1000 g 离心5 min,取沉淀以pH 7.4 的磷酸缓冲液(PBS)洗涤3 次,再用PBS将其红细胞浓度调整为1%;用生理盐水将合成多肽浓度调整为512、256、128、64、32、16、8、4 μg·mL-1,加入等体积的红细胞悬液,以PBS 为阴性对照组,以1% TritonX-100 为阳性对照。37 ℃作用1 h,1000 g 离心5 min,将上清液依次加入96 孔板,酶标仪测定吸光度A540nm值。每个浓度设置3 个平行。
溶血率 (%)=(A540nm样品-A540nm阴性)/(A540nm阳性-A540nm阴性)×100%。当溶血率>5%,认为有细胞毒性。
2.3 药敏实验
采用CLSI 规定的微量肉汤稀释法体外测定多肽[G4、T5、N8K]Temporin-1Dra 对Canidia albicans标准菌株、耐氟康唑白色念珠菌以及临床分离Canidia albicans 耐药菌株的MIC 值。
肉汤微量稀释法对合成多肽和菌悬液进行稀释,在96 孔板内合成多肽,最终浓度为256、128、64、32、16、8、4、2、1、0.5 μg·mL-1,无菌SD 肉汤培养基作为阴性对照,菌悬液作为阳性对照。于96 孔板37 ℃恒温培养18 h,肉眼未见浑浊,孔中所对应的药物最低浓度即为最小抑菌浓度(MIC)值。从未变混浊的孔中吸取培养物100 μL,均匀涂布到SD 琼脂平板上,37 ℃恒温培养24 h,平板计数,按照最低杀菌浓度(MBC)规定:当平板中菌落数≤5 时,药物浓度最低的即为MBC 值。
2.4 时间-杀菌曲线测定
采用菌落计数法测定合成多肽对耐FLC 白色念珠菌在0、0.5、1、1.5、2、2.5、3、4、6、8、10、24 h 的时间-杀菌曲线,多肽的浓度分别为2MIC、MIC、1/2MIC,同时设置FLC 对照组(浓度为MIC),空白生长对照组。
2.5 合成多肽与FLC 的联合药敏试验
采用肉汤微量稀释法进行合成多肽和FLC 对耐FLC 白色念珠菌的联合药敏实验。选取7×7 棋盘,合成多肽和FLC 药液浓度梯度制备和菌悬液制备,且药液浓度的最高浓度设定为各自最小抑菌值的两倍(2MIC),然后倍比稀释至适当的浓度。96 孔板1-7依次为终浓度是32、16、8、4、2、1 μg·mL-1的FLC,AG 依次为终浓度是256、128、64、32、16、8、4 μg·mL-1的Linear-KL,每孔Linear-KL 和FLC 共计100 μL,然后加入100 μL 的菌悬液,同时设置含有200 μL 菌悬液的阳性对照组及含有200 μL SD 肉汤培养基的阴性对照组。然后用手轻敲96 孔板,使之混合均匀,放入37 ℃恒温培养箱静置培养18~24 h。
部分抑菌浓度指数 (fractional inhibitory concentration index,FIC index)是抗菌药药效学参数之一,FIC index=MIC(A)/MICA+MIC(B)/MICB,其中MIC(A)和MIC(B)分别代表A 药和B 药联合用药时各自的MIC 值,MICA 和MICB 分别代表A 药和B 药单独用药时的MIC 值。当FIC index≤0.5 时,药物A 和B 之间有协同抗菌作用;当0.5<FIC index≤1.0 时,药物A 和B 联合用药的抑菌效果为相加作用;当1.0<FIC index≤2.0 时,药物A 和B 联合用药的抑菌效果为无关作用;当FIC index>2.0 时,药物A 和B 之间有拮抗作用,且2 种药物联合使用的效果显著低于其中一种药物单独使用的效果。
3 结果
3.1 多肽生物信息学分析结果
氨基酸替换后的多肽序列:[G4、T5、N8K]Temporin-1Dra(HFLKKLVKLAKKIL-NH2)。
多肽[G4、T5、N8K]Temporin-1Dra 的抗菌肽形成概率预测、理化性质分析、二级结构分析,结果分别如表1、表2、图1 所示。
由表1 可知,多肽[G4、T5、N8K]Temporin-1Dra的抗菌肽形成概率相对较高,理论证明其具有抗菌活性的可能性很大;由表2 可知,该条多肽为含有14个氨基酸、5 个正电荷的阳离子短肽,除此之外不稳定系数为-10.68,表明此多肽为稳定蛋白。由图1 可知,其二级结构包括α-螺旋(6 个氨基酸残基参与),占42.86%;延伸链(2 个氨基酸残基参与),占14.29%;无规则卷曲(6 个氨基酸残基参与),占42.86%。
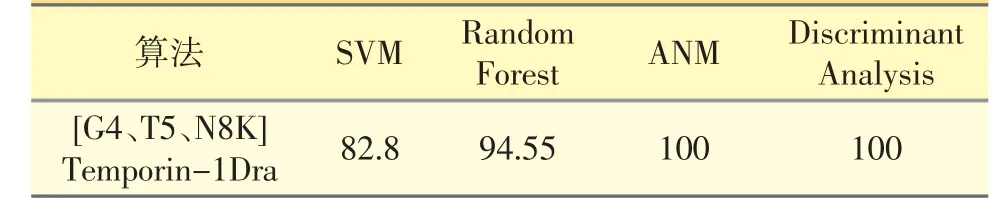
表1 合成多肽的抗菌肽形成概率

表2 合成多肽的理化性质分析结果

图1 合成多肽的二级结构预测
3.2 合成多肽溶血性测定
合成多肽溶血性测定结果如表3 所示。从表3中可以看出,溶血率随着浓度的升高逐渐升高,多肽在128 μg·mL-1(MIC)范围内溶血率<5%,即使在高于MIC 值2~4 倍时,溶血率仍然低于10%,有轻微的溶血现象。

表3 合成多肽的溶血性测定
3.3 药敏实验
多肽[G4、T5、N8K]Temporin-1Dra 的体外药敏实验结果如表4 所示。

表4 合成多肽的抑菌活性测定(MIC,μg·mL-1)
由表4 可知,合成多肽对Canidia albicans ATCC 98001 的MIC 值为64 μg·mL-1,对Canidia albicans耐药菌株的MIC 值在64~128 μg·mL-1;对耐FLC 白色念珠菌的MIC 值和MBC 值均为128μg·mL-1。
3.4 时间-杀菌曲线绘制
多肽[G4、T5、N8K]Temporin-1Dra 对耐氟康唑白色念珠菌的时间-杀菌曲线如图2 所示。
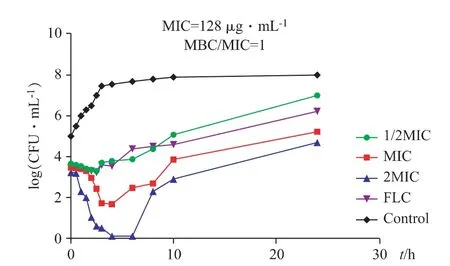
图2 [G4、T5、N8K]Temporin-1Dra 时间-杀菌曲线
由图2 可知,在0~3 h 内,在2MIC、MIC、1/2MIC 浓度下多肽对耐药菌株具有明显的抑制作用,且随浓度的增加杀菌效率逐渐增强。在MIC 浓度下,[G4、T5、N8K]Temporin-1Dra 的杀菌速率强于氟康唑对照组。
3.5 多肽[G4、T5、N8K]Temporin-1Dra 与FLC 的联合药敏试验
多肽[G4、T5、N8K]Temporin-1Dra 和耐FLC 白色念珠菌的联合抑菌结果如表5 所示。
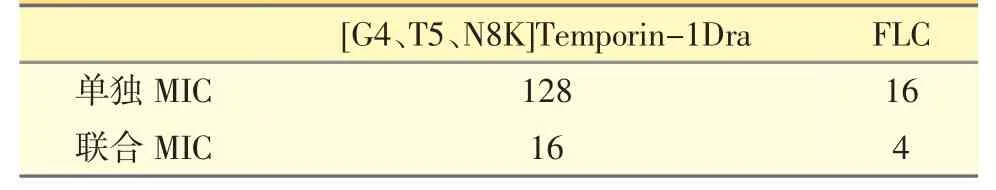
表5 合成多肽和FLC 的联合抑菌结果(MIC,μg·mL-1)
由表5 可知,联合用药时合成多肽和FLC 的MIC 分别为16 μg·mL-1、4 μg·mL-1,根据公式:FIC index=MIC(A)/MICA+MIC(B)/MICB。
部分抑菌浓度指数 (FIC index)=0.375,FIC 指数≤0.5,即多肽[G4、T5、N8K]Temporin-1Dra 和FLC之间有协同抗菌作用。
4 讨论
以天然抗菌肽Temporin-1Dra 为模板,将其第4、5、8 位的氨基酸同时用D 型氨基酸进行替换,得到含有5 个正电荷的阳离子多肽序列:[G4、T5、N8K]Temporin-1Dra ((HFLKKLVKLAKKIL-NH2)。对改造之后的天然抗菌肽进行生物信息学分析,发现其抗菌肽形成概率相对较高;溶血性测定表明,其在128 μg·mL-1(MIC)范围内溶血率<5%,无细胞毒性;体外抑菌活性检测结果表明,对白色念珠菌耐药菌株的MIC 值在64~128 μg·mL-1,故成功设计出一条溶血性低且对白色念珠菌耐药菌株有抑制作用的抗菌肽。
在全球范围内,念珠菌每年造成4000 万例感染病症,白色念珠菌是其主要的感染病原体,所占念珠菌感染病的50%~70%。白色念珠菌是一种存在于人类皮肤、黏膜以及肠道中的条件致病真菌,可导致机体浅表和深部的白色念珠菌病乃至菌血症[6]。唑类药物氟康唑(FLC)可通过口服或静脉给药,用来治疗口腔、皮肤、阴道等浅表皮肤念珠菌感染,但随其广泛使用,FLC 耐药菌株不断增加[7]。从[G4、T5、N8K]Temporin-1Dra 对耐FLC 白色念珠菌的杀菌曲线可以看出,多肽在3 h 内、MIC 浓度下具有显著的杀菌效率,且效果优于FLC 对照组;与FLC 的联合药敏实验结果表明,两者联合具有协同杀菌作用,可明显降低对耐FLC 白色念珠菌的MIC值。推测抗菌肽可通过静电相互作用与真菌细胞膜相结合,在细胞膜上形成孔洞导致细胞内内容物外漏,接下来可对[G4、T5、N8K]Temporin-1Dra 的抑菌机制进行深入的探究。
抗生素耐药严重威胁着人类的健康,多肽[G4、T5、N8K]Temporin-1Dra 的设计和研究,为开发出针对临床白色念珠菌耐药菌株的新型抗菌药物提供了又一参考。
