芝麻肌醇半乳糖苷合成酶基因SiGolS6的克隆及功能分析
2020-09-12刘爱丽魏梦园黎冬华周瑢张秀荣游均
刘爱丽,魏梦园,黎冬华,周瑢,张秀荣,游均
芝麻肌醇半乳糖苷合成酶基因的克隆及功能分析
刘爱丽,魏梦园,黎冬华,周瑢,张秀荣,游均
(中国农业科学院油料作物研究所/农业农村部油料作物生物学与遗传育种重点实验室,武汉 430062)
【】是芝麻肌醇半乳糖苷合成酶家族成员,在植物抗旱过程中可能发挥重要作用。研究在植物干旱胁迫抗性中的功能,以期为芝麻抗旱遗传改良提供理论基础和基因资源。利用反转录PCR(reverse transcription PCR,RT-PCR)方法从芝麻中克隆获得肌醇半乳糖苷合成酶基因。使用InterProScan、ClustalX2和MEGA5.2等生物信息学软件对序列进行分析。通过对转拟南芥材料的表型分析和生理指标测定,研究在植物抗旱性中的功能及作用机理。克隆获得的全长CDS序列为921 bp,编码306个氨基酸,其蛋白质分子量为35.07 kD,等电点为4.75。序列分析显示SiGolS6蛋白含有糖基转移酶保守结构域(IPR002495),属于糖基转移酶超家族。与其他物种GolS蛋白构建的系统进化树中,SiGolS6与马铃薯中的同源基因相似度较高。利用潮霉素筛选和PCR鉴定,获得6个独立的转基因拟南芥株系;qRT-PCR分析筛选出表达量较高的3个转基因株系(OE-2、OE-3和OE-4)用于后续试验分析,检测发现这三个转基因株系的棉子糖含量显著高于野生型植株。干旱胁迫下,转基因株系萎蔫程度较野生型轻,干旱胁迫28 d和复水恢复生长5 d后,转基因株系的鲜重均显著高于野生型,而正常供水条件下无明显差异;干旱胁迫28 d后复水生长5 d,50%的转基因植株基本恢复,而野生型植株存活率不到10%。干旱胁迫21 d,转基因植株的相对电导率,活性氧积累和相对MDA含量均显著低于野生型,而相对SOD、POD活性则显著高于野生型。在拟南芥中超量表达芝麻,能够提高植物在干旱胁迫中的耐受性。
芝麻;肌醇半乳糖苷合成酶;转基因拟南芥;耐旱性;功能分析
0 引言
【研究意义】芝麻(L.)是中国重要的传统油料作物之一,具有颇高的经济效益,在国内外都具有重要地位。干旱是限制各种农作物生产的主要逆境之一[1],近年来,中国芝麻产区干旱发生的范围呈现扩大的趋势,旱害造成芝麻减产20%以上,严重时甚至绝收[2]。因此,加强芝麻抗旱功能基因发掘,明确相关基因的调控机理,对培育抗旱芝麻新品种十分必要。棉子糖系列寡糖(raffinose family oligosaccharides,RFOs)是一种小分子渗透调节物[3],其代谢与植物的生长发育、抗逆反应等关系密切。肌醇半乳糖苷合成酶(galactinol synthase,GolS)是催化RFOs合成的关键酶[3],在植物非生物逆境抗性中发挥重要作用。【前人研究进展】植物在受到干旱、高盐和低温等多种逆境形成的渗透胁迫时,体内会积累渗透调节物使细胞液浓度升高,降低渗透势,使细胞吸水或保水能力得到提高,从而适应不利环境。RFOs就是其中一种小分子渗透调节物,它由一系列α-1,6-半乳糖连接到蔗糖上的6-葡萄糖基组成,主要包括棉子糖、水苏糖和毛蕊花糖[4]。RFOs广泛分布在植物的不同组织部位,在高等植物种子中含量相对较高[5-6]。有研究表明,一些体内不含RFOs或含量极低的植物,受到逆境胁迫后RFOs会迅速积累,植株抗逆性也随之增强[7-8],这一响应逆境的生理现象在番茄[9]、苜蓿[10]、辣椒[11]等植物中均存在。近年来,还发现棉子糖系列寡糖代谢与植物生长发育和种子活力建成关系密切[12]。GolS参与RFOs合成的第一步,该步骤是RFOs家族中各物质合成积累的关键步骤[13],因此,其在植物抗逆应答中的作用重大。大多数GolS基因受多种胁迫诱导表达,据报道,在拟南芥中鉴定了7个GolS基因()[8],其中,和的表达分别受干旱和高盐胁迫诱导,受冷胁迫诱导,说明它们均与抗逆应答相关。研究还发现超表达的拟南芥材料对干旱胁迫的耐受性显著增强[14],有报道还指出能够提高单子叶模式植物二穗短柄草的抗旱性[15]。另外,有研究发现木薯的表达量在干旱胁迫下会迅速上升,在大肠杆菌和拟南芥中过量表达该基因均能提高抗旱能力,说明GolS在植物抗旱调节中起着重要作用[3,16]。将牛耳草肌醇半乳糖苷合成酶基因(在烟草中超表达,也显著提高了转基因植株的抗旱能力[17]。另外,玉米受DREB2A转录因子调控,与超表达均可提高拟南芥抗逆性,并且对植株在正常条件下的生长没有任何负效应[18]。可见GolS在作物抗旱遗传改良中具有广阔的应用前景。前期工作中,在芝麻全基因组范围内鉴定了7个GolS基因(—),表达分析显示,、和受干旱胁迫的强烈诱导[19]。【本研究切入点】虽然GolS基因在植物的干旱抗性中具有重要作用,芝麻的表达也受干旱胁迫诱导,但能否提高植物抗逆性,目前仍鲜见报道。【拟解决的关键问题】本研究从芝麻中分离,并利用农杆菌花序浸染法将其在拟南芥中超量表达,通过鉴定超量表达转拟南芥的抗旱性,分析其在干旱抗性中的功能,以期为芝麻抗旱遗传改良提供理论基础和基因资源。
1 材料与方法
1.1 试验材料
所用芝麻品种为晋芝2号,菌株为大肠杆菌DH5α和农杆菌LBA4404,植物表达载体pCAMBIA1301S是在pCAMBIA1301基础上改建而成[20]。
1.2 基因的克隆及序列分析
使用EASYspin Plus植物RNA提取试剂盒(北京艾德莱生物科技有限公司)提取干旱胁迫处理7 d的初花期抗旱芝麻品种晋芝2号叶片组织总RNA,用HiScipt II One Step RT-PCR Kit反转录试剂盒(南京诺唯赞生物科技有限公司)逆转录合成cDNA。
根据前期对芝麻GolS基因家族的分析[19],通过登录号SIN_1022774在芝麻基因组数据库(http://ocri- genomics.org/Sinbase/index.html)中获得的cDNA序列信息,利用引物GolS6FL-F和GolS6FL-R(表1)进行PCR扩增,分离获得。引物由北京擎科新叶生物技术有限公司合成。
同源基因序列下载自NCBI(http://www. ncbi.nlm.nih.gov/);运用Expy Protparatam(https://web. expasy.org/protparam/)在线预测编码蛋白的理化性质;采用InterProScan(http://www.ebi.ac.uk/ InterProScan/)程序分析保守结构域;用ClustalX2程序对不同植物的GolS序列进行多序列比对;用MEGA5.2程序构建系统进化树[21]。

表1 本研究中所用引物序列
1.3 植物表达载体的构建
用HⅠ和Ⅰ对pCAMBIA1301S表达载体进行双酶切获得线性化载体,将其通过琼脂糖凝胶电泳和琼脂糖凝DNA回收试剂盒(天根生化科技有限公司)纯化后获得高纯度线性化载体。将同样纯化后的片段与线性化pCAMBIA1301S载体通过同源重组的方法进行连接,获得植物表达载体pCAMBIA1301S-。
1.4 转化拟南芥及阳性植株的鉴定
通过冻融法将pCAMBIA1301-植物表达载体转化LBA4404农杆菌感受态,挑取阳性克隆,菌落PCR鉴定后,将其接种到含有利福平(Rif)和卡那霉素(kana)的LB液体培养基上,28℃振荡培养至OD600为0.4—0.6。然后采用花序浸染法浸染拟南芥花序,进行遗传转化[22]。浸染后的植株继续在室温22℃、12 h光照/12 h黑暗的培养间培养至收获种子(T0代)。将T0代种子消毒后播种于含潮霉素(30 mg·L-1)的MS培养基(添加25 mg·L-1头孢霉素抑菌)上筛选,将能正常生长的转基因植株移栽到含泥炭土、蛭石(体积比为1﹕3)的花钵中,同时以野生型拟南芥作为对照,继续生长收种,用于后续PCR试验鉴定筛选[23]。
待上述初步筛选得到的阳性苗长至8片真叶后,用天根生化科技(北京)有限公司的植物DNA提取试剂盒提取叶片基因组DNA,以野生型拟南芥DNA为阴性对照,利用PCR方法鉴定是否获得T1代阳性转基因植株。
将T1代阳性转基因植株单株收获的T1代种子继续进行潮霉素筛选,获得T2代阳性植株,选取上述获得部分阳性株系将其移栽生长,再次提取叶片基因组DNA进行PCR分子鉴定,确定T2代阳性植株。
1.5 实时荧光定量PCR(qPCR)检测
取转基因T2代阳性植株和野生型植株幼嫩叶片,用EASYspin Plus植物RNA提取试剂盒(北京艾德莱生物科技有限公司)提取叶片总RNA,使用微量分光光度计测定RNA浓度和质量,反转录获得cDNA。利用Beacon Designer8.14设计荧光定量PCR引物SiGolS6q-F/R。拟南芥持家基因()作为内参基因,实时荧光定量PCR分析在转基因和野生型植株中的表达水平。实时荧光定量PCR试剂盒ChamQ Universal SYBR qPCR Master Mix购自南京诺唯赞生物科技有限公司,按照试剂盒说明书配置荧光定量PCR反应体系,实时荧光定量PCR分析平台为Roche LightCycler 480,基因特异性引物见表1。采用2-ΔΔCT法分析相对表达水平[24]。
1.6 转基因拟南芥的耐旱性分析
在温室中,将不同株系的转基因拟南芥种子和野生型拟南芥种子直接点播于含3﹕1(v/v)蛭石和营养土的花钵(直径10 cm)中,先用保鲜膜保湿48 h,揭膜后置于室温22℃、12 h光照/12 h黑暗的培养间中继续培养,定期浇水。种子点播7 d后,间苗,每钵留苗3—4棵,再用保鲜膜保湿1 d。
种子点播至土里第14 d,开始干旱处理。干旱处理前给所有植株浇足水,待吸水至饱和后,将放置花钵的大盘子里多余的水全部倒掉,以这一天计为干旱处理第1 d。干旱处理28 d后,复水生长5 d,观察表型并拍照(含复水5 d后表型),并统计2种材料的存活数,计算存活率。选取正常生长、干旱胁迫28 d及复水5 d材料的地上部分,用清水冲洗其表面杂物,吸水纸吸干水分,在天平上称重,测定其鲜重变化情况。随机摘取15片大小相对一致的叶片,混合均匀后分成3份即时称量其鲜重,之后室温放置在滤纸上,每间隔0.5 h称重1次,计算其离体叶片失水率。取正常生长14 d的转基因和野生型植株,检测二者的棉子糖含量。棉子糖含量采用内标法由武汉迈特维尔生物科技有限公司(http://www.metware.cn/)基于Agilent7890B-7000D GC-MS/MS平台检测。取正常供水对照和干旱胁迫21 d后转基因与野生型植株的叶片,检测二者的相对电导率、过氧化物酶(peroxidase,POD)和超氧化物歧化酶(superoxide dismutase,SOD)活性,以及丙二醛(malondialdehyde,MDA)含量变化和O2-产生情况,每个指标每个株系取3—4个重复进行测定。使用浸泡法测定相对电导率[25]。POD、SOD活性测定试剂盒和MDA含量测定试剂盒购自南京建成生物工程研究所,具体试验流程及计算方法参照南京建成(www.njjcbio.com)丙二醛(MDA)测定试剂盒(TBA法)、总超氧化物歧化酶(T-SOD)测试盒(羟胺法)及过氧化物酶(POD)测定试剂盒(测植物)(比色法)说明书完成。
1.7 数据分析
试验数据用Microsoft Excel 2010和 SPSS11.5软件进行整理和统计分析。
2 结果
2.1 SiGolS6序列分析
克隆获得全长CDS,序列长度为921 bp,编码306个氨基酸,蛋白分子量为35.07 kD,等电点为4.75。多序列比对和保守结构域分析发现芝麻SiGolS6与其他植物中的同源基因都含有一个糖基转移酶保守结构域(glycosyl transferase,family 8,IPR002495),属于糖基转移酶超家族(图1-A)。
为了进一步研究芝麻SiGolS6蛋白在物种中的进化位置及亲缘关系,应用MEGA5.2程序构建了多物种的系统进化树(图1-B)。结果表明,芝麻SiGolS6和马铃薯中的同源基因亲缘关系较近。
2.2 转基因拟南芥阳性植株鉴定
将pCAMBIA1301S-转化拟南芥,T1转基因材料经潮霉素筛选,共获得6个独立的转基因植株。22℃光照培养箱培养7—10 d,T2转基因株系在含潮霉素的MS筛选培养基上生长状况良好(图2-A),而野生型(wild type,WT)拟南芥根系较短,均黄化死去(图2-B)。提取WT和T2转基因植株的DNA,进行目的基因的分子验证,除WT外,均能扩增出目的条带(图2-C)。随机选择3个独立的转基因株系OE-2、OE-3、OE-4进行qPCR检测,结果显示,3个转基因株系中的表达显著高于野生型(图2-D)。GolS是催化棉子糖合成的关键酶[3]。进一步检测了超表达T3转基因株系及野生型中的棉子糖含量,结果表明,转基因拟南芥的棉子糖含量显著高于野生型植株(图3)。
2.3 转基因拟南芥的抗旱性分析
为了研究转拟南芥的抗旱性,对正常培养14 d的T3转基因植株和野生型植株进行干旱胁迫处理(不浇水)。结果表明,正常供水条件下,转基因株系和野生型植株均正常生长,二者长势无明显区别;干旱胁迫处理28 d,野生型植株萎蔫程度较转基因株系严重(图4-A),复水处理(恢复正常供水)5 d后,50%的转基因植株基本恢复,而野生型植株存活率不到10%(图4-A和图4-C)。
离体叶片失水率试验显示,野生型植株的失水率始终高于转基因株系(图4-B)。选取正常生长、干旱胁迫28 d及复水5 d的材料,分别测量其鲜重。结果显示,正常供水条件下,转基因材料的鲜重与野生型无明显差异。干旱胁迫及复水处理后,转基因植株的鲜重则显著高于野生型(图4-D)。电导率测定结果显示,干旱处理21 d后,转基因株系的相对电导率也显著低于野生型植株(图4-E)。
活性氧(ROS)和MDA含量、SOD及POD活性是衡量植物抗逆性状的重要生理指标。氮蓝四唑(nitrobluetetrazolium,NBT)染色结果显示,正常供水条件下,转基因材料染色程度和野生型材料基本一致,说明二者在正常条件下产生的超氧自由基差异不大。而干旱胁迫下,转基因材料较野生型材料染色面积小,说明胁迫条件下,转基因株系积累的活性氧明显低于野生型材料(图5-A)。取干旱胁迫21 d的拟南芥植株,分别检测其MDA含量、SOD及POD活性,发现转基因株系的相对MDA含量明显低于野生型植株(图5-B),相对SOD活性和POD活性则明显高于野生型拟南芥植株(图5-C和图5-D)。

SiGolS6:芝麻Sesamum indicum,XP_011087512.1;CsGolS:甜橙Citrus sinensis,XP_006444560.1;PtGolS:毛果杨Populus trichocarpa,XP_011087512.1;AtGolS1:拟南芥Arabidopsis thaliana,NP_182240.1;GrGolS:棉花Gossypium raimondii,XP_012490292.1;VvGolS:葡萄Vitis vinifera,XP_002281369.1;SlGolS:番茄Solanum lycopersicum,NP_001234668.2;StGolS:马铃薯Solanum tuberosum,ADW78838.1;SbGolS:高粱Sorghum bicolor,XP_002467954.1;BdGolS:二穗短柄草Brachypodium distachyon,XP_003558046.1;SitGolS:谷子Setaria italica,XP_004984579.1;OsGolS:水稻Oryza sativa,XP_015628833.1;ZmGolS:玉米Zea mays,NP_001105748.2。划线处为Glycosyl transferase, family 8(IPR002495)保守结构域The line marks the Glycosyl transferase, family 8 (IPR002495) conserved domain
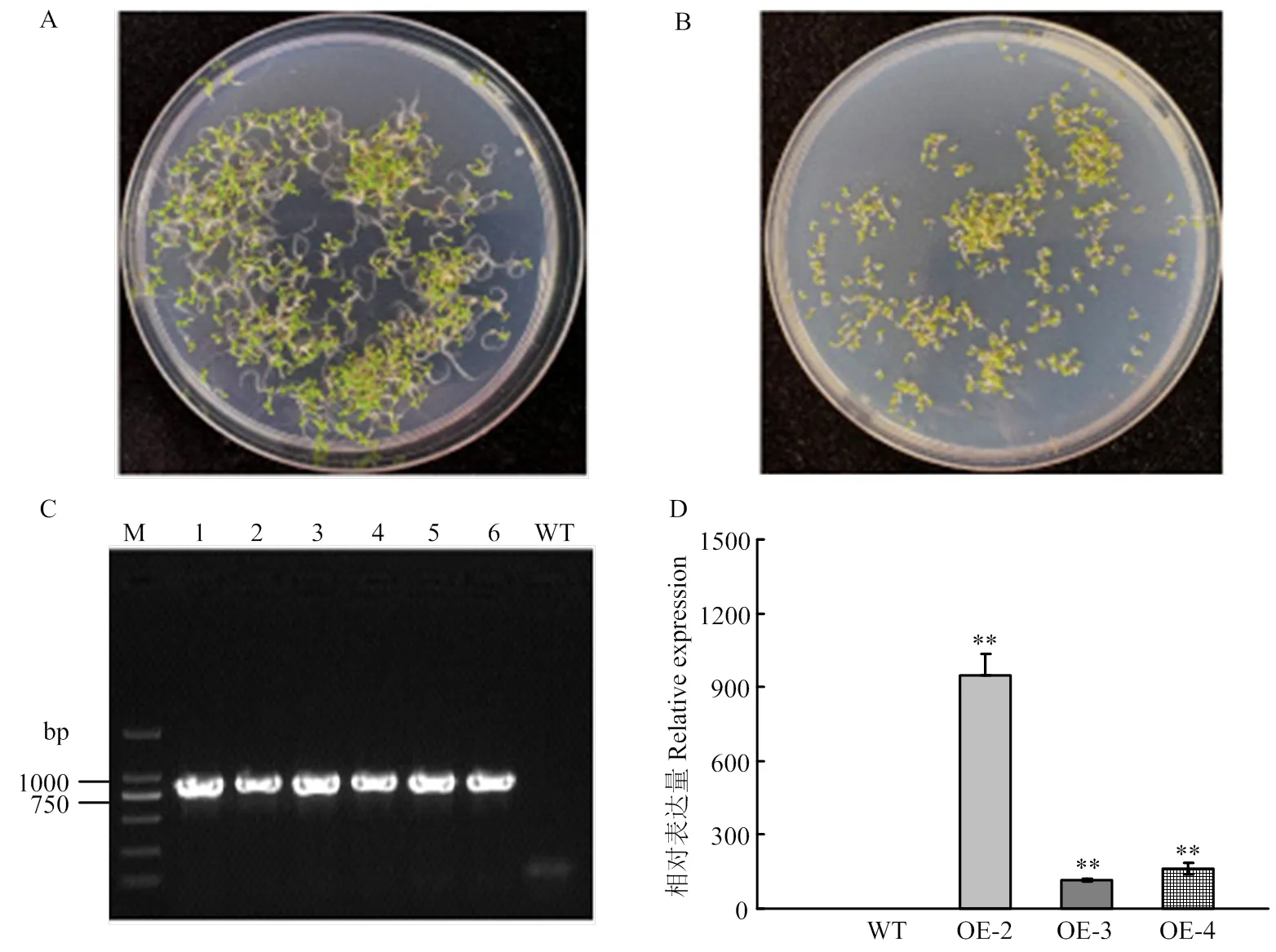
A、B:含潮霉素的MS筛选培养基上生长的T2转基因(A)和野生型(B)植株;C:T2阳性转基因植株鉴定,1—6:转基因株系;WT:野生型对照;D:转基因株系中SiGolS6的表达量检测。*表示在P<0.05水平上差异显著;**表示在P<0.01水平上差异显著。下同
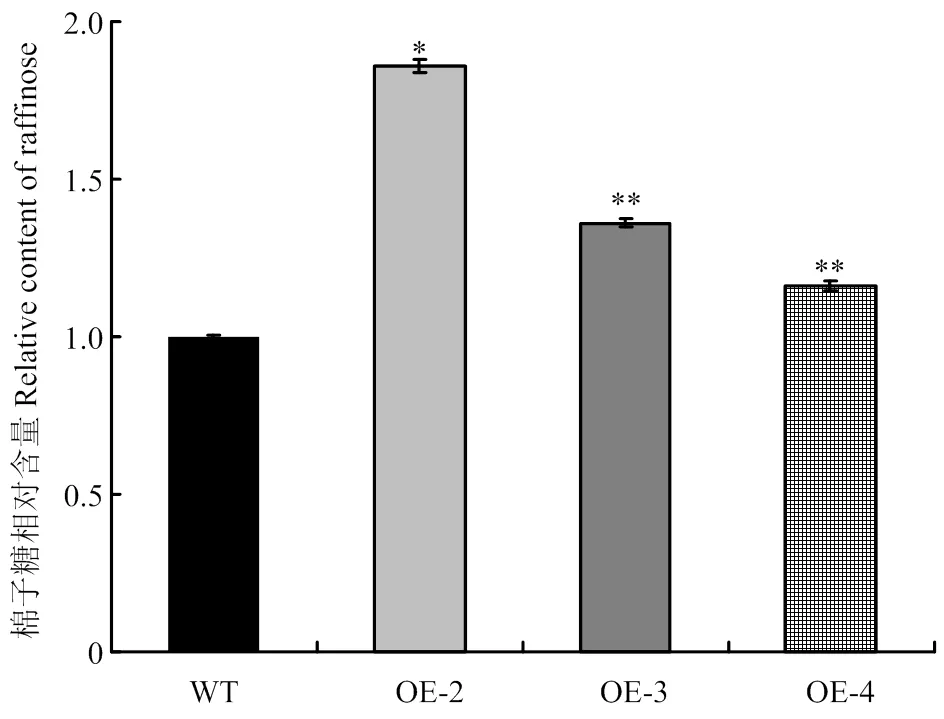
图3 转基因株系中棉子糖含量检测
3 讨论
3.1 芝麻SiGolS6序列分析
SiGolS6是芝麻糖基转移酶超家族中的一员,通过对芝麻SiGolS6和其他物种GolS进行多序列比对并构建系统进化树,表明SiGolS6与马铃薯同源基因的亲缘关系较近。有研究发现,RFOs对马铃薯在胁迫条件下的耐受能力起着关键作用[26],而GolS是马铃薯RFOs合成过程中的关键酶,可见GolS对马铃薯在逆境下的抗性也至关重要。同源性分析发现芝麻SiGolS6与马铃薯亲缘关系较近,说明SiGolS6可能也参与植物逆境胁迫抗性。前期研究工作中,我们在芝麻基因组中鉴定了7个GolS基因(—),表达分析发现,受干旱胁迫的强烈诱导[19]。而前人研究表明,拟南芥、水稻、玉米、白杨和番茄中GolS基因的表达在干旱、高盐等非生物胁迫条件下上升[14,27-29]。通过进一步研究证明了上述一些基因在逆境胁迫中发挥了重要作用,如拟南芥的表达受干旱胁迫诱导,而超表达不仅能够增强拟南芥的抗旱、抗盐以及抗氧化胁迫的能力[14,30],而且能够提高单子叶模式植物二穗短柄草以及水稻的抗旱性[15,31]。以上结果表明芝麻可能参与植物抗逆反应。
3.2 芝麻SiGolS6对转基因拟南芥耐旱性的影响
植物在正常条件下RFOs含量很少,但在逆境胁迫下,RFOs的积累会被诱导,从而增强植株的抗逆性[7-8,32]。GolS是催化RFOs合成的关键酶[3],其活性会影响RFOs的积累水平[33]。检测转基因和野生型植株的棉子糖含量发现,转基因拟南芥的棉子糖含量显著高于野生型植株,说明GolS表达量的升高确实导致了RFOs的积累。通过对转基因拟南芥材料在正常及干旱胁迫条件下的表型鉴定发现,在正常条件下,转基因植株与野生型植株的生长(鲜重)无显著差异,但在干旱胁迫处理及复水后,转基因植株的鲜重显著高于野生型植株。干旱胁迫过程中,转基因植株的萎蔫程度较野生型轻;复水5 d后,大约50%的转基因植株基本恢复正常生长状态,而野生型植株死亡率则达到90%以上。进一步分析发现,转基因植株的离体叶片失水速率低于野生型;干旱胁迫下,转基因植株的相对电导率也显著低于野生型。以上结果都说明在干旱胁迫下,提高了转基因植株的耐旱能力。此外,转基因拟南芥植株的抗旱性可能与表达量水平存在一定的关系。如表达量较高的OE-2家系在胁迫复水后,长势较OE-3和OE-4更好。存活率、鲜重和相对电导率等指标也显示OE-2家系的耐旱性强于OE-3和OE-4。
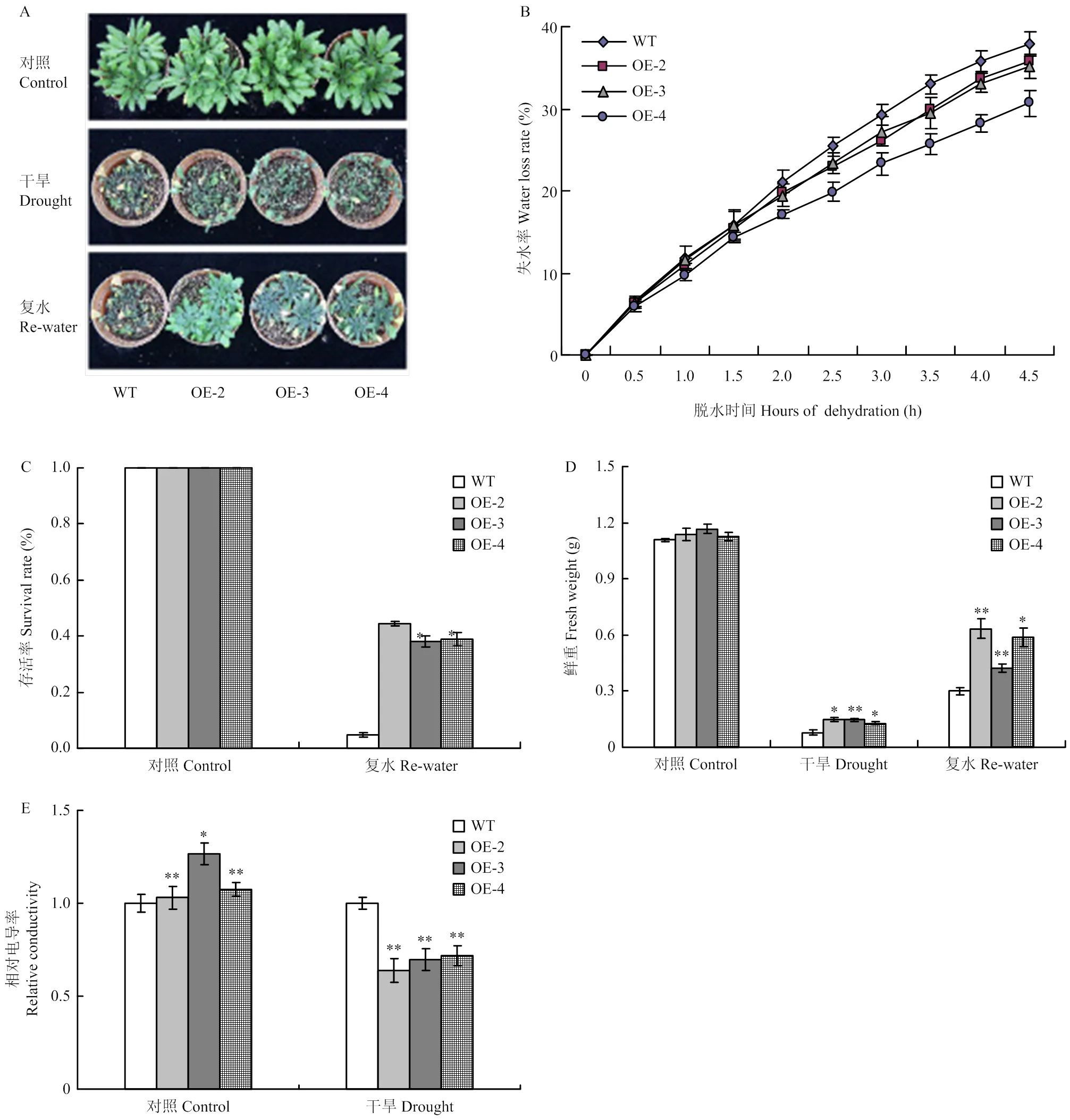
A:干旱胁迫下野生型和转基因植株的表型;B:野生型和转基因植株离体叶片失水速率,3次重复;C:干旱胁迫复水后野生型和转基因植株的存活率;D—E:干旱胁迫下野生型和转基因植株鲜重(D)和相对电导率(E)
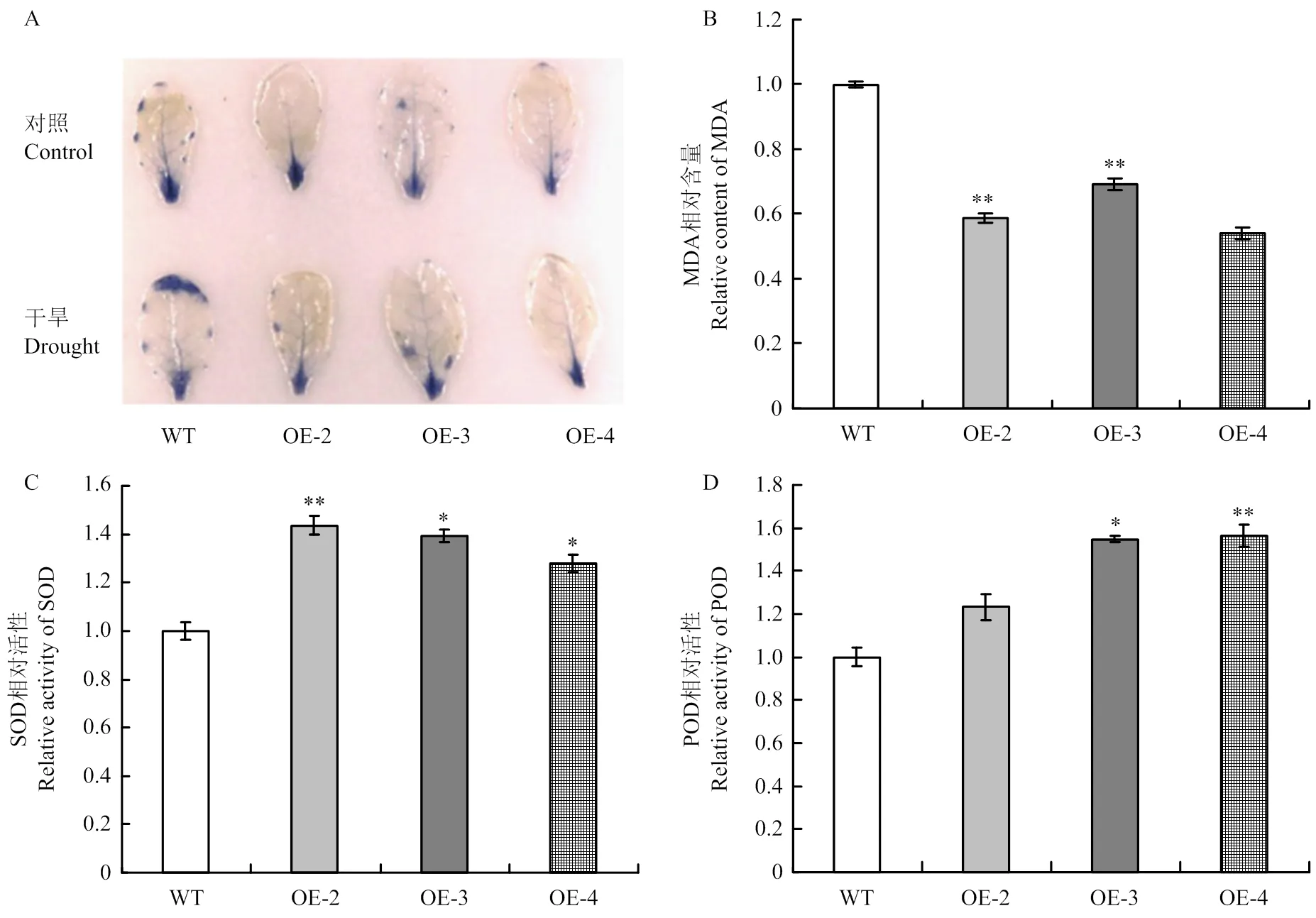
A:正常供水和干旱胁迫下离体叶片的氮蓝四唑(NBT)染色;B—D:干旱胁迫下野生型和转基因植株相对MDA含量(B)、相对SOD活性(C)和相对POD活性(D)
3.3 芝麻SiGolS6对转基因拟南芥抗氧化能力的影响
在逆境胁迫条件下,植物体内的ROS会大量积累,导致细胞受到损害,并对植物生长发育产生不利影响[34]。有研究表明,RFOs可以作为抗氧化剂,限制ROS过量积累,保护细胞免受氧化损伤[35-36]。超量表达拟南芥和鹰嘴豆GolS基因的转基因材料均表现出RFOs含量上升,在逆境胁迫条件下ROS积累较少,氧化损伤较小,对逆境胁迫抗性显著增强[35,37]。本研究中,NBT染色结果表明,干旱胁迫下转基因株系积累的O2-低于野生型材料,转基因株系的MDA含量也显著低于野生型,说明转基因植株在干旱胁迫下ROS积累较少,受到的氧化损伤相对较低。SOD和POD是植物酶促抗氧化系统的重要组分,在活性氧清除和非生物逆境抗性中发挥着重要作用[34]。超量表达南极发草()和水稻都可以提高转基因水稻中ROS清除相关酶基因的表达,降低胁迫条件下ROS积累水平,显著增强转基因材料对干旱和低温的抗性[38]。本研究也发现转基因拟南芥株系中SOD和POD活性显著高于野生型。综上所述,转基因植株通过提高抗氧化能力增强了对干旱胁迫的抗性。
4 结论
在拟南芥中超量表达芝麻肌醇半乳糖苷合成酶基因,提高了转基因植株棉子糖含量和抗氧化酶活性,增强了转基因植株干旱胁迫耐受性。推测可能参与植物对干旱胁迫的应答过程。
[1] 武新娟. 马铃薯不同品种的抗旱性评价及Fe-SOD基因的研究[D]. 哈尔滨: 东北农业大学, 2008.
WU X J. Evaluation of drought tolerance and clone of gene Fe-SOD in potato varieties [D]. Harbin: Northeast Agricultural University, 2008. (in Chinese)
[2] 王林海, 张艳欣, 危文亮, 张秀荣. 中国芝麻湿害和旱害发生调查与分析. 中国农学通报, 2011, 27(28): 301-306.
WANG L H, ZHANG Y X, WEI W L, ZHANG X R. Investment of waterlogging and drought effect on the sesame production in China.,2011, 27(28): 301-306. (in Chinese)
[3] 范洁. 木薯肌醇半乳糖苷合成酶基因的抗旱功能研究[D]. 海口: 海南大学, 2015.
FAN J.Functional characterization involved in drought stress of galactinol synthase genefromCrantz [D].Haikou: Hainan University, 2015. (in Chinese)
[4] 李芳, 汪晓峰. 植物中棉子糖系列寡糖代谢及其调控关键酶研究进展. 西北植物学报, 2008, 28(4): 4852-4859.
LI F, WANG X F. Advance in raffinose family oligosaccharides metabolism and the key enzymes in plants.,2008, 28(4): 4852-4859. (in Chinese)
[5] HORBOWICZ M, OBENDORF R L. Seed desiccation tolerance and storability: Dependence on flatulence-producing oligosaccharides and cyclitols-review and survey., 1994, 4(4): 385-405.
[6] MUZQUIZ M, BURBANO C, PEDROSA M M, FOLKMAN W, GULEWICZ K. Lupins as a potential source of raffinose family oligosaccharides., 1998, 9(3): 183-188.
[7] 林世锋, 王仁刚, 任学良, 王东茂, 张拓, 黄亚娟. 烟草肌醇半乳糖苷合成酶基因的克隆及序列分析. 东北农业大学学报, 2012, 43(7): 113-118.
LIN S F, WANG R G, REN X L, WANG D M, ZHANG T, HUANG Y J.Cloning and sequence analysis of a galactinol synthase gene).,2012, 43(7): 113-118.(in Chinese)
[8] 王毅, 肖良俊, 马婷, 宁德鲁. 泡核桃肌醇半乳糖苷合成酶基因克隆及表达分析. 基因组学与应用生物学, 2018, 37(5): 2029-2033.
WANG Y, XIAO L J, MA T, NING D L. Cloning and expression analysis of inositol galactinol synthase gene in., 2018, 37(5): 2029-2033. (in Chinese)
[9] DOWNIE B, GURUSINGHE S, DAHAL P, THACKER R R, SNYDER J C, NONOGAKI H, YIM K, FUKANAGA K, ALVARADO V AND KENT J. Bradford expression of a GALACTINOL SYNTHASE gene in tomato seeds is up-regulated before maturation desiccation and again after imbibition whenever radicle protrusion is prevented., 2003, 131(3): 1347-1359.
[10] CUNNINGHAM S M, NADEAU P, CASTONGUAY Y, LABERGE S, VOLENEC J. Raffinose and stachyose accumulation, galactinol synthase expression, and winter injury of contrasting alfalfa germplasms., 2003, 43(2): 562-570.
[11] 缪旻珉, 李娜, 任旭琴, 张宗东, 程皓, 曹碚生. 一个辣椒肌醇半乳糖苷合成酶同源基因全长cDNA的克隆与低温表达分析. 园艺学报, 2008(11): 1671-1675.
MIAO M M, LI N, REN X Q, ZHANG Z D, CHENG H, CAO B S. Cloning, characterization and expression of a putative galactinol synthase gene from cold stressed pepper (L.)., 2008(11): 1671-1675.(in Chinese)
[12] 李涛. 棉子糖系列寡糖(RFOs)在玉米与拟南芥植株抗旱及种子活力中的功能研究[D]. 杨凌: 西北农林科技大学, 2017.
Li T.The function of raffinose family oligosaccharides in plant drought stress tolerance and seed vigor of maize and[D]. Yangling: Northwest A&F University, 2017. (in Chinese)
[13] SARAVITZ D M, PHARR D M, CARTER T E. Galactinol synthase activity and soluble sugars in developing seeds of four soybean genotypes., 1987, 83: 185-189.
[14] TAJI T, OHSUMI C, IUCHI S,SEKI M, KASUGA M, KOBAYASHI M, SHINOZAKI K Y, SHINOZAKI K. Important roles of drought- and cold-inducible genes for galactinol synthase in stress tolerance in., 2002, 29(4): 10.
[15] HIMURO Y, ISHIYAMA K, MORI F, GONDO T, TAKAHASHI F, SHINOZAKI K, KOBAYASHI M, AKASHI R.galactinol synthaseimproves drought tolerance in the monocot model., 2014, 171(13): 1127-1131.
[16] 范洁, 王雨晴, 李瑞梅, 张帆, 段瑞军, 符少萍, 刘姣, 胡新文, 郭建春. 木薯中肌醇半乳糖苷合成酶基因在大肠杆菌中的表达. 分子植物育种, 2015, 13(5): 1027-1032.
FAN J, WANG Y Q, LI R M, ZHANG F, DUAN R J, FU S P, LIU J, HU X W, GUO J C.Expression of recombinant galactinol synthase ofGrantz in., 2015, 13(5): 1027-1032.(in Chinese)
[17] WANG Z, ZHU Y, WANG L L, LIU X, LIU Y X, PHILLIPS J, DENG X. A WRKY transcription factor participates in dehydration tolerance inby binding to the W-box elements of the galactinol synthase () promoter., 2009, 230(6): 1155-1166.
[18] GU L, ZHANG Y, ZHANG M, LI T,DIRK L M A, DOWNIE B, ZHAO T Y., a target of transcription factor ZmDREB2A, offers similar protection against abiotic stress as., 2016, 90(1/2): 157-170.
[19] YOU J, WANG Y Y, ZHANG Y J, DOSSA K, LI D H, ZHOU R, WANG L H, ZHANG X R. Genome-wide identification and expression analyses of genes involved in raffinose accumulation in sesame., 2018, 8(1): 4331.
[20] 肖本泽. 抗旱候选基因和启动子的水稻遗传转化分析和田间抗旱性鉴定[D]. 武汉: 华中农业大学, 2007.
XIAO B Z. Transformation study and field testing of candidate genes and promoters for drought resistance in rice[D].Wuhan: Huazhong Agricultural University, 2007.(in Chinese)
[21] TAMURA K, PETERSON D, PETERSON N, STECHER G, NEI M, KUMAR S. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods., 2011, 28: 2731-2739
[22] 刘慧娟, 冯志国, 李先文, 李涛, 何光源. 采用农杆菌花序浸染法获得转crtB基因拟南芥. 湖北农业科学, 2013, 52(1): 200-202.
LIU H J, FENG Z G, LI X W, LI T, HE G Y.Obtaining crtB transgenicby agrobacterium tumefaciens-floral dip method.,2013, 52(1): 200-202.(in Chinese)
[23] 周瑢, 刘盼, 黎冬华, 张艳欣, 王林海, 张秀荣, 魏鑫. 芝麻硬脂酸脱饱和酶基因SiSAD的克隆及功能验证.中国农业科学, 中国农业科学, 2019, 52(10): 1678-1685.
ZHOU R, LIU P, LI D H, ZHANG Y X, WANG L H, ZHANG X R, WEI X. Cloning and Functional Characterization of Sesame SiSAD Gene., 2019, 52(10): 1678-1685. (in Chinese)
[24] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method., 2001, 25: 402-408.
[25] 陈建勋, 王晓峰. 植物生理学实验指导. 第二版. 广州: 华南理工大学出版社, 2006: 64-66.
CHEN J X, WANG X F.. Guangzhou: South China University of Technology Press, 2006: 64-66. (in Chinese)
[26] FOLGADO R, PANIS B, SERGEANT K, RENAUT J, SWENNEN R, HAUSMAN J F. Unravelling the effect of sucrose and cold pretreatment on cryopreservation of potato through sugar analysis and proteomics., 2015, 71(3): 432-441.
[27] SAITO M, YOSHIDA M. Expression analysis of the gene family associated with raffinose accumulation in rice seedlings under cold stress., 2011, 168(18): 2268-2271.
[28] ZHOU M L, ZHANG Q, ZHOU M, SUN Z M, ZHU X M, SHAO J R, TANG Y X, WU Y M. Genome-wide identification of genes involved in raffinose metabolism in maize.,2012, 22(12): 1775-1785.
[29] ZHOU J, YANG Y, YU J, WANG L K, YU X,OHTANI M, KUSANO M, SAITO K,DEMURA T,ZHUGE Q. Responses ofgalactinol synthase genes to abiotic stresses., 2014, 127(2): 347-358.
[30] NISHIZAWA A, YABUTA Y, SHIGEOKA S. Galactinol and raffinose constitute a novel function to protect plants from oxidative damage., 2008, 147(3): 1251-1263.
[31] SELVARAJ M G, TAKUMA ISHIZAKI T, VALENCIA M, OGAWA S, DEDICOVA B, OGATA T, YOSHIWARA K, MARUYAMA K, KUSANO M, SAITO K, TAKAHASHI F, SHINOZAKI K, NAKASHIMA K, ISHITANI M. Overexpression of angalactinol synthase gene improves drought tolerance in transgenic rice and increased grain yield in the field., 2017, 15(11): 1465-1477.
[32] 左静. 梅花肌醇半乳糖苷和棉子糖合成酶基因的克隆与功能初探[D]. 武汉: 华中农业大学, 2017.
Zuo J. Cloning and functional analysis of galactinol and raffinose synthase genes in[D].Wuhan: Huazhong Agricultural University, 2017.(in Chinese)
[33] THOMAS P, ANDREAS R. Biochemistry and physiology of raffinose family oligosaccharides and galactosyl cyclitols in seeds., 2001, 11(3): 185-197.
[34] YOU J, CHAN Z. ROS regulation during abiotic stress responses in crop plants., 2015, 6: 1092.
[35] NISHIZAWA A, YABUTA Y, SHIGEOKA S. Galactinol and raffinose constitute a novel function to protect plants from oxidative damage., 2008, 147(3): 1251-1263.
[36] VAN DEN ENDE W. Multifunctional fructans and raffinose family oligosaccharides., 2013, 4: 247.
[37] SALVI P, KAMBLE N U, MAJEE M. Stress-inducible galactinol synthase of chickpea (CaGolS) is Implicated in heat and oxidative stress tolerance through reducing stress-induced excessive reactive oxygen species accumulation., 2018, 59(1): 155-166.
[38] CUI L H, BYUN M Y, OH H G, KIM S J, LEE J, PARK H, LEE H, KIM W T. Poaceae type II galactinol synthase 2 from Antarctic flowering plantand rice improves cold and drought tolerance by accumulation of raffinose family oligosaccharides in transgenic rice plants., 2020,61(1): 88-104.
Cloning and Function Analysis of Sesame Galactinol Synthase Gene
LIU AiLi, WEI MengYuan, LI DongHua, ZHOU Rong, ZHANG XiuRong, YOU Jun
(Oil Crops Research Institute of the Chinese Academy of Agricultural Sciences/Key Laboratory of Biology and Genetic Improvement of Oil Crops, Ministry of Agriculture and Rural Affairs, Wuhan 430062)
【】is a member of galactinol synthase family in sesame,which may play important role in drought stress resistance. Studying the function of【】The galactinol synthase gene,, was isolated from sesame through reverse transcription PCR (RT-PCR). The sequence was analyzed by bioinformatics tools such as InterProScan, ClustalX2 and MEGA5.2. Then the function of SiGolS6 in plant drought resistance was characterized by phenotype analysis and physiological index measurement oftransgenic. 【】The total length of the CDS sequence ofwas 921 bp, encoding a polypeptide of 306 amino acids. The molecular weight of SiGolS6 is 35.07 kD and its isoelectric point is 4.7. Sequence analysis showed that SiGolS6 protein contained conserved glycosyl transferase domain (IPR002495), belonging to the glycosyl transferase superfamily. Based on phylogenetic tree constructed with GolS proteins from sesame and other species, SiGolS6 was highly similar to the homologous genes in potato. Six independent transgeniclines were identified by hygromycin screening and PCR. Three transgenic lines (OE-2, OE-3, and OE-4) with high expression levels were identified by qRT-PCR, and used for subsequent experiment. Raffinose content in those transgenic plants was higher than that in wild-type (WT) plants. Under drought stress, the wilting degree of transgenic lines was less than that of WT lines. After 28 d of drought stress and 5 d of recovery, the fresh weight of transgenic lines was significantly higher than that of WT, but there was no significant difference under normal conditions. After 5 d of recovery, 50% of transgenic plants recovered, while the survival rate of WT was less than 10%. After 21 d of drought stress, the relative electrical conductivity, ROS accumulation and MDA content of transgenic plants were significantly lower than those of WT, while the relative activities of SOD and POD were significantly higher than those of WT.【】Overexpression ofcould improve the drought tolerance of transgenic plant.
sesame; galactinol synthase; transgenic; drought tolerance; functional analysis

10.3864/j.issn.0578-1752.2020.17.002
2019-12-30;
2020-03-08
国家特色油料产业技术体系(CARS-14)、中国农业科学院科技创新工程(CAAS-ASTIP-2016-OCRI)、中央级公益性科研院所基本科研业务费专项(Y2019XK15-02)
刘爱丽,E-mail:liuailihappy@126.com。通信作者游均,E-mail:junyou@caas.cn
(责任编辑 李莉)
