紫花苜蓿MsWRKY42的分离、鉴定及其对非生物胁迫的响应
2020-09-12刘佼佼王学敏马琳崔苗苗曹晓宇赵威
刘佼佼,王学敏,马琳,崔苗苗,曹晓宇,赵威
紫花苜蓿的分离、鉴定及其对非生物胁迫的响应
刘佼佼1,王学敏2,马琳2,崔苗苗2,曹晓宇2,赵威1
(1河南科技大学农学院/牡丹学院,河南洛阳 471023;2中国农业科学院北京畜牧兽医研究所,北京 100193)
【】WRKY是转录因子大家族,在植物生长发育及逆境胁迫应答中发挥着核心调控作用。通过分析转录因子MsWRKY42在紫花苜蓿抗逆境过程中的作用,为进一步研究WRKY转录因子在紫花苜蓿抗逆分子调控中的作用奠定基础。通过同源比对方法从紫花苜蓿转录组基础数据库中获得序列。使用MEGA-X对MsWRKY42蛋白序列及拟南芥序列进行多序列比对,构建系统发育树。通过PlantCARE预测分析启动子的顺式作用元件。采用实时荧光定量PCR(qRT-PCR)方法分析在紫花苜蓿不同组织中的表达量及其在NaCl(0.3 mol·L-1)、PEG(15%)、4℃、40℃、低磷以及ABA(0.1×10-3mol·L-1)处理后的表达量变化。构建pCAMBIA1300-融合表达载体,通过农杆菌转化本氏烟草(),确定MsWRKY42蛋白的亚细胞定位。利用酵母单杂交系统检测MsWRKY42和启动子区域顺式作用元件W-box的体外结合活性。该基因包含1个1 692 bp的开放阅读框,编码563个氨基酸。多序列比对及系统进化树分析表明,该蛋白属于Ⅱb类WRKY家族成员,含有1个WRKY保守结构域和1个C2H2锌指基序,与拟南芥WRKY家族中的相似度最高,故将其命名为。在紫花苜蓿启动子区域鉴定到多个顺式作用元件,主要包括胁迫响应、激素响应、生长发育等不同生命活动相关的调控作用元件。实时荧光定量PCR结果表明,在紫花苜蓿各组织中均有不同程度的表达,其中根、叶中的表达量最高,茎、花、荚果中次之,芽中最低。经NaCl、PEG、低温、高温、低磷和ABA处理后的表达量均有不同程度的上调。亚细胞定位结果显示,MsWRKY42蛋白定位在细胞核上。酵母单杂交系统检测结果显示,MsWRKY42能够与W-box顺式作用元件特异性结合。MsWRKY42为典型的WRKY转录因子,蛋白质定位在细胞核,能够与W-box顺式作用元件特异性结合;该基因在紫花苜蓿不同组织部位中均有表达,在根和叶中的表达量最高,且表达受NaCl、PEG、低温、高温胁迫和ABA激素的正向诱导。在紫花苜蓿中,该基因可能参与多种非生物胁迫反应。
紫花苜蓿;WRKY转录因子;非生物胁迫;亚细胞定位;结合活性分析
0 引言
【研究意义】紫花苜蓿(L.)是多年生豆科牧草,其营养价值高、分布范围广,是中国北方干旱和半干旱地区促进农业生产和经济发展的关键草种之一[1]。随着生态环境的不断恶化,紫花苜蓿的产量和品质都面临严峻考验,苜蓿产业化发展受到遏制。发掘紫花苜蓿重要抗逆基因资源,了解其抗逆调控机制,对于指导苜蓿抗逆遗传育种和生产实际具有重要意义。【前人研究进展】植物在生长发育过程中不断适应环境变化,已经形成了一套复杂高效的信号传导网络,转录因子在其中起核心调控作用[2]。WRKY作为植物中十大转录因子家族之一,因其N端含有保守的WRKYGQK结构域而得名,其C末端包含独特的锌指基序——C2H2(C-X4-5-C-X22-23-H- X-H)或C2HC(C-X5-8-C-X25-28-H-X1-2-C)。一般情况下,根据N端结构域的数量和C端锌指基序的特征将WRKY家族分为三类:第一类(Ⅰ)有2个WRKY结构域和C2H2型锌指结构域;第二类(Ⅱ)有1个WRKY结构域和C2H2型锌指结构域,在此基础上根据其结构进一步分为5个亚类(Ⅱa、Ⅱb、Ⅱc、Ⅱd和Ⅱe);第三类(Ⅲ)有1个WRKY结构域和C2HC型锌指结构域。WRKY蛋白能够与靶基因启动子中的顺式作用元件W-box(TTGACC/T)发生特异性结合,从而调控目的基因的表达,进而广泛参与植物生长发育代谢以及各种生物、非生物胁迫(干旱胁迫、高盐胁迫、温度胁迫和营养胁迫)响应过程,被称为非生物胁迫响应的“中心调控因子”[3-5]。拟南芥()中有众多WRKY转录因子都和植物耐旱或耐盐性相关[6]。其中,通过调节膜转运蛋白参与气孔关闭以保持水分[7];直接与逆境诱导型基因和启动子中的W-box结合,提高拟南芥的耐旱和耐盐性[8]。玉米(L.)中的可在干旱和高盐条件下被诱导,并且过表达可以激活等多个基因,从而增强植物对干旱和高盐胁迫的耐受性[9]。YANG等[10]研究表明核桃()和通过脱落酸(abscisic acid,ABA)信号传导途径提高植物对盐、渗透等的耐受性。温度环境是影响植物生长发育的另一重要因素。Zou等[11]研究发现,低温敏感性植物的成熟花粉对冷胁迫刺激的敏感度非常高,花粉中特异性表达的能负调控低温应答途径。油菜()中的能激活ABA信号途径中的相关基因提高植物的耐低温能力[12]。在热激蛋白HSP101启动子的控制下,过表达增强了转基因水稻(L.)幼苗的耐热性[13]。拟南芥的是首个被报道的参与调节低磷胁迫的WRKY家族成员。在沉默株系中,磷饥饿相关基因(如磷酸酶、和高亲和力磷转运蛋白)的表达降低[14]。另有研究发现AtWRKY42和AtWRKY6可与AtPHO1(AtPHOSPHATE1)结合,通过抑制的表达能够负调控磷从地下部分向地上部分的转运[15];同时,磷的缺乏诱导26S蛋白酶体降解AtWRKY6和AtWRKY42转录因子[16]。低磷条件下,与野生型相比,过表达的水稻植株低磷耐受性增强,同时能够调节磷稳态与磷饥饿之间的潜在串扰[17]。【本研究切入点】目前,关于WRKY家族的研究多集中在一些模式植物中,在牧草中鲜有报道。紫花苜蓿作为牧草中的典型代表,WRKY蛋白在紫花苜蓿中的分子机理尚不明确。【拟解决的关键问题】本研究从紫花苜蓿中成功克隆WRKY基因,对其进行生物信息学分析,并研究在不同组织中和非生物逆境胁迫下的表达模式,同时进行亚细胞定位分析、构建超表达植物表达载体,为深入研究的功能和抗逆调控机制奠定基础,同时为紫花苜蓿抗逆育种筛选优良的基因资源。
1 材料与方法
1.1 试验材料
试验材料为紫花苜蓿中苜一号(L.,Zhongmu No.1)品种,由中国农业科学院北京畜牧兽医研究所保存。PROMEGA总RNA提取试剂盒,购自普洛麦格公司,TransScript Green One-Step qRT-PCR SuperMix、pEASY-Blunt Simple Cloning Kit、DH5α Chemically Competent Cell、EasyPure Quick Gel Extraction Kit、DNA凝胶试剂盒,购自北京全式金生物技术有限公司。试验所用的内切酶、连接酶均购自NEB(北京)有限公司。
1.2 紫花苜蓿MsWRKY42的克隆
使用Eastep® Super Total RNA Extraction Kit试剂盒(Promega)提取紫花苜蓿叶片总RNA,用紫外分光光度计测定RNA的纯度和浓度。利用TransScript Green One-Step qRT-PCR反转录体系合成cDNA。
根据已公开的拟南芥的cDNA序列,在紫花苜蓿二倍体水平CADL比对数据库(https:// www.alfalfatoolbox.org/doblast/Home.gy?filterword=DOBLAST&function=function0)中进行比对,参考相似度最高的序列设计特异引物(电子附表1),以紫花苜蓿cDNA为模板进行PCR扩增,反应体系为cDNA 2 μL、KOD-plus 1 μL、10×Buffer for KOD 5 μL、25 mmol·L-1MgSO42 μL、2 mmol·L-1dNTPs 5 μL、引物各1.5 μL和PCR grade water 32 μL。反应程序为94℃ 2 min;94℃ 30 s,58℃30 s,68℃2 min,34个循环;68℃ 10 min。产物经1%琼脂糖凝胶电泳检测、纯化后,连入Peasy-T1-Blunt载体,转化大肠杆菌DH5α感受态细胞,挑取单克隆进行菌液PCR验证,阳性克隆送生工生物工程(上海)股份有限公司测序。
1.3 MsWRKY42的序列分析
利用SnapGene软件分析开放阅读框及其氨基酸序列;通过Protparam(https://web.expasy. org/protparam/)分析的理化性质;利用在线程序PSORT II Prediction(https://psort.hgc.jp/form2. html)对MsWRKY42蛋白进行亚细胞定位预测;利用SOPMA(http://www.sopma.org/)在线预测该蛋白的二级结构;利用在线软件SWISS-model(https:// swissmodel.expasy.org)预测该蛋白的三级结构。
使用ClustalX软件与其他物种的同源基因进行多序列比对;将与拟南芥WRKY基因家族多序列比对后,用MEGA-X软件选择最大似然法(ML)法构建系统发育树,Bootstrap值设定为500,通过Bootstrap对生成的系统进化树进行校正;利用PlantCARE(http://www.plantcarescience.com/)预测分析启动子。
1.4 MsWRKY42组织特异性表达分析
分别提取中苜1号根、茎、叶、芽、花和荚果的总RNA,反转录成cDNA后,进行实时荧光定量PCR。根据得到的序列设计特异引物Q42F/R(电子附表1),以紫花苜蓿为内参基因,利用ABI7500 Real-Time PCR system(美国ABI公司),依照TaKaRa SYBY Premix Ex Taq说明书进行PCR扩增。3次生物学重复,2次技术重复。采用2-ΔΔCT方法[18]计算的表达量。
1.5 不同处理下MsWRKY42的表达分析
中苜一号种子经氯气消毒,平铺在有滤纸的培养皿中,用无菌水将滤纸浸湿,在光照培养箱(16 h光照/8 h黑暗)中培养至种子露白,发芽后的种子移至1/2 MS液体培养基中,培养4周后,分别移入0.3 mol·L-1NaCl、15% PEG、4℃、40℃、缺磷和0.1×10-3mol·L-1ABA处理的环境中,分别在0、2、4、6、8、12、24和48 h取样,每个处理3个生物学重复。每个样品取样完成,液氮速冻,-80℃保存。
1.6 MsWRKY42的亚细胞定位
设计亚细胞定位引物GFP-MsWRKY42F/R(电子附表1),在目的基因ORF两端(去掉终止密码子)加入酶切位点HⅠ和Ⅰ,以测序成功的阳性质粒T-blunt-为模板进行扩增、回收。用HⅠ和Ⅰ双酶切质粒pCAMBIA1300-,产物纯化。用连接酶将目的基因片段连接载体pCAMBIA1300-,并转化大肠杆菌DH5α感受态细胞,经菌液PCR及测序验证,获得重组质粒pCAMBIA1300-。将重组质粒和对照空载质粒pCAMBIA1300-分别转入农杆菌GV3101菌株中,把菌液PCR检测为阳性的单克隆菌落于含有35 μg·mL-1利福平和50 μg·mL-1卡那霉素的LB液体培养基中培养,在28℃摇床以250 r/min培养14 h;收集、重悬菌体,调整菌体浓度使其OD600在0.5—1.0,静置3 h后选择5—7片长势一致的本氏烟草叶片(带有RFP标签的核定位蛋白的烟草),用去掉针头的注射器注射含有目的基因载体和空载体的菌液。注射后的烟草置于28℃温室中培养2 d,光照周期为16 h/8 h(光照/黑暗)。用LEICA TCS SP8共聚焦显微镜观察侵染的叶片,确定蛋白的亚细胞定位。
1.7 MsWRKY42结合活性分析
根据W-box的序列(C/T)TGAC(C/T)设计能合成3个串联重复序列的W-box引物,在设计引物的同时加上RⅠ/Ⅰ酶切位点(电子附表1),连接酵母载体pHISi,构建重组质粒pHISi-W- box。测序验证正确后将重组质粒转入酵母YM4271,挑取阳性克隆,摇菌后制作感受态细胞,同时菌液均匀涂于加有不同浓度 3-AT的SD/-His单缺陷平板上,观察转化子的生长情况,筛选出3-AT浓度以消除pHISi-W-box引起的HIS的本底表达。根据的ORF序列(去掉终止密码子)设计带有HⅠ和Ⅰ双酶切位点的上下游引物PMsWRKY42F/R(电子附表1)。以含有CDS片段的T载体质粒为模板,扩增含有酶切位点的目的片段并回收,连接酵母表达载体pGADT7,构建重组质粒pGADT7-,测序验证正确后将pGADT7-、pHISi-W-box质粒转入酵母YM4271菌株中,挑取单克隆,摇菌后稀释成不同浓度,点涂在3-AT固体缺陷培养基SD/-His-Leu-ura上,同时分别将pHISi+pGADT7-42、pGADT7+pHISi、pGADT7+pHISi-W-box作为对照,观察转化子生长情况并拍照记录。
2 结果
2.1 MsWRKY42的克隆
以紫花苜蓿总RNA反转录获得的cDNA为模板,MsWRKY42F/R为引物进行PCR扩增,获得反应产物。该产物的琼脂糖凝胶电泳结果显示,条带明亮单一,大小与基因组测序结果一致(图1),初步判定获得目的条带。
将PCR产物纯化回收后,连接至Peasy-T1-Blunt载体上,再转化至DH5α大肠杆菌感受态中,挑取单菌落检验。菌液PCR结果显示,所选菌液能够扩增出与目的片段大小一致的DNA片段。将上述菌液送至生物公司测序,结果显示与参考序列一致,表明克隆成功。
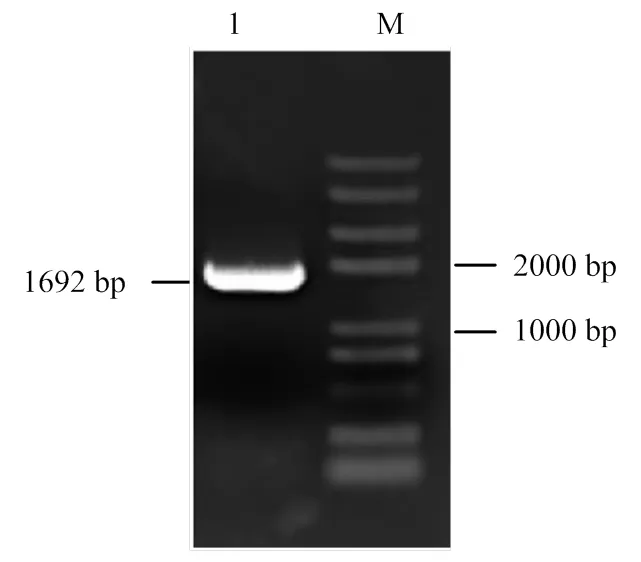
M:Trans2K Plus II DNA分子标记;1:PCR扩增产物
2.2 MsWRKY42的序列分析
利用SnapGene软件对序列进行分析,该基因片段包含一个1 692 bp的开放阅读框,共编码563个氨基酸。该序列编码的蛋白理论等电点为7.70,相对分子量60.74 kD,不稳定系数为42.49,属于不稳定蛋白,该蛋白平均亲水系数为-0.668,为亲水性蛋白。利用在线程序PSORT II Prediction对MsWRKY42蛋白进行亚细胞定位预测,结果显示该蛋白位于细胞核上的可能性最高,为56.15%。
利用DNAMAN软件将与其他物种氨基酸序列进行同源比对,发现该蛋白序列含有WRKY家族典型的WRKYGQK结构域,同时含有1个C2H2锌指基序(图2)。氨基酸序列与豆科植物的相似度很高,其中,与蒺藜苜蓿的相似度为96.27%。与拟南芥WRKY基因家族多序列比对后构建系统进化树(图3),参考拟南芥分组方法,MsWRKY42转录因子属于Ⅱb组。
对MsWRKY42蛋白的二级结构预测结果显示(图4),该蛋白的主要二级结构元件中,无规则卷曲所占比例最高,为63.94%。α-螺旋和β-转角所占比例依次为22.91%和10.83%,没有β-折叠。通过在线程序SWISS-model对蛋白三维结构进行同源模拟预测发现(图5),MsWRKY42蛋白与PDB数据库(http:// www.rcsb.org/)WRKY蛋白晶体结构模型中的2AYD(AtWRKY1)序列同一性最高。MsWRKY42蛋白由5条反平行β链组成,其中一条β链末端为锌结合位点。
2.3 MsWRKY42启动子分析
通过PlantCARE启动子预测软件分析启动子(表1)。结果显示,该基因启动子包含许多顺式作用元件,其中有参与逆境胁迫、参与ABA以及MeJA反应的元件,也存在光响应、昼夜节律响应等元件。暗示可能受干旱、高温等与水分胁迫相关的逆境诱导。
2.4 MsWRKY42蛋白的定位
通过进行亚细胞定位(图6),在注射空载体pCAMBIA1300-的对照组中,绿色荧光在细胞膜、细胞核、细胞质中均有分布,而注射融合表达载体pCAMBIA1300-的细胞中,仅在细胞核中发现有绿色荧光,在细胞膜和细胞质中均无荧光,且绿色荧光与核定位的marker蛋白的红色荧光完全重合。说明MsWRKY42蛋白定位且只定位在细胞核上,这一结果与亚细胞定位预测结果一致。
2.5 MsWRKY42组织特异性表达分析
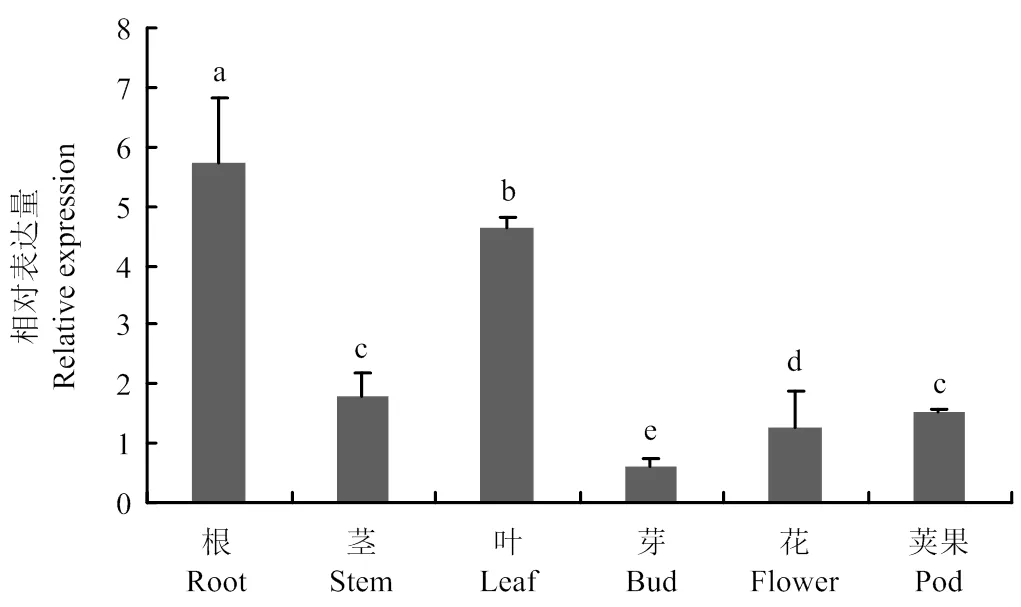
采用qRT-PCR技术分析在紫花苜蓿各个组织中的相对表达量。结果(图7)表明,在紫花苜蓿在各个组织中均有不同程度表达。其中在根、叶中的表达丰度较高,茎、花、荚果中次之,在芽中表达丰度最低。

MsWRKY42;紫花苜蓿Medicago sativa;AtWRKY42:拟南芥Arabidopsis thaliana,NP_001328851.1;MtWRKY:蒺藜苜蓿Medicago truntula,XP_013462871.1;CaWRKY31:鹰嘴豆Cicer arietinum,XP_004486177.1;SsWRKY6:密花豆Spatholobus suberectus,TKY72179.1;GmWRKY42:大豆Glycine max,AJB84600.1;GhWRKY42:陆地棉Gossypium hirsutum,AIE43854.1。下同The same as below。方框表示WRKY结构域。三角表示C2H2基序The WRKY domain are represented in the boxes. The C2H2 motif are represented on the triangle
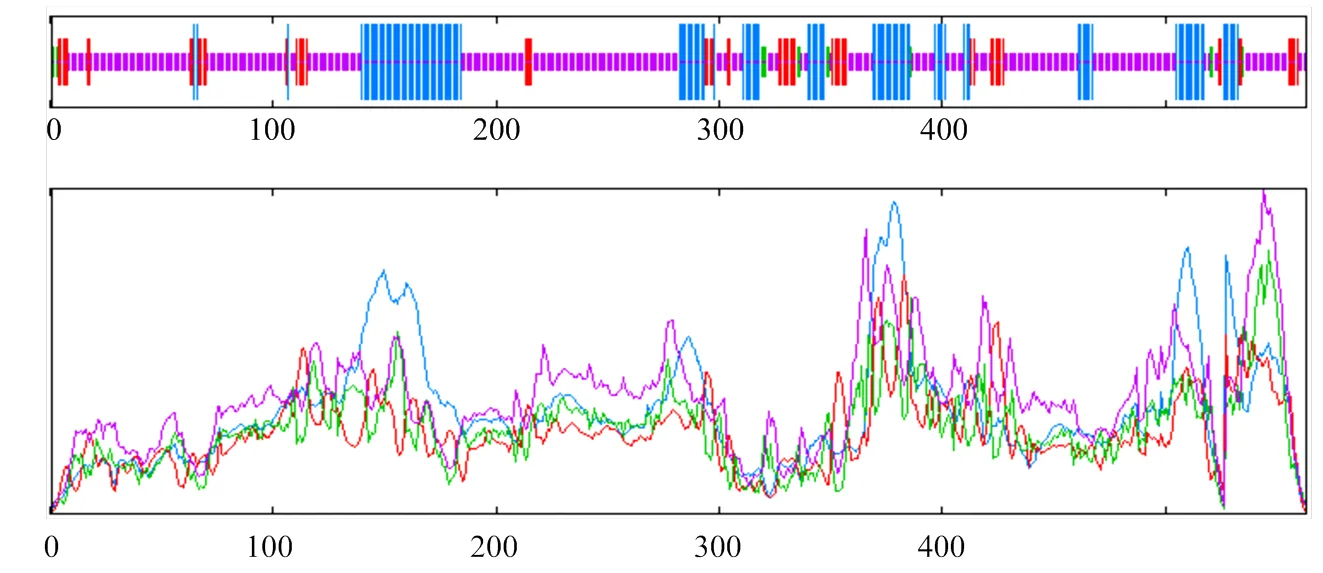
红色线条表示延伸链;紫色线条表示无规则卷曲;蓝色线条表示α-螺旋
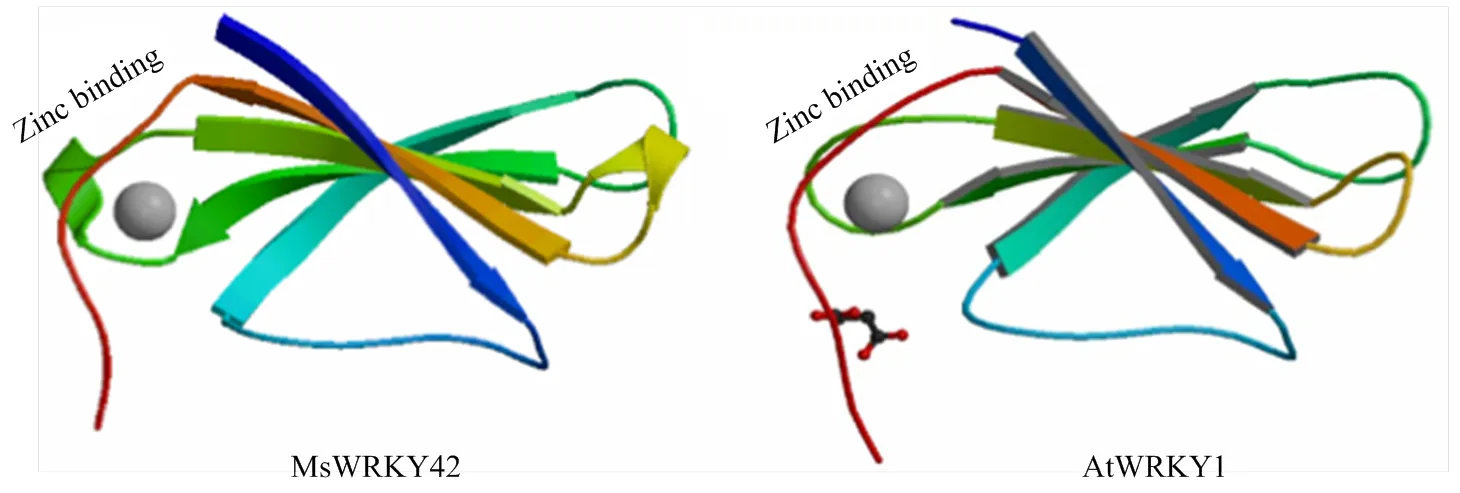
图5 MsWRKY42蛋白三级结构的预测

表1 PlantCARE 启动子预测结果
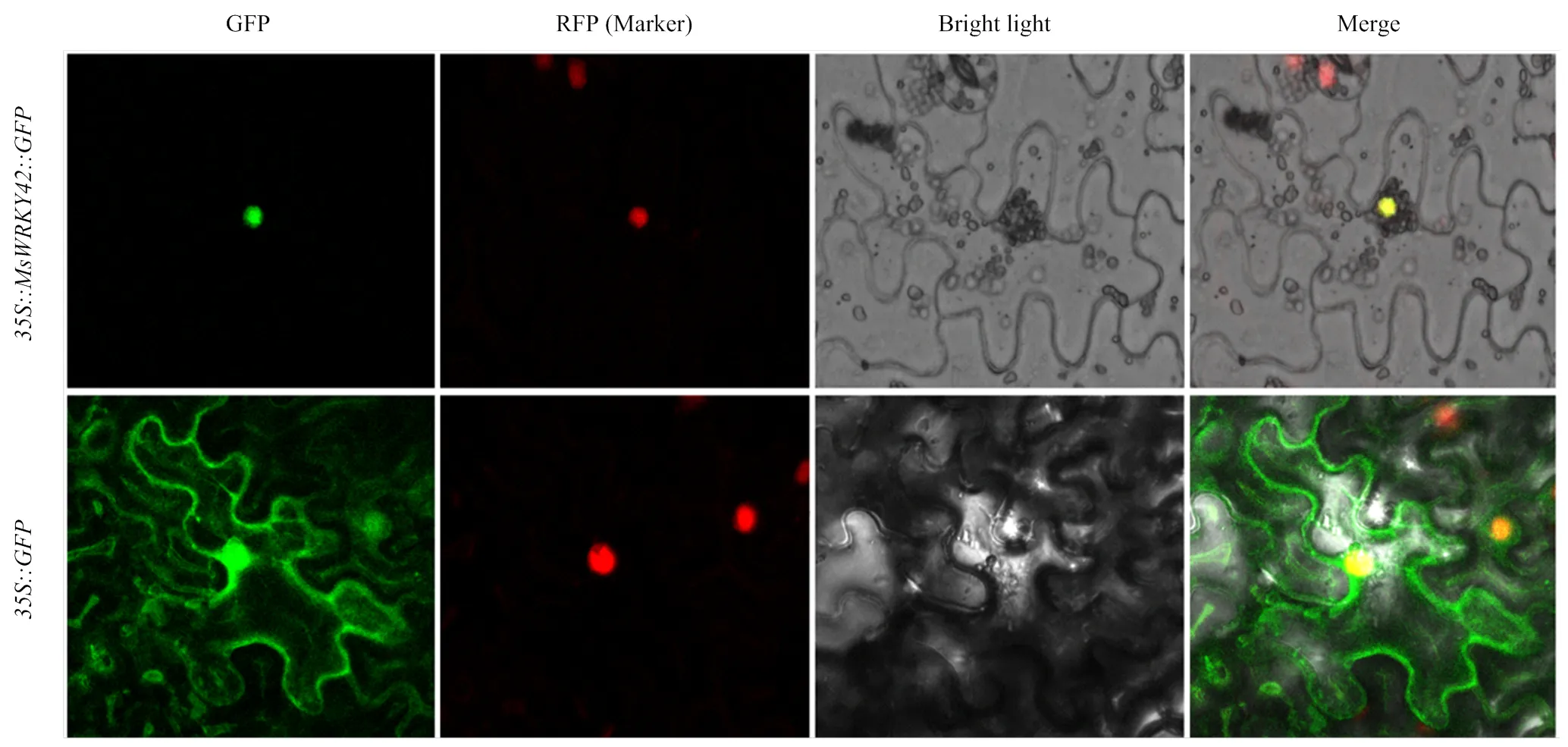
图片采用绿色荧光、明场、绿色荧光和明场叠加3个视野拍摄。35S::GFP:携带空载pCAMBIA1300-GFP的农杆菌菌株。35S::MsWRKY42::GFP:携带重组载体pCAMBIA1300-MsWRKY42-GFP的农杆菌菌株。比例尺=25 μm
不同字母表示在P<0.05水平差异显著。下同
2.6 MsWRKY42受多种逆境胁迫诱导
通过对材料进行非生物胁迫研究(图8),在300 mmol·L-1NaCl处理下,在2 h和6 h出现峰值,在6 h之后逐渐降低,但处理48 h后表达量仍显著高于对照(0 h);用15%的PEG模拟干旱胁迫,的表达量在2 h内迅速上调,随后下降,在12和48 h时表达量与对照差异不显著;4℃低温处理下,表达量在2 h时被快速诱导,在4 h急剧下降,随后又逐渐上升;40℃高温处理下,表达量整体趋势是升高的,且到处理的48 h时仍保持上升趋势;缺磷处理下,在4 h时的表达量最高,为对照表达量的6.2倍,随后表达逐渐降低;0.1×10-3mol·L-1ABA处理下,表达量在2 h时剧增,随后表达丰度下降,整个处理过程中表达量始终显著高于对照。
2.7 MsWRKY42蛋白结合活性分析
为了明确MsWRKY42蛋白与W-box的结合活性,对其进行了体外结合活性分析。结果显示,抑制酵母报告载体pHISi和pHISi-W-box本底表达的3-AT浓度为150 mmol·L-1(图9-A)。将不同的酵母转化子点涂在含有150 mmol·L-13-AT的培养基上,结果显示,只有pGADT7-42+pHISi-W-box的酵母转化子能够生长,其他对照均没有生长(图9-B)。说明报告基因HIS在MsWRKY42的酵母中表达,证明MsWRKY42能够与W-box顺式作用元件特异性结合。
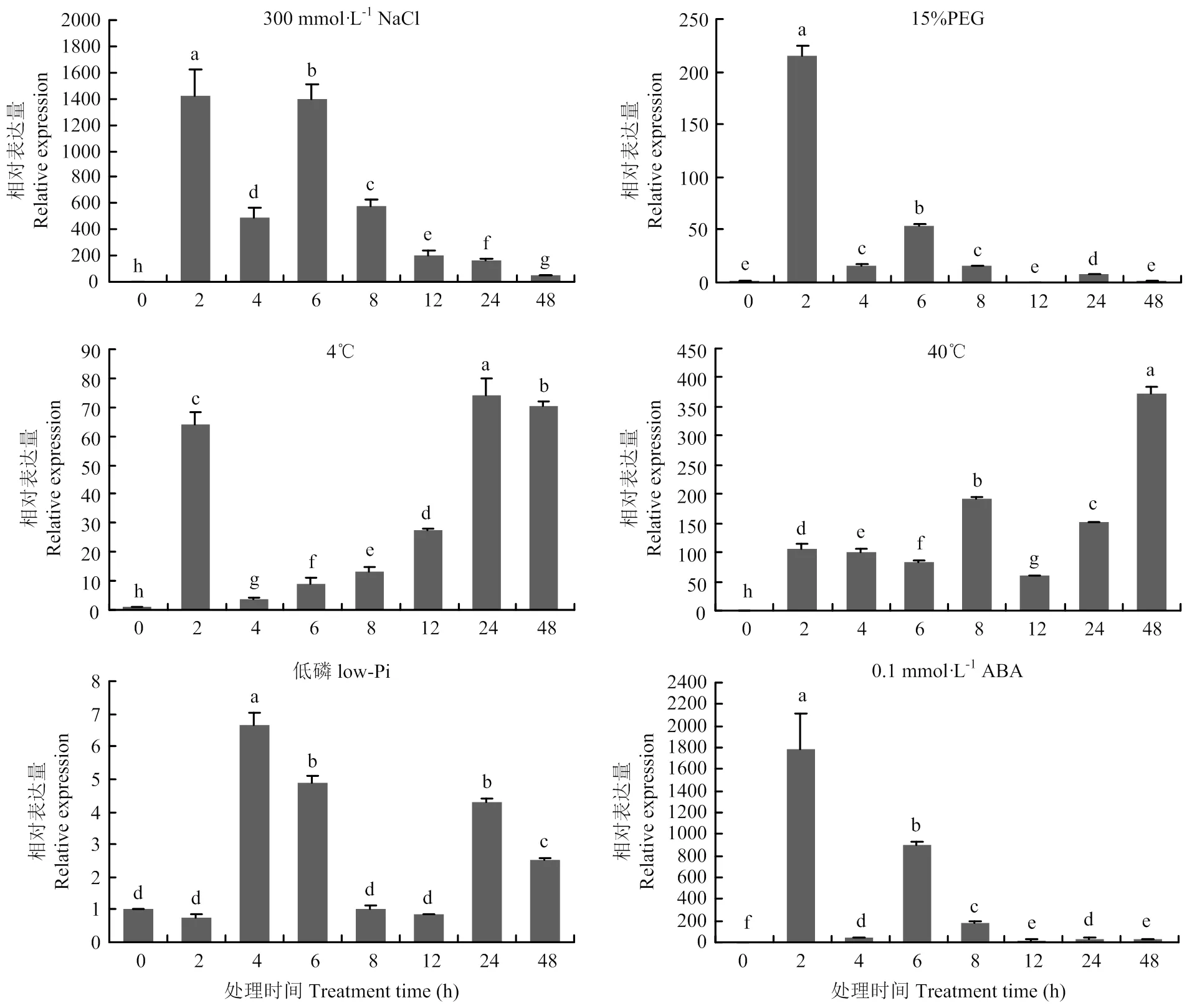
图8 不同胁迫下MsWRKY42的表达模式
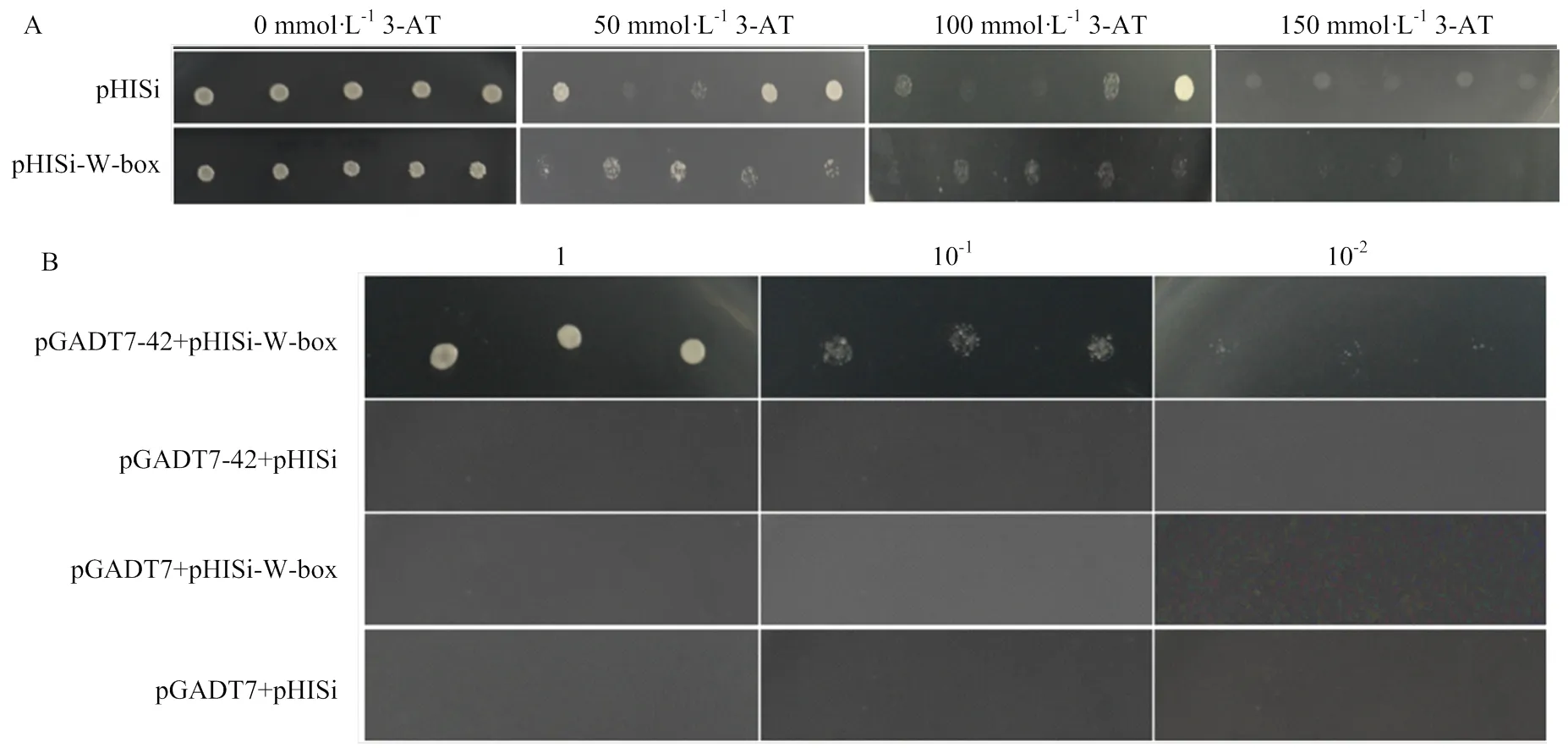
A:3-AT浓度的筛选;B:稀释不同倍数的4种酵母转化子在SD/-His-Leu-ura培养基上的生长状态
3 讨论
3.1 MsWRKY42蛋白结构与功能的关系
本研究从紫花苜蓿中克隆得到的cDNA序列,该基因编码的蛋白可能为不稳定蛋白。系统进化树聚类结果表明属于WRKY家族Ⅱb亚类(图3),该分支多个基因已证实与植物的非生物胁迫应答相关,例如与、互作关联,对干旱、冷、ABA等多种非生物逆境应答相关[19];能够通过ABA转导途径参与菊花()对干旱胁迫的响应过程[20]。因此,推测也可能参与了紫花苜蓿的非生物胁迫响应。本研究对MsWRKY42蛋白进行三级结构预测发现,该蛋白是由5条反平行β链和锌结合位点组成的球状结构,与AtWRKY1蛋白结构相似(图5)。Duan等[21]研究发现转录因子与DNA的结合能力是由β2链与β3链之间的β折叠区域决定的,推测具有与相似的与DNA的结合方式。亚细胞定位结果显示MsWRKY42蛋白定位在细胞核上,这与生物信息学预测结果相同,同时与拟南芥[16]报道相同,也与其作为转录因子的转录调节功能一致。
W-box大多存在于植物WRKY基因的启动子中,尤其是与胁迫相关的WRKY基因,其中,W-box的数量、排列方式等对结合活性都有很大影响。WRKY家族与顺式作用元件W-box的结合已有许多研究,AtWRKY57[8]、AtWRKY6[22]等转录因子均与W-box特异性结合,从而调控相关基因的表达,本研究中与W-box能够特异性结合,这些结果不仅表明W-box在WRKY转录因子发挥其生物学功能中起重要且广泛的作用,而且,推测与拟南芥中的、存在相似的调控模式。
3.2 非生物胁迫对MsWRKY42的影响
通过PlantCARE在线网站对启动子内顺式作用元件进行预测,包括2个胁迫响应元件ARE、5个脱落酸(ABA)响应元件ABRE、2个茉莉酸甲酯响应元件TGACG-motif和2个CGTCA-motif,因此,推测可能通过ABA信号途径参与多种胁迫反应。基于此,研究对多种逆境下基因的表达进行了分析。
PEG是一种高分子渗透剂,能使植物细胞和组织处于类似于干旱胁迫的状态中[23]。WRKY 家族基因可通过ABA信号转导途径行使功能[24]。拟南芥中、和三者能够协同互作,与ABA信号途径基因和启动子中的W-box结合,单独或协同调控这些基因的表达,进而影响拟南芥的耐旱和耐盐性[25]。本研究中,在干旱、ABA诱导下的表达量在2 h处均显著上调,推测可能通过ABA信号通路参与干旱胁迫反应。Gruber等[26]研究显示,盐胁迫下WRKY转录因子家族被显著诱导,说明其广泛参与到植物的耐盐机制中。本研究中,盐胁迫下的表达量显著增高,与GRUBER等[26]研究结果一致。拟南芥中的、和能与一些热激转录因子的W-box结合从而参与调控高温胁迫反应[27]。本研究结果显示,在高温条件下,的表达量在2 h升高后没有太大的变化,但在48 h时有一个显著的升高。资料表明,WRKY能够通过不同的信号转导途径参与植物的低温胁迫应答。例如花粉中特异性表达的能负调控CBF介导的低温应答途径[11]。在低温下被诱导表达的,通过激活下游基因、、和的表达增强植物的耐寒性[28]。本研究中低温也显著诱导的增强表达。以上的结果表明,可能参与了多个逆境响应过程。
土壤有效磷的供应情况以及植物对磷的吸收能力是植物生长发育的关键制约因素[29]。以往的研究发现可以与磷转运蛋白PHT1;1启动子区域中的两个W-box结合,上调表达,从而参与对低磷胁迫的反应[30]。本研究对启动子区的序列分析发现,该启动子中含有W-box,可能其他的WRKY转录因子也能够调控的表达,暗示WRKY42在抗逆调控中不是简单的线性关系,而是处于复杂但相互平衡的调节网络中。本研究中在低磷条件下迅速被诱导,随后下降,在24 h开始上升,可能是因为WRKY蛋白和自身启动子中的W-box顺式作用元件相结合从而调控自身表达,也可能在此过程中存在其他转录因子的竞争,抑制对自身的调控。
从本研究的结果发现,紫花苜蓿的对多种逆境胁迫均有响应,且基因诱导表达的丰度较高,暗示该基因可能参与了多种非生物逆境,包括磷营养胁迫的调控。前人对其他物种的研究中发现,通过调节和的表达调控低磷逆境[16];通过ABA信号途径来提高野生草莓()对盐和干旱的抗性[31]。但像这样,在同一物种中参与多个逆境响应的还未见报道。虽然非生物胁迫下紫花苜蓿中的生物学功能以及其调控机制还需要进一步验证,但本研究结果加深了对参与植物逆境应答调控的认识,为紫花苜蓿转录因子调控非生物胁迫分子机制研究提供一定的依据。
4 结论
从紫花苜蓿中克隆获得一个WRKY转录因子基因,命名为,该序列ORF为1 692 bp,编码563个氨基酸,为不稳定蛋白,该蛋白具有1个WRKY保守结构域和C2H2锌指结构域,属于WRKY转录因子家族的Ⅱb亚类,位于细胞核,可以与W-box特异性结合;在紫花苜蓿具有组织特异性,推测其在紫花苜蓿适应多种非生物胁迫过程中起重要作用。
[1] 张立全, 张凤英, 哈斯阿古拉. 紫花苜蓿耐盐性研究进展. 草业学报, 2012, 21(6): 296-305.
ZHANG L Q, ZHANG F Y, HASI A G L. Research progress on alfalfa salt tolerance., 2012, 21(6): 296-305. (in Chinese)
[2] HAN X, KUMAR D, CHEN H, WU S, KIM J Y. Transcription factor-mediated cell-to-cell signalling in plants., 2014, 65(7): 1737-1749.
[3] BIRKENBIHL R P, LIU S, SOMSSICH I E. Transcriptional events defining plant immune responses., 2017, 38: 1-9.
[4] JIANG J, MA S, YE N, JIANG M, CAO J, ZHANG J. WRKY transcription factors in plant responses to stresses., 2017, 59(2): 86-101.
[5] PHUKAN U J, JEENA G S, SHUKLA R K. WRKY transcription factors: Molecular regulation and stress responses in plants., 2016, 7: 760.
[6] CARVALHO R F, CAMPOS M L, AZEVEDO R A. Salt stress in plants., 2013, 53(12): 920-929.
[7] QIAO Z, LI C L, ZHANG W. WRKY1 regulates stomatal movement in drought-stressed., 2016, 91: 53-65.
[8] JIANG Y, LIANG G, YU D. Activated expression ofconfers drought tolerance in, 2012, 5(6): 1375-1388.
[9] LI H, GAO Y, XU H, DAI Y, DENG D, CHEN J., a WRKY maize transcription factor conferring enhanced salt stress tolerances in., 2013, 70(3): 207-216.
[10] YANG G Y, ZHANG W H, SUN Y D, ZHANG T T, HU D, ZHAI M Z. Two novel WRKY genes from,and, are involved in abscisic acid-dependent stress responses., 2017, 61(4): 611-621.
[11] ZOU C, JIANG W, YU D. Male gametophyte-specifictranscription factor mediates cold sensitivity of mature pollen in., 2010, 61(14): 3901-3914.
[12] WANG F, HOU X, TANG J, WANG Z, WANG S, JIANG F, LI Y. A novel cold-inducible gene from Pakchoi (),, enhances the cold, salt and dehydration stress tolerance in transgenic tobacco.,2012, 39(4): 4553-4564.
[13] WU X, SHIROTO Y, KISHITANI S, ITO Y, TORIYAMA K. Enhanced heat and drought tolerance in transgenic rice seedlings overexpressingunder the control ofpromoter., 2009, 28(1): 21-30.
[14] DEVAIAH B N, KARTHIKEYAN A S, RAGHOTHAMA K G.transcription factor is a modulator of phosphate acquisition and root development in, 2007, 143(4): 1789-1801.
[15] CHEN Y F, LI L Q, XU Q, KONG Y H, WANG H, WU W H. The WRKY6 transcription factor modulatesexpression in response to low PI stress in., 2009, 21(11): 3554-3566.
[16] SU T, XU Q, ZHANG F C, CHEN Y, LI L Q, WU W H, CHEN Y F.modulates phosphate homeostasis through regulating phosphate translocation and acquisition in, 2015, 167(4): 1579-1591.
[17] DAI X, WANG Y, ZHANG W H., a WRKY transcription factor, modulates tolerance to phosphate starvation in rice.,2017, 67(3): 947-960.
[18] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod., 2001, 25(4): 402-408.
[19] 范晓江, 郭小华, 牛芳芳, 杨博, 江元清. 拟南芥转录因子的转录活性与互作蛋白分析. 西北植物学报, 2018, 38(1): 1-8.
FAN X J, GUO X H, NIU F F, YANG B, JIANG Y Q. Exploring the transcriptional activity and interacting proteins oftranscription factors in., 2018, 38(1): 1-8. (in Chinese)
[20] FAN Q, SONG A, JIANG J, ZHANG T, SUN H, WANG Y, CHEN S, CHEN F.enhances the dehydration tolerance of chrysanthemum through the regulation of ABA-associated genes., 2016, 11: e0150572.
[21] DUAN M R, NAN J, LIANG Y H, MAO P, LU L, LI L, WEI C, LAI L, LI Y, SU X D. DNA binding mechanism revealed by high resolution crystal structure ofWRKY1 protein., 2007, 35(4): 1145-1154.
[22] CIOLKOWSKI I, WANKE D, BIRKENBIHL R P. Studies on DNA- binding selectivity of WRKY transcription factors lend structural clues into WRKY-domain function., 2008, 68(1/2): 81-92.
[23] ATTREE S M, FOWKE L C. Embryogeny of gymnosperms: Advances in synthetic seed technology of conifers.,1993, 35(1): 1-35.
[24] DE ZELICOURT A, COLCOMBET J, HIRT H. The role of MAPK modules and ABA during abiotic stress signaling,2016, 21: 677-685
[25] LIU Z Q, YAN L, WU Z, MEI C, LU K, YU Y T, LIANG S, ZHANG X F, WANG X F, ZHANG D P. Cooperation of three WRKY-domain transcription factors,, andin repressing two ABA-responsive genesandin, 2012, 18(63): 6371-6392.
[26] GRUBER V, BLANCHET S, DIET A, ZANAF O, BOUALEM A, KAKAR K, ALUNNI B, UDVARDI M, FRUGIER F, CRESPI M. Identification of transcription factors involved in root apex responses to salt stress in., 2009, 281(1): 55-66.
[27] LI S, FU Q, CHEN L, HUANG W, YU D.,andcoordinate induction of plant thermotolerance., 2011, 233: 1237-1252.
[28] KIM C Y, VO K, NGUYEN C D, JEONG D H, LEE S K, KUMAR M, KIM S R, PARK S H, KIM J J, JEON J S. Functional analysis of a cold-responsive rice WRKY gene,1., 2016, 10(1): 13-23.
[29] KANT S, PENG M S, ROTHSTEIN S J. Genetic regulation by NLA and microRNA827 for maintaining nitrate-dependent Phosphate homeostasis in., 2011, 7(3): 1-11.
[30] WANG H, XU Q, KONG Y H, CHEN Y, DUAN J Y, WU W H, CHEN Y F.transcription factor activatesexpression in response to phosphate starvation., 2014, 164(4): 2020-2029.
[31] WEI W, CUI M Y, YANG H, GAO K, XIE Y G, JIANG Y, FENG J Y. Ectopic expression of, a WRKY transcription factor from the T diploid woodland strawberry (), enhances resistance to powdery mildew, improves osmotic stress resistance, and increases abscisic acid sensitivity in., 2018, 275: 60-74.
Isolation, Identification, and Response to Abiotic Stress ofgene fromL.
LIU JiaoJiao1, WANG XueMin2, MA Lin2, CUI MiaoMiao2, CAO XiaoYu2, ZHAO Wei1
(1College of Agriculture, Henan University of science and technology/College of Tree Peony, Luoyang 471023, Henan;2Institute of Animal Sciences, Chinese Academyof Agricultural Sciences, Beijing 100193)
【】The WRKY gene family in plants encodes a large group of transcription factors (TFs) that play essential roles in diverse stress responses, developmental and physiological processes. It laid a foundation for further research on the role of WRKY transcription factor in alfalfa stress-resistant molecular regulation by analyzing the role of MsWRKY42 transcription factor in alfalfa. 【】sequence was obtained by homologous alignment and sequence characteristics of it were analyzed by online bioinformatics tools. The phylogenetic tree ofandgenes was constructed by MEGA-X. The putative cis-elements in promoter region ofwas analyzed by PlantCARE. The real-time quantitative PCR (qRT-PCR) was used to analyze the expression pattern ofMsWRKY42 in different organs and its response to abiotic including NaCl (0.3 mol·L), PEG(15%), 4℃, 40℃, low phosphorus and ABA (0.1×10-3mol·L-1). The fusion expression vector of pCAMBIA1300-was constructed and delivered intobymediated method to determine the subcellular localization of WRKY protein. The yeast one-hybrid technique was used to analyze the binding activity of MsWRKY42 and the cis-acting element W-box.【】The gene contained a 1 692 bp open reading frame encoding 563 amino acids. Multiple sequence alignment and phylogenetic tree analysis results indicated that the protein is a member of the IIb sub-group WRKY family and contains a WRKY conserved domain and a C2H2zinc finger motif. It has the highest similarity tofamily, therefore, named as. A variety of cis-acting elements were identified in the promoter region of, including regulatory elements such as stress response, hormone response, and diurnal regulation. Real-Time PCR analysis showed thathad the highest expression in roots and leaves. The expression ofwas up-regulated by NaCl, PEG, low temperature, high temperature, low phosphorus and ABA treatments. Subcellular localization indicated thatwas mainly located on the nucleus in plant cells. The results of the binding activity analysis showed that MsWRKY42 was able to specifically bind to W-box.【】is a typical transcription factor, which can specifically bind to cis-acting elements, and the protein is localized in the nucleus. The gene was expressed in different tissues of alfalfa, and was induced by NaCl, PEG, high temperature, low phosphorus and ABA treatment. It is speculated that thegene may play a role in response to multiple stress defense responses as a WRKY transcription factor.
alfalfa; WRKY transcription factor; abiotic stress; subcellular localization; binding activity analysis

10.3864/j.issn.0578-1752.2020.17.004
2019-10-30;
2020-02-16
国家自然科学基金面上项目(31872410)、现代农业产业技术体系牧草产业体系岗位科学家(CARS34)、河南科技大学学科提升计划(13660001)
刘佼佼,E-mail:1192771534@qq.com。通信作者赵威,E-mail:zhaowei1@haust.edu.cn
(责任编辑 李莉)
