肺纤毛黏液结节性乳头状肿瘤的临床病理特征
2020-09-11裴笑月李晓慧
裴笑月, 冯 璐, 胡 波, 李晓慧
1. 大连大学附属新华医院病理科,大连 116021 2. 大连医科大学附属第一医院病理科,大连 116011
肺纤毛黏液结节性乳头状肿瘤(ciliated muconodular papillary tumor,CMPT)是一种罕见的肺外周结节,2002年由Ishikawa[1]首次报道。本病好发于中老年人,年龄19~78岁,中位年龄62岁,男女发病率无差别,可能与种族易感性或基因差别有关[2]。该病临床多无明显症状,常在体检时无意中被发现。CT示病变位于肺外周小的实性或部分为实性的结节,轮廓不规则,直径0.5~1.5 cm,无清晰边界,影像学及冰冻切片分析易误诊为肺腺癌。目前认为CMPT是一种良性肿瘤,呈惰性的临床过程,局部手术切除即可。现收集8例CMPT患者临床资料,分析其病理组织学、免疫表型和分子特征,以提高确诊率。
1 资料与方法
1.1 一般资料 收集2017年1月至2018年12月大连大学附属新华医院及大连医科大学附属第一医院收治的8例CMPT病例资料,回顾分析、总结临床病理资料、免疫表型和分子病理结果,在患者知情同意情况下通过电话咨询获取随访资料。本研究经过大连大学附属新华医院伦理委员会批准(XH2020A001),所有患者均知情且签署知情同意书。
1.2 纳入与排除标准 纳入标准:2名副高级职称以上病理医师按照2015版肺肿瘤病理学和遗传学分类标准,通过观察术后病理组织像、结合免疫组化(IHC)及特殊染色结果,诊断为CMPT的病例。排除标准:因组织固定问题导致的固缩、伴发其他器官恶性肿瘤及因其他疾病死亡的病例。
1.3 IHC 采用EnVision 2步法,所有一抗包括甲状腺转录因子(thyroid transcription factor-1,TTF-1)、NapsinA、细胞角蛋白7(cytokeratin 7,CK7)、CK5/6、P40、P63、Ki67、表皮生长因子受体(epidermal growth factor receptor,EGFR),均购自福州迈新生物技术有限公司。染色结果判定以DAB显色,棕黄色为阳性表达,其中NapsinA、CK7、CK5/6、EGFR定位在胞质,其余定位于胞核。
1.4 EGFR基因突变检测 6例标本进行EGFR基因突变检测,余2例因肿瘤组织过少未检测。切取5 μm厚肿瘤组织7片(肿瘤细胞含量20%以上)置于1.5 mL离心管中,采用石蜡样本DNA提取试剂盒(ADx-FF01,厦门艾德生物医药公司,中国)提取基因组DNA,实验步骤按试剂盒说明书进行。通过实时定量PCR(ARMS法),检测EGFR基因18~21号外显子21种体细胞突变,每个样本均设立阳性质控品和阴性对照。采用AmoyDx基因检测试剂盒(厦门艾德生物医药公司,中国),检测设备为ABI 7500荧光定量PCR仪(ABI,美国),按试剂盒证明书中步骤操作。PCR反应条件:95℃预变性5 min;95℃变性25 s,64℃退火20 s,72℃延伸20 s,分2个阶段进行,共46个循环;最后阶段60℃时收集FAM信号,执行实时PCR。
1.5 特殊染色 8例病例肿瘤组织均进行黏液染色和弹力纤维染色。黏液染色采用阿利新蓝-过碘酸雪夫(AB-PAS)法,弹力纤维染色采用醛品红法。所需试剂盒均购自福州迈新生物技术有限公司,染色步骤按试剂盒说明进行。显微镜下观察,黏液染色以细胞质出现淡蓝色判断为阳性,弹力纤维染色以肿瘤组织内出现紫色判断为阳性。
2 结 果
2.1 人口学特征及一般资料分析 结果(表1)显示:男1例,女7例,男女比例为1∶7,年龄54~75岁,平均年龄63.5岁。患者均体检发现肺结节,2例有轻度咳嗽,其余6例无明显症状,2例伴肺腺癌,2例表现为多发结节。所有病例均行肺楔形切除加淋巴结清扫,标本送检病理检查。病例2的CT结果(图1)示肺外周实性或部分实性结节,直径0.5~2.5 cm,无清晰边界,初步诊断为肺腺癌。
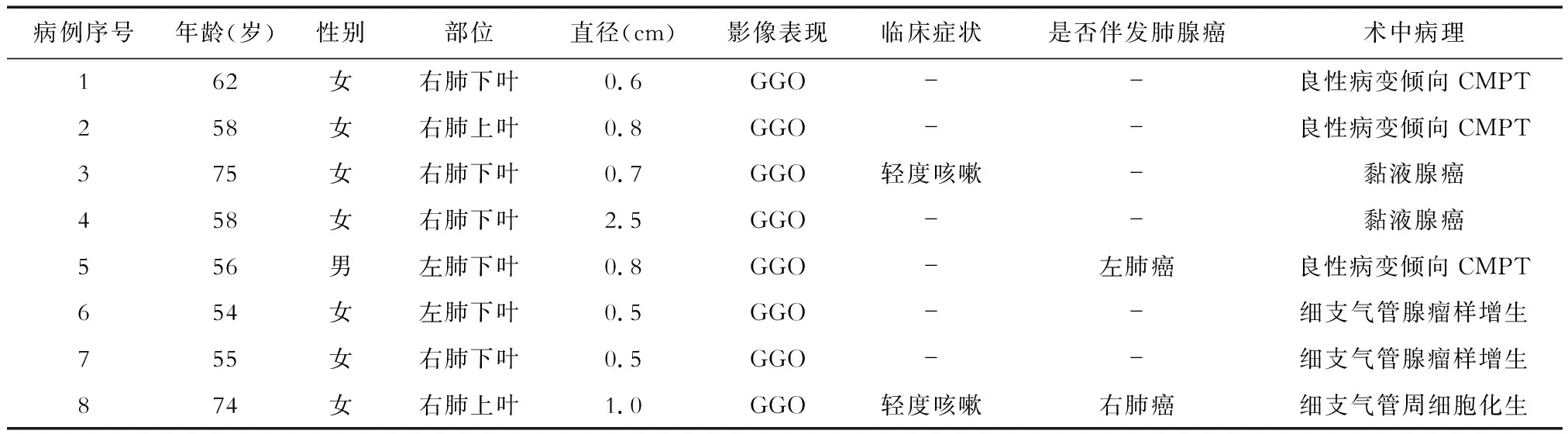
表1 8例CMPT患者一般资料及临床病理特征
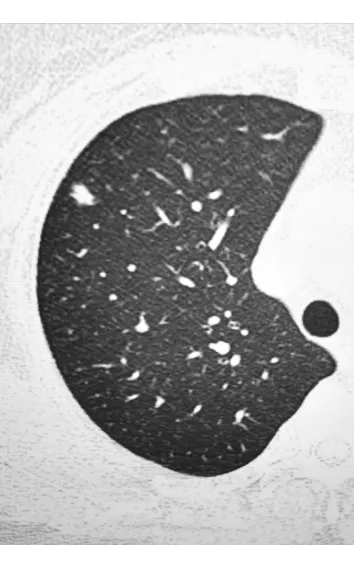
图1 病例2入院时肺部CT影像
2.2 术中病理结果 结果(表1)显示:8例标本均为楔形肺组织,切面可触及灰白色结节;直径0.5~2.5 cm,界限不清;5例紧邻胸膜,2例为多发结节。术中冰冻诊断良性病变倾向CMPT 3例,黏液腺癌2例,细支气管腺瘤样增生2例,细支气管周细胞化生1例。
2.3 病理组织学分析 结果(图2)显示:CMPT样本在镜下可见3种肿瘤细胞成分,即纤毛细胞、黏液细胞、基底细胞。3种肿瘤细胞比例不等,可形成腺样结构、乳头样结构。一般纤毛柱状细胞被覆腺样/乳头样结构表面,基底细胞位于腺样/乳头样结构外围,黏液细胞穿插在这2种细胞之间,形成小巢状。肺泡腔扩张,充满黏液,黏液池内可见乳头甚至是微乳头漂浮其中。肿瘤细胞异型性小,形态温和,未见核分裂象及肿瘤性坏死。间质可见淋巴细胞、浆细胞浸润。
2.4 免疫表型分析 结果(图3)显示:8例病例中纤毛柱状细胞和黏液细胞均显示CK7阳性(图3A),TTF-1弱阳性(图3B);基底细胞P63、P40阳性(图3C),CK5/6阳性;Ki67阳性指数<2%;EGFR弱阳性;3例NapsinA呈弱阳性(图3D),其余5例均阴性。
2.5 EGFR检测结果 结果(表2)显示:6例中有1例(例5)检测到EGFR19号外显子缺失(exon19 19-Del),占17%(1/6)。
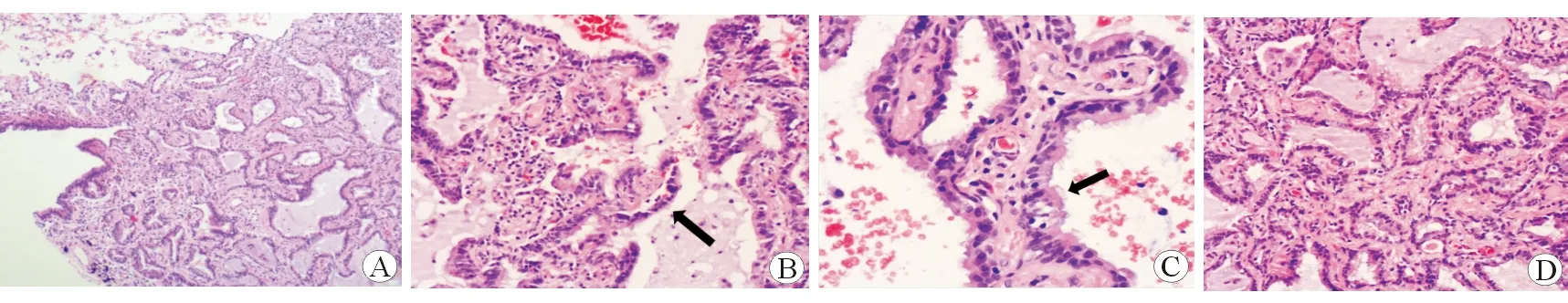
图2 CMPT典型组织H-E染色结果

图3 EnVision 2步法检测CK7、TTF-1、基底细胞P40及 NapsinA结果
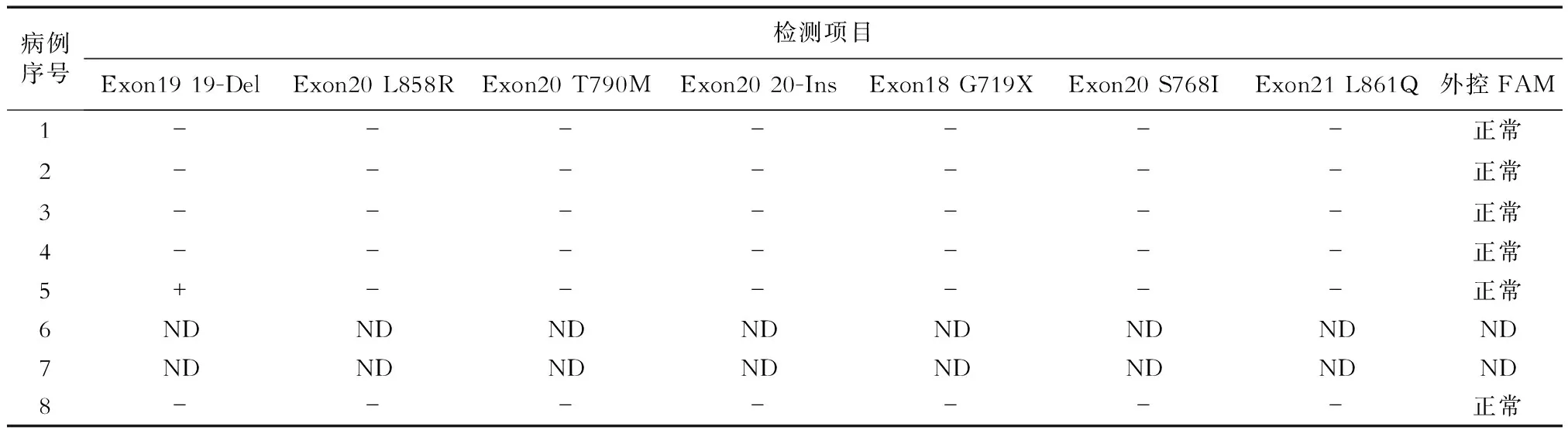
表2 8例CMPT患者EGFR检测结果
2.6 特殊染色结果 8例病例黏液染色AB-PAS均示阳性,典型病例染色结果见图4A。弹力纤维染色均显示肺泡弹性框架结构缺失或破坏,典型病例染色结果见图4B。
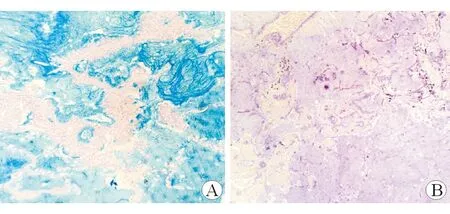
图4 CMPT典型病例特殊染色结果
2.7 治疗与预后 全部病例均行手术治疗,其中2例行全肺叶切除术,6例行楔形肺组织切除。所有病例术后随访(<24个月)无复发和转移。
3 讨 论
肺纤毛黏液结节性乳头状肿瘤是一种新型低级别肺肿瘤,临床呈惰性过程。由于目前文献报道较少,对其认识不够,临床往往与黏液腺癌混淆。据文献[3-10]报道,CMPT并无特殊临床症状,男女发病率相同,无好发部位,所有肺叶都可发生,CT结果多示孤立的肺外周结节,常在体检中发现。本研究8例患者,女性多于男性(7∶1),年龄均为中老年人,发生于右肺的多于左肺(6∶2),其中有4例发生于右肺下叶。2例伴发肺腺癌,2例有轻度咳嗽症状。
病理组织学上,CMPT多表现为一个界限相对清楚的结节,大小不等(1 cm左右)。镜下肿瘤可见腺管样结构、乳头样或微乳头样结构及不连续的附壁样结构,肿瘤富黏液,微乳头可漂浮于黏液湖中,这点与黏液腺癌特别相似。CMPT主要由3种肿瘤细胞构成,即纤毛细胞、黏液细胞和基底细胞。3种肿瘤细胞成分比例不一,相互混合交叉。表面多覆盖黏液细胞和纤毛细胞,外周可见单层连续的基底细胞,这里强调连续性,因为腺癌多呈现无或不连续的基底细胞。所有肿瘤细胞形态温和,无明显异型性,少见核分裂象及坏死。间质可见厚壁血管、小气道及淋巴细胞浸润。这些表现以纤毛细胞最具特点,正确地认识纤毛细胞可以提高该病的诊断率,甚至是术中冰冻切片检查的诊断率。本研究8例病例组织学表现符合上述特征,其中有3例在术中冰冻切片检查中识别出纤毛细胞而作出良性病变、倾向CMPT的诊断,可见正确识别纤毛细胞是避免术中冰冻切片检查误诊的关键。
免疫表型及特殊染色方面,CMPT和肺腺癌也有一定的交叉。CMPT的纤毛柱状细胞和黏液细胞均表达CK7和TTF-1;NapsinA表达强弱不等,这与腺癌癌细胞表达一致。区别就在基底细胞上,CMPT的基底细胞连续性表达P63、P40及CK5/6,而肺腺癌几乎是缺失或不连续的表达[15]。CMPT增殖指数Ki67一般低于2%,呈现良性肿瘤的特点,要明显低于肺腺癌的增殖指数,特别是浸润性腺癌。特殊染色显示,黏液染色AB-PAS黏液细胞及黏液湖呈阳性淡蓝色染色,弹力纤维染色显示肺泡弹性框架结构缺失或破坏。这些指标均说明CMPT是一种真正的良性肿瘤,而不是反应性增生或错构瘤性病变。
分子特征上,本研究中患者肿瘤组织EGFR均呈弱阳性表达,1例(17%)EGFR19号外显子缺失突变。多位学者[2,10-11]研究报道,CMPT基因突变频率依次为BRAF(38%)、KRAS(24%)、EGFR(19%)和HRAS(5%),其中EGFR的突变率与本研究相符,说明EGFR缺失是CMPT的一个常见驱动基因改变。同时本研究发现2例病例伴有肺腺癌病史,Udo等[12]认为,部分CMPT是黏液腺癌的癌前病变,也有文献[13]报道CMPT常伴癌症病史。EGFR缺失或插入是肺腺癌常见的突变[14],突变率高达50%,远高于本研究中的突变率。并且,本研究仅发现CMPT存在EGFR第19号外显子的缺失,这种缺失虽然在肺腺癌中也存在,但并不是肺腺癌的独立驱动基因。此外,EGFR存在21种体细胞突变,在CMPT中的突变类型是否与肺腺癌一致,以及是否伴随其他基因及位点的改变,值得进一步探讨。可以肯定的是,CMPT是一种肿瘤性病变,但是否与肺腺癌为同类,还有待进一步扩大样本明确。
在鉴别诊断方面,CMPT主要与肺腺癌、细支气管周细胞化生、伴Ewing肉瘤断裂区域1基因(EWSR1)环磷腺苷效应元件结合蛋白1(CREB1)融合的原发性肺黏液样肉瘤(primary pulmonary myxoid sarcoma,PPMS)及微囊性纤维黏液瘤相鉴别。(1)CMPT与肺腺癌:两者均好发于肺外周且缓慢生长,在影像学上难以区分。组织学均可见腺样、乳头样、微乳头样结构,富含黏液区与黏液腺癌易混淆。在细胞组成上,肺腺癌缺乏纤毛柱状细胞及连续的基底细胞,而CMPT均具备。染色好的切片可直接辨认出基底细胞,如有必要,可以通过IHC检测3个基底细胞标志物(P63、P40及CK5/6)加以明确。此外,肺腺癌多见不典型性增生及核分裂象,而CMPT缺乏。肺腺癌,特别是黏液腺癌常表达肝细胞核因子4a(HNF4a)[15],这对两者鉴别有一定的参考价值。(2)细支气管周细胞化生:发病部位多见于细支气管附近或不成对肺动脉旁,影像学上多表现为多灶性结节,缺乏黏液细胞化生,但可表达MUC5[2],不存在EGFR等基因突变。而CMPT常表现为孤立性结节,可见黏液细胞,不表达MUC5,存在EGFR、BRAF基因突变。(3)伴EWSR1-CREB1融合的PPMS:该肿瘤由Nicholson等于1999年首次报道,组织学上肿瘤呈小叶状增生,在丰富黏液样基质背景中形成网状或条索状结构,形态学与发生在软组织的骨外黏液样软骨肉瘤相似[16]。大体上瘤体呈结节状,边界清楚,切面灰白或灰黄色,胶冻样。PPMS一致性表达波形蛋白,不表达上皮、肌上皮、血管及神经源性标志物,仅个别病例偶尔局灶表达S-100蛋白、SMA和EMA,表明PPMS是一种独特的肺间叶源性肿瘤。PPMS与CMPT在组织学上有交叉,通过仔细辨别组织学和借助IHC可将两者鉴别。(4)微囊性纤维黏液瘤[17]:该肿瘤发生在肺或支气管内相对罕见,具有特征性的微囊结构,阿辛蓝染色阳性,由于其温和的细胞形态学和良性的临床过程,手术切除标本与恶性肿瘤鉴别相对容易,但在小活检时,与CMPT鉴别困难。微囊被覆的梭形细胞形态学类似血管内皮细胞,但不表达血管内皮标志物;部分微囊腔隙形态与肺泡性腺瘤类似,但不表达任何上皮和肺泡细胞标志物,因此提示微囊腔隙并非与真正的脉管或肺泡分化相关。临床中,发生在肺的微囊性纤维黏液瘤,首先要排除具有黏液样特征的软组织肿瘤转移到肺的可能性。因此,对于CMPT的诊断,结合临床表现及影像学结果尤为重要。
综上所述,CMPT是一种罕见的良性肿瘤,易误诊为黏液腺癌,无特异性临床症状,但通过正确识别纤毛细胞及基底细胞的连续性表达,可降低误诊率。
