原发灶手术对初诊 Ⅳ 期三阳性乳腺癌患者的预后分析:基于SEER数据库的回顾性研究
2020-09-11杜俊娴罗忆泓倪小建
杜俊娴, 陈 枞, 罗忆泓, 徐 静, 倪小建, 朱 玮
复旦大学附属中山医院普通外科,上海 200032
上海部分统计数据显示,乳腺癌新发病例数位居女性新发恶性肿瘤之首[1]。约有5%~8%的乳腺癌患者初诊时即发生远处转移[2],系统治疗是初诊 Ⅳ 期乳腺癌患者的主要治疗方法。美国癌症协会统计数据显示,2016年在美国约56%的Ⅳ期乳腺癌患者进行了单纯放疗和/或化疗,10%的患者实施了全乳切除术±系统治疗(ST),6%的患者实施了保乳术±ST[3]。目前关于原发灶手术(primary lesion resection, PLR)是否可以改善Ⅳ期乳腺癌患者的生存结局仍存在争议[4]。三阳性乳腺癌(triple-positive breast cancer, TPBC)是指雌激素(ER)或孕激素(PR)阳性、人类表皮生长因子受体2(HER-2)阳性的1类乳腺癌,属于Luminal B型乳腺癌的一种亚群,约占乳腺癌患者的9%~12%[3]。在靶向治疗和内分泌治疗日益进展的时代,有研究表明 Ⅳ 期乳腺癌中TPBC的总体生存率好于其他分子亚型[5-6],这为PLR提供了更多的治疗时机。探讨PLR是否可以改善 Ⅳ 期TPBC患者的预后有一定的临床参考价值。
美国国立癌症研究所SEER数据库详细记录了大约覆盖全美国28%人口的诊断、临床病理特征及随访等信息。HER-2表达状况自2010年开始作为SEER数据库的收录数据,因此本研究纳入了SEER数据库中2010年至2015 年初诊 Ⅳ 期的女性TPBC患者,分析PLR组和NPLR组的TPBC患者临床病理特征的差异,探索TPBC患者预后的独立影响因素及其预测价值,了解在不同转移状态下PLR对TPBC患者生存结局的影响,并进一步分析手术方式对TPBC患者总体生存率(OS)和乳腺癌特异生存率(BCSS)的影响,以期对Ⅳ期TPBC患者的临床治疗决策提供参考。
1 资料与方法
1.1 一般资料 使用SEER stat 软件(版本号8.3.5)查找2010年至2015年病理确诊为 Ⅳ 期乳腺癌并有完整随访信息的患者。纳入标准:(1)病理确诊为乳腺癌;(2)初诊临床分期为Ⅳ期(第7版UICC/AJCC临床分期);(3)无其他肿瘤;(4)有完整随访(随访截止到2018年11月);(5)女性;(6)确诊时间为2010年1月1日至2015年12月30日。提取患者的诊断年龄、人种、组织学类型、T分期、N分期、Grade分级、原发灶手术、放疗、化疗、转移部位(骨、脑、肝、肺)、受体状态(ER/PR/HER2)、生存时间及生存状态的数据。根据受体状态筛出TPBC患者,在此基础上排除有以下状况的患者。(1)未知T、N分期,Grade分级;(2)未知PLR与否;(3)未知骨、脑、肝、肺转移情况。最终993例患者纳入研究队列。
1.2 统计学处理 根据PLR与否将Ⅳ期TPBC患者进行二分类,使用SPSS 22.0软件进行统计分析,纳入除PLR外的临床病理因素进行1∶1倾向得分匹配来平衡混杂偏倚,匹配容差设为0.1。χ2检验用来比较PSM前后手术组和非手术组临床病理特征的分布差异。单因素COX回归分析有统计学差异的变量纳入COX比例风险模型进行多因素分析,得到影响初诊 Ⅳ 期TPBC患者OS和BCSS 的独立风险因素。统计不同转移状况(单纯骨转移、单纯内脏转移、骨转移+内脏转移、非常见部位转移)下不同治疗方案(PLR、ST、PLR+ST、未行上述治疗)的使用情况。使用Graphpad Prism 7.0软件绘制ST和PLR+ST在不同转移状况的亚组中的Kaplan-Meier生存曲线,并进行Log-rank检验。对于进行PLR且知道手术方式的393例患者,采用PSM、χ2检验、Fisher确切概率法、Kaplan-Meier和Log-rank检验分析手术方式对患者OS和BCSS的影响。检验水准(α)为0.05。
2 结 果
2.1 Ⅳ期TPBC患者PLR组和NPLR组临床病理特征 对于993例筛选Ⅳ期TPBC患者(图1),按原发灶是否进行过手术分为2组[PLR:395(39.8%);NPLR:598(60.2%)]。分析结果显示,除种族、组织学类型外,其余变量在2组之间的构成比差异有统计学意义。PLR组较NPLR组年龄<55岁(54.2%vs42.9%)、分化程度低(65.1%vs55.5%)、T分期早(T1~T2: 64.2%vs47.1%)、N分期晚(N2~N3: 44.5%vs22.6%)的患者占比多。同时较NPLR组来说,PLR组患者中接受放疗(47.1%vs24.9%)或化疗(87.3%vs72.9%)的患者比例高,发生远处转移(骨:59.0%vs69.4%;脑:3.0%vs8.4%;肝:24.1%vs38.6%;肺:21.0%vs35.8%)的患者占比低。1∶1倾向得分匹配来平衡混杂偏倚后,除N分期(P=0.027)、脑转移(P=0.049)变量以外,其他变量的构成比在2组间差异无统计学意义(表1)。
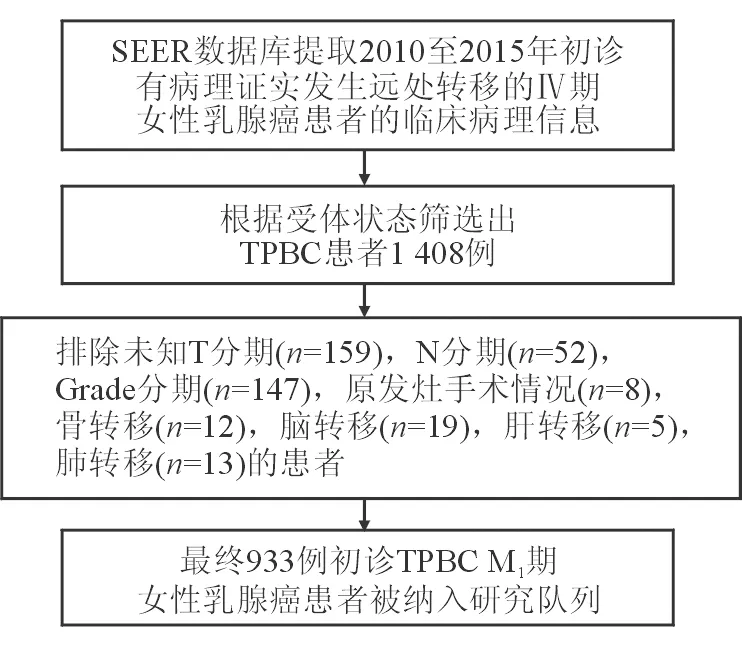
图1 SEER数据提取流程
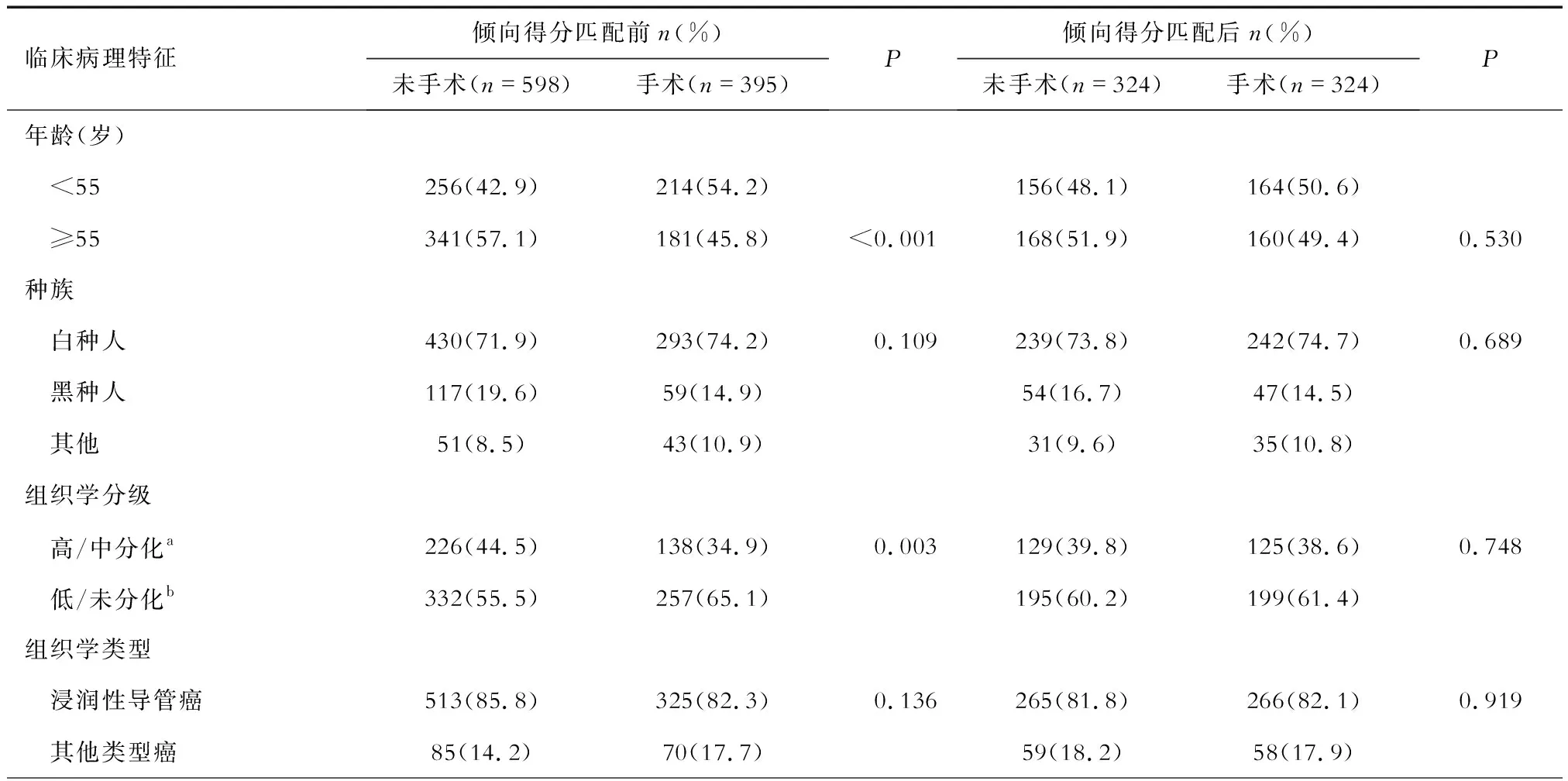
表1 倾向得分匹配前后Ⅳ期TPBC患者手术组与非手术组临床病理特征比较
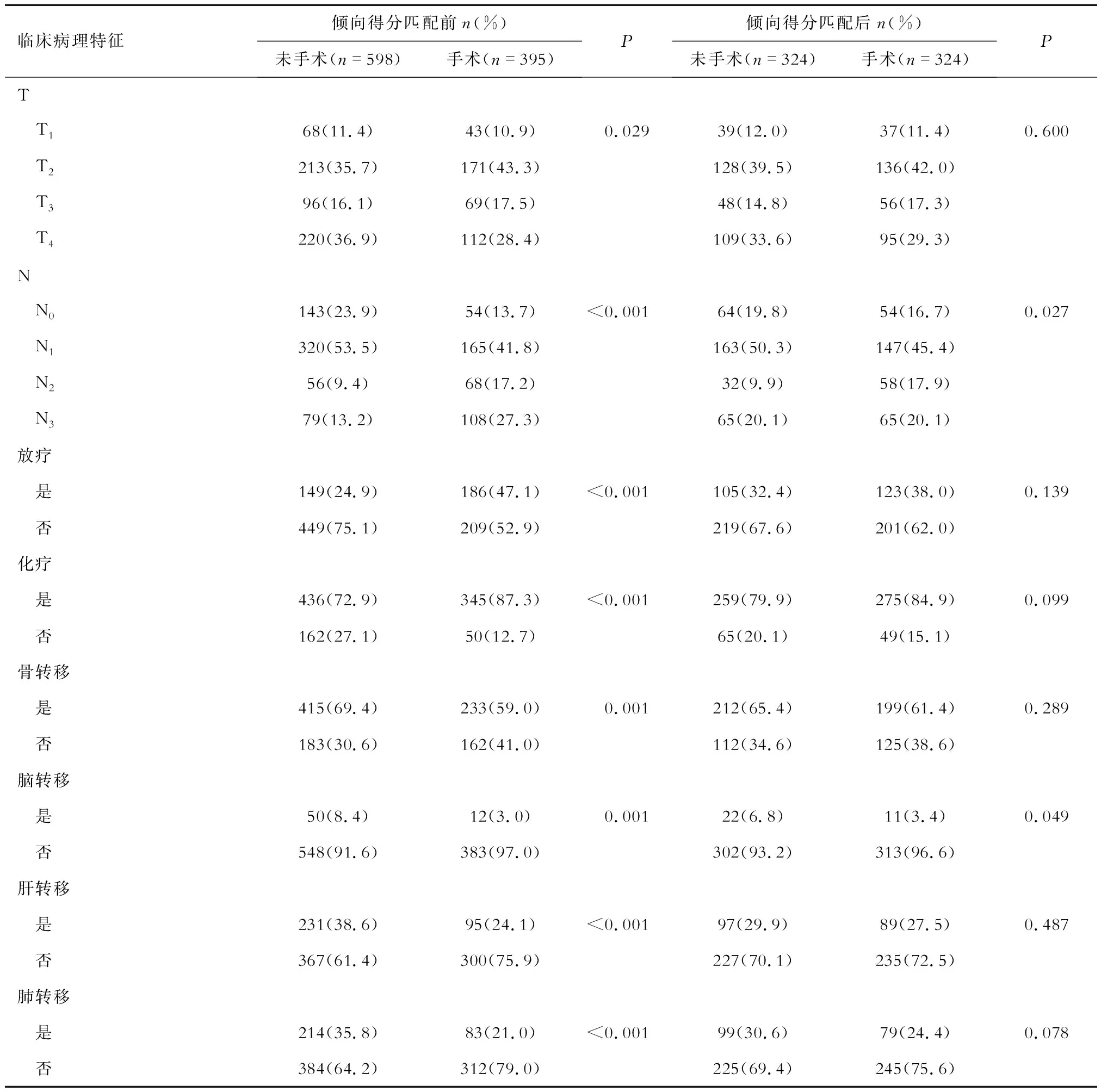
续表
2.2 Ⅳ期TPBC患者生存结局及预后因素分析 生存分析结果显示,PSM前,993例患者中位随访时间为40个月(0~83个月)。中位生存时间为51个月。PLR组5年OS为62.2%,NPLR组为29.8%(χ2=86.38,P<0.001),5年BCSS为65.6%vs31.9%(χ2=78.74,P<0.001;图2A、2B)。PSM平衡混杂偏倚后,有648例患者纳入后续分析,其中位随访时间为41个月(0~83个月)。中位生存时间为57个月,PLR组5年OS为60.2%,NPLR组为32.4%(χ2=41.24,P<0.001),PLR组5年BCSS为63.8%,NPLR组为34.3%(χ2=39.58,P<0.001;图2C、2D)。值得注意的是,在发生脑转移的亚组中,手术并不能改善患者的OS(P=0.338 8)和BCSS(P=0.438 8;图2E、2F)。
单因素COX回归分析结果显示,年龄、T分期、PLR、化疗、脑转移、肺转移与Ⅳ期TPBC患者的OS和BCSS有关(表2)。
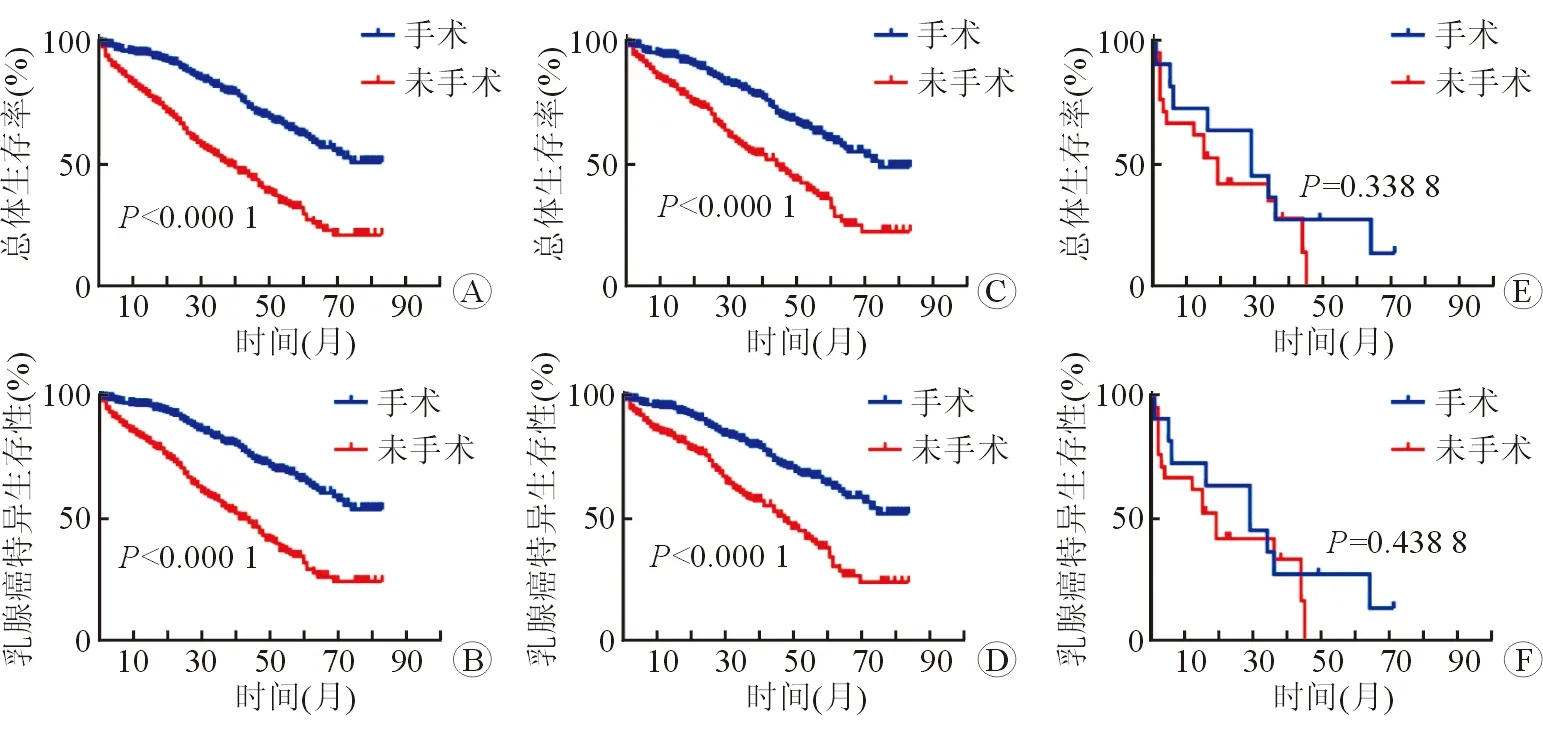
图2 生存曲线分析原发灶手术与否对Ⅳ期TPBC患者OS及BCSS的影响
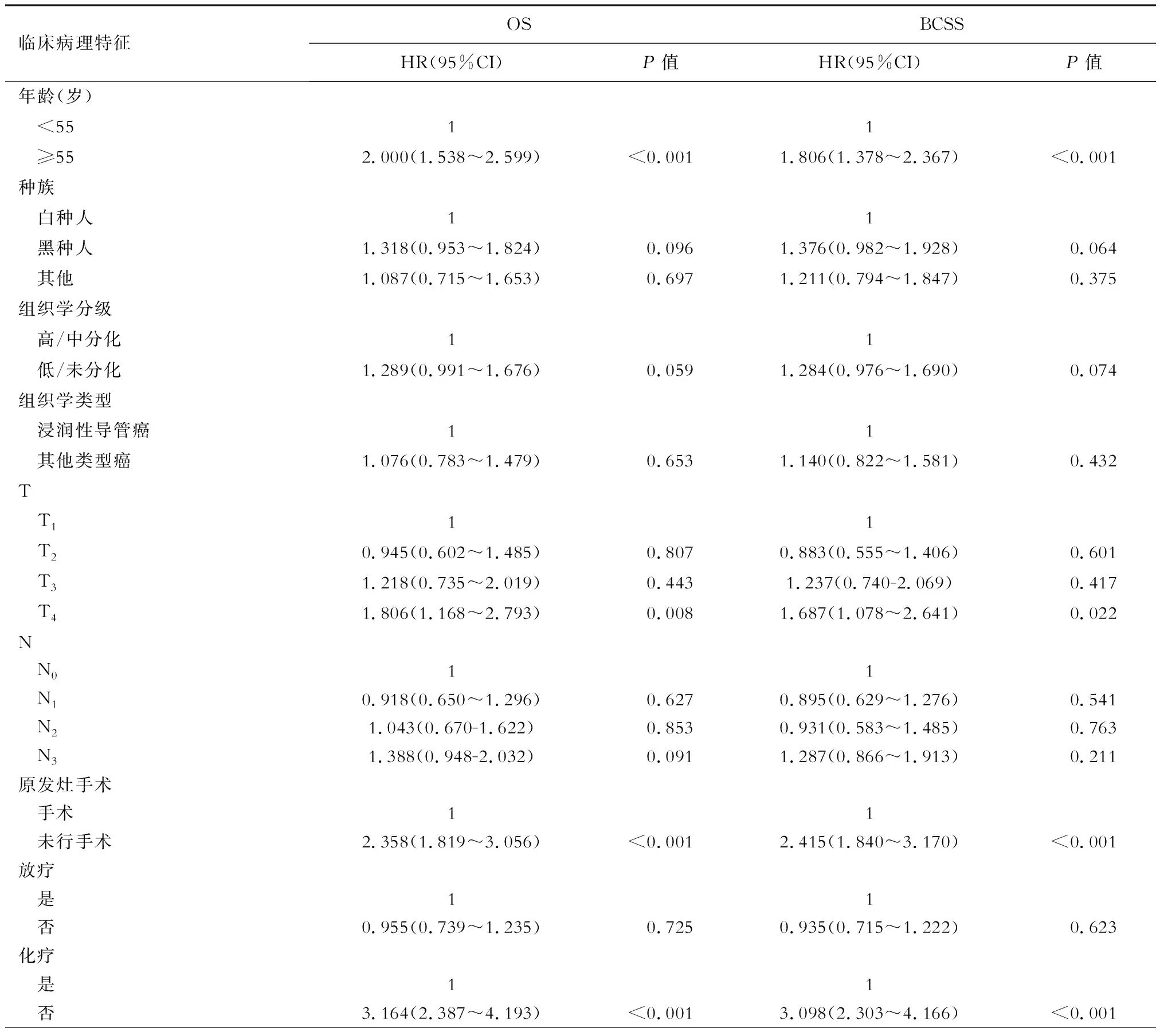
表2 倾向性得分匹配后影响Ⅳ期TPBC患者的OS及BCSS的单因素COX回归分析 N=648
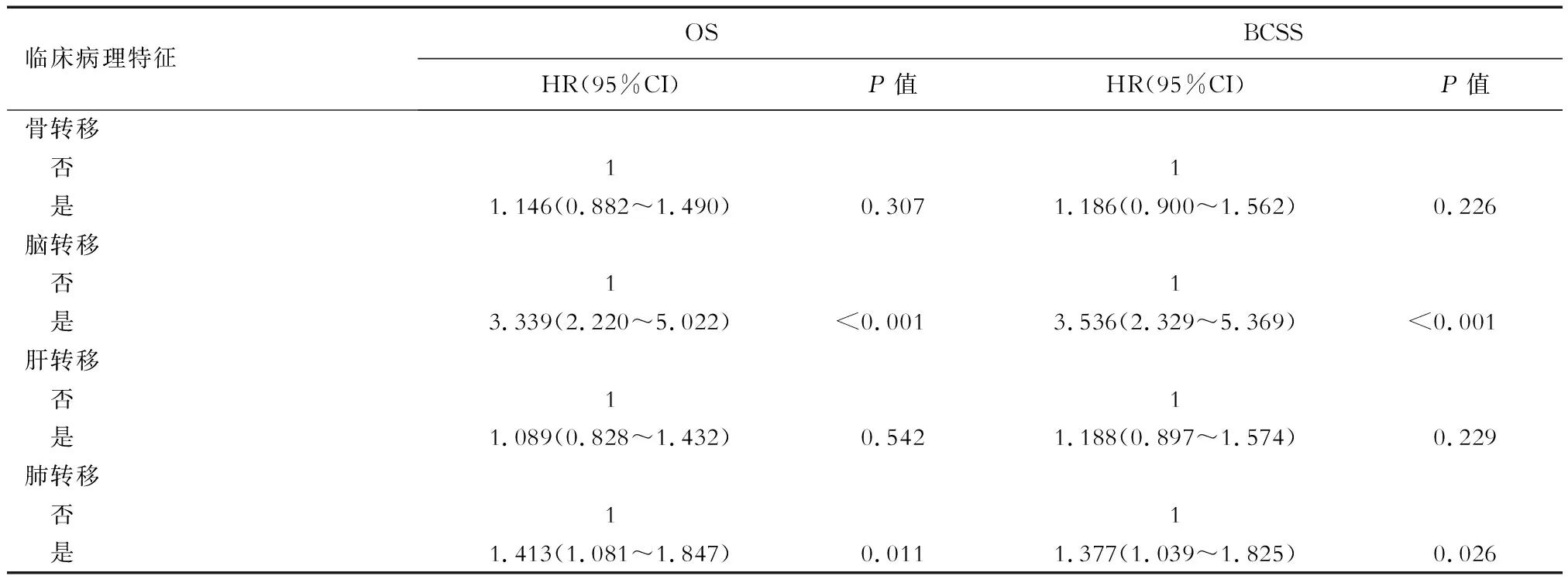
续表 n=648
将上述单因素分析有统计学意义的变量纳入多因素COX比例风险模型分析,结果表明,年龄(OS:HR=1.583,95%CI 1.201~2.086,P=0.001;BCSS:HR=1.438,95%CI 1.081~1.913,P=0.013)、T分期(T4vsT1:OS:HR=1.588,95%CI 1.022~2.468,P=0.04;BCSS:HR=1.480,95%CI 0.941~2.329,P=0.09)、原发灶手术(OS:HR=2.163,95%CI 1.660~2.818,P<0.001;BCSS:HR=2.226,95%CI 1.688~2.937,P<0.001)、化疗(OS:HR=2.639,95%CI 1.969~3.539,P<0.001;BCSS:HR=2.636,95%CI 1.935~3.589,P<0.001)、脑转移(OS:HR=2.770,95%CI 1.825~4.205,P<0.001;BCSS:HR=2.962,95%CI 1.932~4.542,P<0.001)是影响TPBC患者OS和BCSS的独立预后因素(表 3)。
2.3 亚组分析2种治疗模式(PLR+ST;单纯ST)对Ⅳ期TPBC患者生存结局的影响 为进行进一步亚组分析,将648例Ⅳ期TPBC患者根据治疗方式分为4组:PLR+系统治疗(systemic treatment, ST)组(放疗和/或化疗)(44.4%)、ST组(43.7%)、仅PLR组(5.6%)、未行上述治疗组(6.3%)。根据转移状况可分为4组(表4):单纯骨转移组(37.2%)、单纯内脏转移组(26.2%)、骨转移+内脏转移组(26.2%)、非常见部位转移组(10.3%)。
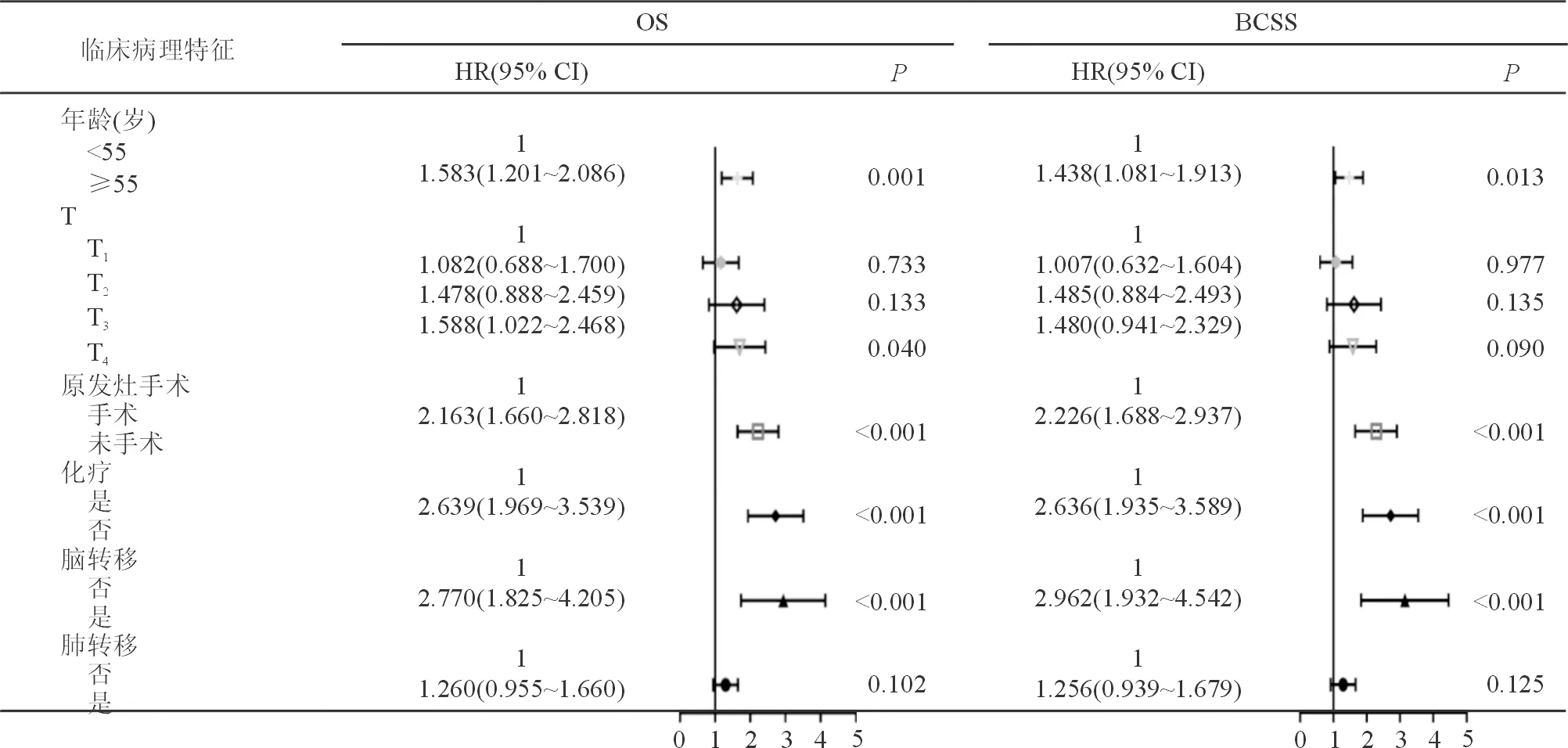
表3 倾向性得分匹配后影响晚期TPBC患者的OS和BCSS的多因素COX回归分析 n=648
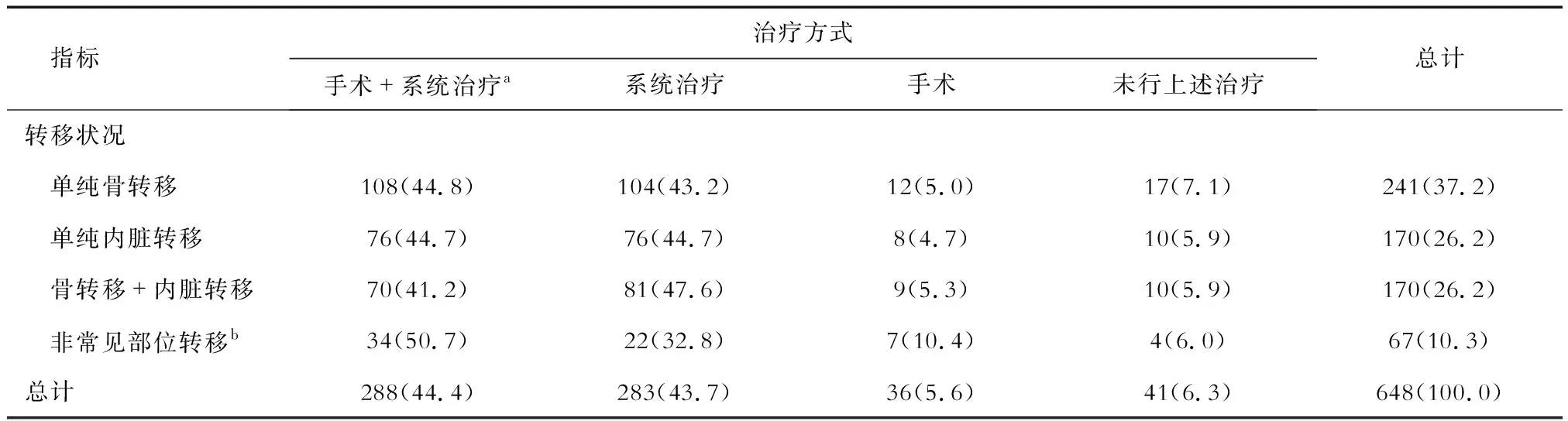
表4 不同转移状况下治疗模式选择情况统计 n(%)
考虑到ST是Ⅳ期乳腺癌患者的主要治疗手段,因此主要比较了在不同转移状况的亚组中,PLR+ST组和单纯ST组患者OS和BCSS的差异。结果显示PLR+ST组较单纯ST组可显著改善单纯骨转移组(OS:χ2=17.19,P<0.001; BCSS:χ2=20.18,P<0.001;图3A、3B)、单纯内脏转移组(OS:χ2=9.177,P=0.002 5; BCSS:χ2=7.774,P=0.0053;图3C、3D)、骨转移+内脏转移组(OS:χ2=9.535,P=0.002 0; BCSS:χ2=8.444,P=0.003 7;图3E、3F)的OS和BCSS,而在非常见部位转移组中PLR+ST组和单纯ST组的生存差异无统计学意义(OS:P=0.080 3;BCSS:P=0.105 6;图3G、3H)。
2.4 Ⅳ期TPBC患者保乳术组和全乳切除术组临床病理特征及生存结局的差异 395例实行PLR的患者中,除去2例手术方式未知的患者,剩余393例患者可分为保乳术组(n=112)和全乳切除术组(n=281),与保乳术组比较,全乳切除术组中,T(T3~T454.5%vs23.2%)、N分期晚(N2~N340.9%vs29.5%)的患者占比高。PSM后,临床病理变量在保乳术组和全乳切除术组的构成比差异无统计学意义(表5)。
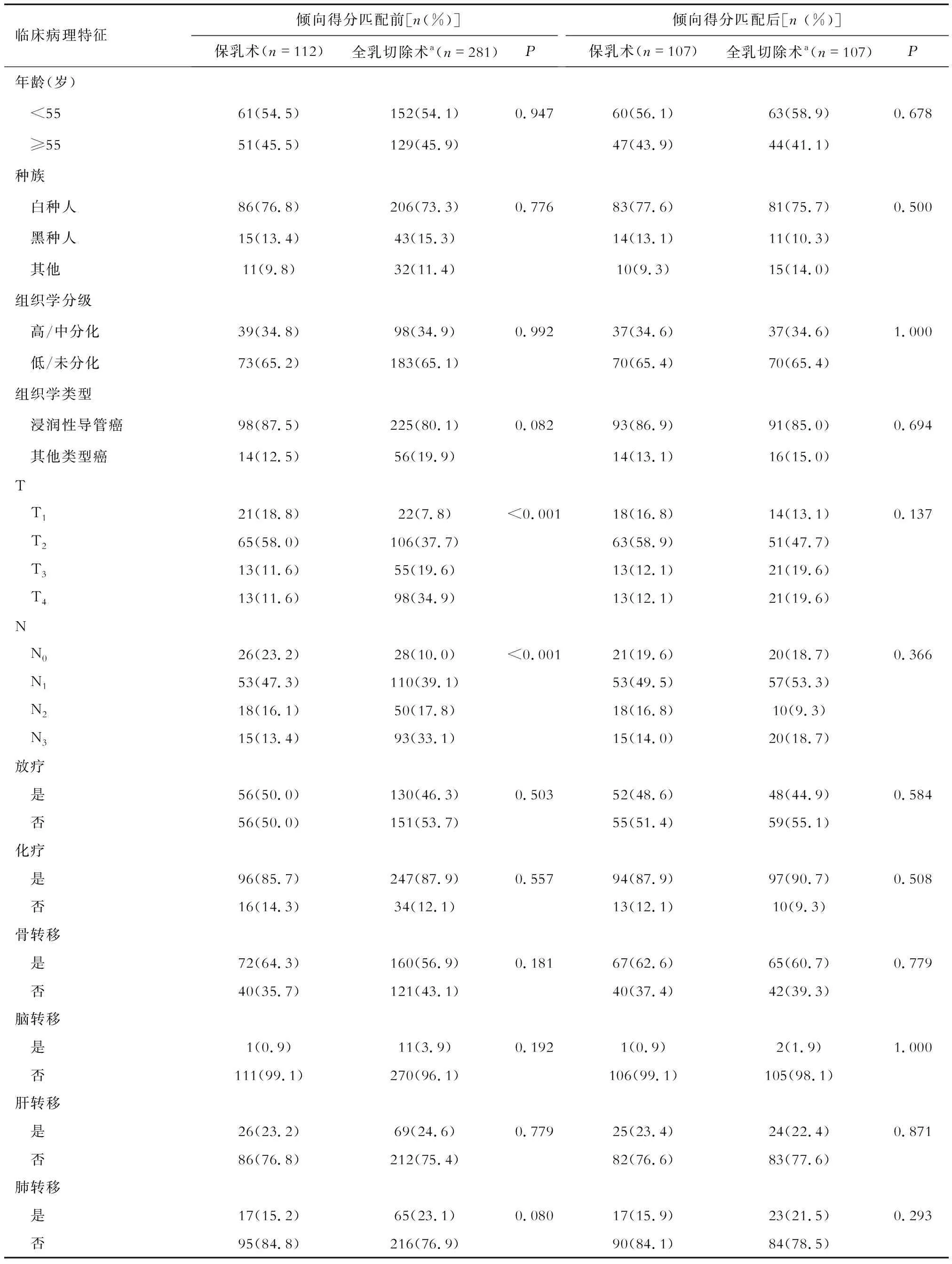
表5 倾向得分匹配前后Ⅳ期TPBC患者保乳术组与全乳切除术组临床病理特征比较
PSM前,生存曲线分析显示保乳术组的OS及BCSS好于全乳切除术组(图4A、4B),而PSM后,生存分析发现两种手术方式并不明显影响患者OS或BCSS(图4C、4D)。
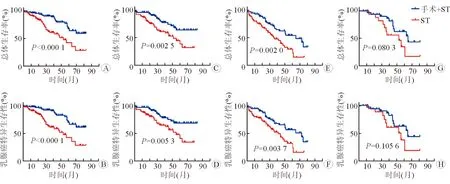
图3 生存曲线分析PLR+ST组和ST组在不同亚组的Ⅳ期TPBC患者中OS及BCSS的差异
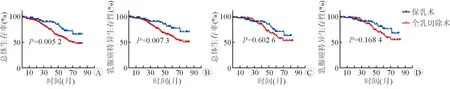
图4 手术方式对Ⅳ期TPBC患者OS及BCSS的影响
3 讨 论
初诊 Ⅳ 期乳腺癌患者预后较差,总体中位生存时间仅约28个月[5]。原发灶手术对 Ⅳ 期乳腺癌患者预后的影响尚存在争议,多项回顾性研究表明,局部手术是改善患者预后的独立影响因素[10-14],3个关于中国 Ⅳ 期乳腺癌患者的回顾性研究得出与之一致的结论[15-17]。考虑到回顾性研究存在选择偏倚,接受手术治疗的患者可能存在较低的肿瘤负荷和较少的转移灶,一些回顾性研究将之前报道过的与生存益处相关的变量进行倾向性得分匹配后,发现与PLR相关的生存获益会被缩小或消除[18-19]。另外,3项前瞻性研究的结果也存在争议。MF07-01是 Ⅲ 期多中心随机对照实验,纳入了274例初诊 Ⅳ 期的乳腺癌患者,分为先局部手术后系统治疗LRT组(n=138)和系统治疗组ST(n=136),中位随访时间为55个月,发现LRT组OS明显好于ST组(HR=0.66,95%CI 0.49~0.88;P=0.005)。亚组分析显示HR(+)、HER2(-)、年龄<55岁、只发生骨转移的亚组中,LRT组的OS显著优于ST组[8]。在另1项研究NCT00193778中,初诊Ⅳ期乳腺癌患者先行ST(化疗/内分泌治疗),ST应答者随机分成手术组和非手术组,中位随访时间为23个月,结果发现手术组无局部进展生存率提高,但无远处进展生存率及OS无明显改善[20]。此外,TBCRC 013研究发现,在不考虑乳腺癌亚型的情况下,PLR并不能改善晚期乳腺癌患者预后[21]。另有一些研究探讨了原发灶的手术方式对患者预后的影响。韩国YONSEI大学的1项基于9例行保乳术,64例行全乳切除术的初诊 Ⅳ 期乳腺癌患者的回顾性研究发现,保乳术+放疗组(BCS+RT)患者的5年局部无进展生存率及OS好于全乳切除术±放疗组,但该研究纳入病例数较少,且未公布2组患者的具体临床信息[22],该结局不排除存在选择偏倚的可能。另有综述指出,对于 Ⅳ 期乳腺癌患者,在术前有效的全身治疗,控制远处转移,可以使保乳的成功率最大化[23]。Ⅳ期乳腺癌患者是否可以从手术中获益,可获益的人群、手术的时机、手术方式的选择目前还在探索阶段。
2017年更新了第8版AJCC分期手册,将ER、PR、HER2状态纳入其中作为预后分期的参考指标[24]。初诊Ⅳ期的乳腺癌亚组生存分析结果显示,在内分泌治疗和靶向治疗快速进展的时代,TPBC(ER、PR、HER2均阳性)较其他分子分型的乳腺癌患者有更好的生存结局[5-6]。目前,Ⅳ期TPBC患者的治疗手段有化疗联合靶向治疗、内分泌治疗、放疗、手术治疗(原发灶/转移灶)等。本研究是基于SEER数据库2010年至2015年初诊为Ⅳ期TPBC的993例患者的回顾性研究,分析的是2010年至2015年初诊Ⅳ期TPBC患者,此期间靶向治疗及内分泌治疗的进展使得晚期TPBC患者的生存时间延长,疾病控制、缓解率提升,在此背景下希望了解原发灶手术治疗是否改善晚期TPBC患者生存。年龄变量笔者依据文献报道的平均绝经年龄[7],及探讨Ⅳ期患者原发灶手术价值的前瞻性随机MF07-01试验[8],选择55岁为分组界值。组织学分级分组参照Ⅳ期乳腺癌预后影响因素分析结果,高、中分化组患者生存结局无统计学差异[9],将患者分为高/中分化(Grade Ⅰ/Ⅱ)和低/未分化(Grade Ⅲ)2组。
进行基线资料统计发现,PLR组的患者较NPLR组肿瘤负荷少,发生了远处转移(骨、脑、肝、肺)的患者占比低,值得注意的是,PLR组中分化程度低、N分期晚的患者占比多,这可能是由于术前未将这些变量视为影响治疗决策的关键变量。通过1∶1 PSM平衡组间混杂偏倚后,PLR组的OS及BCSS仍优于NPLR组。采用COX比例风险模型分析发现,年龄、T分期、PLR、化疗及脑转移是影响Ⅳ期TPBC患者的独立预后因素。亚组分析显示,对于发生脑转移或非常见部位转移的Ⅳ期TPBC患者,PLR组并没有生存优势。而在单纯骨转移组、单纯内脏转移组、及骨转移+内脏转移组中,PLR组较NPLR组可显著提高患者的OS及BCSS。
另外,在本研究中,PLR组的393例患者处于T1~T2期的有214例(54.5%),共有112例患者实行保乳术,282例患者实行全乳切除术,基于前期数据分析我们发现Ⅳ期TPBC患者中PLR组生存结局好于NPLR组,因此进一步探讨了手术方式是否会影响患者生存。结果显示,PSM前,保乳术组T、N分期早的患者占比高,保乳术组的生存结局好于全乳切除术组。将保乳术组与全乳切除术组进行1∶1 PSM平衡基线差异(全乳切除术组T、N分期晚的患者占比高)造成的选择偏倚后发现,在临床病理特征、辅助治疗等变量的组间构成比相似的患者群体中,手术方式并不影响患者的OS或BCSS。该结果提示在适合做原发灶手术的Ⅳ期TPBC患者中,局部肿瘤负荷低(T、N分期早)的患者在保证切缘阴性的前提下,创伤小的保乳术不会降低手术带来的生存获益。同时值得注意的是,PSM后,214例Ⅳ期TPBC患者中有3例(1.4%)发生脑转移,由于脑转移组患者样本量少,且前期分析表明Ⅳ期脑转移组患者不能从PLR中获益,因此尚不能明确手术方式对该亚组患者生存结局的影响。原发灶手术可能改善Ⅳ期TPBC患者生存有以下可能机制:(1)局部手术可以控制出血、渗出和感染等局部症状,改善患者的生存质量[25];(2)原发灶存在具有高侵袭转移能力的干细胞,手术切除原发灶,可减低肿瘤负荷,延长患者的生存期[26-27];(3)Harano等[28]的研究表明,接受曲妥珠单抗治疗的HER2阳性的 Ⅳ 期乳腺癌患者,原发灶肿瘤切除组较未切除组有明显的生存获益,提示或由于原发灶手术切除,降低了肿瘤负荷,改善了靶向药物的疗效;(4)HR和HER2通路存在交互作用,可能介导靶向治疗及内分泌治疗的抵抗,导致耐药[29-30],手术切除原发灶可清除耐药细胞,提高系统治疗的疗效;(5)原发灶的存在会抑制机体免疫细胞的功能,动物实验证实在有远处转移的老鼠模型中切除原发灶可以恢复机体的免疫活性[31]。
本研究尚存在一定的局限性:(1)作为回顾性研究,手术组和非手术组纳入的患者存在选择偏倚,虽后续使用PSM法平衡混杂偏倚,但依然不能完全消除偏倚;(2)靶向治疗作为晚期TPBC患者的一线治疗手段,SEER数据库没有相应的具体记载;化疗虽有记录,但仅限于是否进行过化疗,具体的方案和周期没有明确的数据;(3)SEER数据库中关于手术与放化疗、靶向治疗的先后顺序未进行描述;(4)未收录患者的内分泌治疗的用药及时长的数据;(5)缺少对于转移灶负荷及治疗情况的相关数据。
本研究基于SEER数据库回顾性分析得出,PLR可明显改善除发生脑转移及非常见部位转移的 Ⅳ 期TPBC患者的生存结局;手术方式是保乳术还是全乳切除术对生存结局的影响无统计学差异。这一研究可为 Ⅳ 期TPBC患者的诊疗决策提供参考。由于回顾性研究存在混杂偏倚,对 Ⅳ 期TPBC患者是否实施原发灶手术,需综合考虑患者的年龄、肿瘤负荷、转移状况、系统治疗的疗效、是否可以达到切缘阴性等因素持谨慎态度做出决定。
