影响过敏性紫癜患者肾损伤的独立危险因素分析
2020-09-11张芳玲
吴 军 张芳玲
过敏性紫癜(anaphylactoid purpura,HSP)为结缔组织病,属于变态反应性疾病,好发于儿童群体,特征性皮损(在肢体远端呈现对称分布)是患者的典型临床表现,常伴表现包括关节肿痛、腹痛、蛋白尿以及血尿等。有调查[1]显示,HSP临床发病率具有逐年升高趋势,大多数患者预后良好,但依然有部分患者存在反复发作现象,对其身心健康造成了严重影响。有报道[2-3]称,20%~80%HSP累及肾脏,大部分紫癜性肾炎出现于发病后3个月内,紫癜性肾炎容易造成持续性肾脏损害,导致肾衰竭,严重威胁患者正常生活与预后。探究HSP患者肾损伤发生的影响因素,采取针对性预防治疗措施,对提高患者生活质量、改善其预后具有非常重要临床意义。本研究主要分析HSP患者肾损伤相关独立危险因素,旨在为HSP患者临床治疗提供可靠指导。
1 资料与方法
1.1 一般资料 选取2017年1月至2019年11月太和县人民医院收治的118例HSP患者。纳入标准:①与《诸福堂实用儿科学》[4]中的HSP有关诊断标准相符;②临床资料完整;③入院前近1周内未服用糖皮质激素;④患儿家属对研究知情。排除标准:①HSP发病前有肾脏疾病;②合并影响机体免疫功能的基础疾病,包括糖尿病、肿瘤以及慢性乙型肝炎等;③合并其他免疫异常病变,如系统性红斑狼疮、风湿病、川崎病、类风湿性关节炎等;④3个月内接受过具有肾损害的药物治疗。男性68例,女性50例;年龄4~14岁,平均(8.07±2.27)岁,包括7例复发病例。
1.2 方法 收集患者一般资料,主要包括性别、年龄、皮疹持续时间、腹痛、关节痛、皮疹反复等。实验室检查:全部病例都在入院当天抽取静脉血,予以常规实验室检测,包括凝血指标[凝血酶原时间(prothrombin time,PT)、纤维蛋白原(fibrinogen,FIB)、血小板计数(platelet count,PLT)及活化部分凝血活酶时间(activated partial thromboplastin time,APTT)]、血脂[低密度脂蛋白胆固醇(low density lipoprotein,LDL)、高密度脂蛋白胆固醇(high density lipoprotein,HDL)、总胆固醇(total cholesterol,TC)]、血清免疫球蛋白(IgG、IgA与IgM)、白细胞计数(white blood cell,WBC)以及血红蛋白(hemoglobin,Hb)等。参照肾损伤判定标准:予以尿常规检查,发现蛋白定性阳性或者红细胞不少于3个/高倍视野[5]。分为肾损伤组(n=44)与非肾损伤组(n=74),记录并比较两组患者的一般资料及实验室检测结果。

2 结果
2.1 两组患者一般资料比较 两组患者性别构成、腹痛、关节痛及皮疹反复情况比较差异无统计学意义(P>0.05);肾损伤组年龄大于非肾损伤组,皮疹持续时间长于非肾损伤组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者一般资料比较
2.2 两组患者实验室指标比较 两组患者PT、APTT、LDL、HDL、TC、IgG、WBC、Hb水平比较差异均无统计学意义(P>0.05);肾损伤组FIB、PLT、IgA、IgM水平高于非肾损伤组,差异有统计学意义(P<0.05)。见表2。
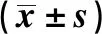
表2 两组患者实验室指标比较
2.3 多因素分析 肾损伤为因变量,选择单因素分析中有统计学意义的变量为自变量,α入=0.05,α剔除=0.10,计量资料(均为连续变量)直接输入数值;logistic回归分析显示,皮疹持续时间、FIB、PLT、IgA、IgM属于HSP肾损伤独立危险因素(P<0.05)。见表3。
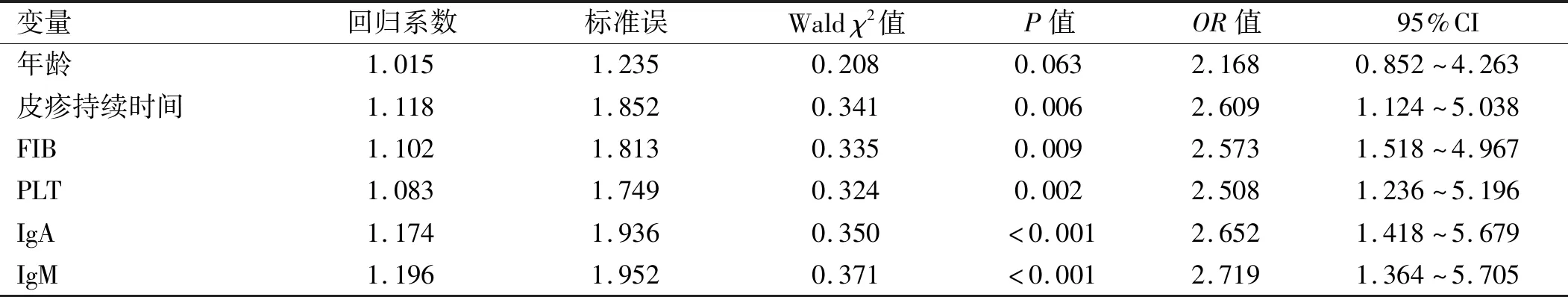
表3 多因素分析
3 讨论
HSP伴肾损伤将明显延长患者治疗时间,对其远期预后造成不良影响[6]。以往有研究[7]认为,年龄、皮疹反复发作属于HSP患者肾损伤发生的独立危险因素。但本研究中,两组患者皮疹反复情况无明显差异,肾损伤组年龄明显大于非肾损伤组,但多因素分析发现其并非HSP肾损伤独立危险因素。可能与本研究样本量较少、非多中心研究等有关。
本研究显示,皮疹持续时间属于HSP患者肾损伤独立危险因素,与杨绪娟等[8]研究结论一致。考虑由于皮疹持续时间长,患者出现HSP相关危险因素持续存在,使机体产生变态型血管反应,引起血管炎,造成免疫复合物大量沉积与相应补体激活,促使肾小球以及肾间质产生一系列炎症反应,最终导致肾损伤。临床应关注HSP患者皮疹持续时间,尤其是持续时间长的患者,应及时采取针对性预防对策,尽量缩短皮疹持续时间,降低肾损伤风险。
本研究中,肾损伤组PLT明显高于非肾损伤组,logistic回归分析证实其为肾损伤独立危险因素。正常情况下,PLT水平在血液中保持恒定状态,具有保护与修复内皮组织及血管、凝血、止血、避免动脉粥样硬化发生等作用[9-10]。人体循环血液中,PLT处于静息状态。对于HSP患者而言,因为免疫复合物及相关炎性因子大量释放,使血管内皮受损,从而显露内皮下胶原等结构,促使血管性血友病因子(von willebrand factor,vWF)和血管内皮下组织黏附,导致vWF出现分子构型改变,PLT在vWF介导下黏附于血管破损部位内皮下组织,激发PLT活化反应,其中包括PLT聚集以及分泌反应,提高血小板活力与分泌水平,造成血液处于高凝状态,促使毛细血管产生微血栓,尤其是肾小球,由于其毛细血管非常丰富,因此更易产生微血栓,引起肾功能损伤[11-12]。同时,肾小球聚集激活,PLT能够通过脱颗粒作用以及促中性粒细胞分泌带正电蛋白分子、血管活性胺等,导致肾小球滤过屏障通透性提高,使免疫复合物大量沉积,最终造成肾小球免疫损伤。
本研究多因素分析显示,FIB属于HSP肾损伤独立危险因素。肾损害可致FIB水平升高,导致血液高凝状态,增加小血管血栓概率。同时,FIB表达升高可损害肾小球系膜,促进体内新月体形成,进一步加重肾损害程度,造成恶性循环[13]。当前,关于血清免疫球蛋白是否为HSP患者肾损伤危险因素尚无统一定论。有研究[14]认为,免疫球蛋白和HSP肾损伤不存在相关性。亦有研究[15]表明,HSP肾损伤危险因素之一为IgM。本研究发现,IgA、IgM属于HSP肾损伤独立危险因素。分析原因,可能由于致敏性因素导致HSP患者T淋巴细胞功能紊乱,B淋巴细胞大量克隆活化,使血清IgA水平提升,IgA形成的相应抗原-抗体免疫复合物进入血循环,特别是以IgA为主的相应免疫复合物大量沉积于人体全身小血管壁(包括肾小血管),造成肾损伤[16]。对于IgM因素,可能由于HSP患者体内T淋巴细胞CD亚群高度表达,B淋巴细胞大量增殖,促进了IgM活化与合成,相应免疫复合物大量附着于肾小血管壁,引起肾损伤。故临床应密切关注HSP患者皮疹持续时间,严密监测FIB、PLT、IgA、IgM,合理评估患者肾损伤出现的风险,尽早采取有效干预对策,改善其预后。
综上,皮疹持续时间、FIB、PLT、IgA及IgM水平等均为HSP肾损伤独立危险因素,临床应密切关注与检测这些因素,早期予以针对性干预,以减小肾损伤发生风险。
