2型糖尿病肾脏病患者血清长正五聚蛋白3和α-klotho蛋白水平的变化及意义
2020-09-11李宝新郭淑芹张玛丽张云良
田 茜 李宝新 李 娜 郭淑芹 张玛丽 李 杰 王 翯 张云良
糖尿病肾脏病(diabetic kidney disease, DKD)是糖尿病患者长期高血糖造成的慢性微血管并发症,是导致终末期肾病的重要原因之一,因其起病隐匿,易延误病情[1-2],故早期诊断及预防DKD具有重要意义。近年来血管炎症反应、氧化应激及代谢紊乱等因素促进DKD的发生得到临床认可[3]。长正五聚蛋白3(pentraxin 3,Ptx3)是多种炎症介质的受体,与血流动力学改变、清除凋亡细胞有密切关系[4]。α-klotho蛋白作为内分泌激素调节机体能量代谢,并在抗细胞凋亡及抗氧化中发挥着关键作用[5],二者均参与炎症反应,进而调节内皮细胞功能,但在DKD患者体内血清Ptx3及α-klotho蛋白表达水平尚不明确。本研究旨在测定不同尿白蛋白/肌酐比值(urine albuminuria/creatinine ratio,UACR)的2型糖尿病肾脏病患者中血清Ptx3和α-klotho蛋白的水平变化,并分析两者与UACR及相关参数的关系。现报道如下。
1 资料与方法
1.1 一般资料 选取2016年11月至2018年11月保定市第一中心医院内分泌科收治的2型糖尿病患者174例作为研究对象,其中男性90例,女性84例。2型糖尿病的诊断符合1999年世界卫生组织诊断标准[6],排除标准:①伴有急性糖尿病并发症;②有明确原发性肾病及其他原因继发的肾病病史者;③正在服用或曾应用3个月以上治疗肾病的药物者;④急慢性感染性疾病;⑤血液系统疾病、自身免疫系统性疾病、恶性肿瘤等;⑥心、脑血管疾病急性期。依据WHO推荐的DKD分期标准[7],按照UACR将糖尿病患者分为3个亚组:正常白蛋白尿组(DM组)60例,UACR<30 mg/g;微量白蛋白尿组(DKD1组)61例,30 mg/g≤UACR<300 mg/g;大量白蛋白尿组(DKD2组)53例,UACR≥300 mg/g。选取同期于本院体检的55例健康人群作为正常对照组(NC组)。4组研究对象年龄、性别及体质量指数(body mass index,BMI)比较差异无统计学意义,糖尿病3组间糖尿病病程无统计学差异(P均>0.05),基本资料具有可比性。见表1。本研究获得医院伦理委员会审核批准,研究对象均签署知情同意书。
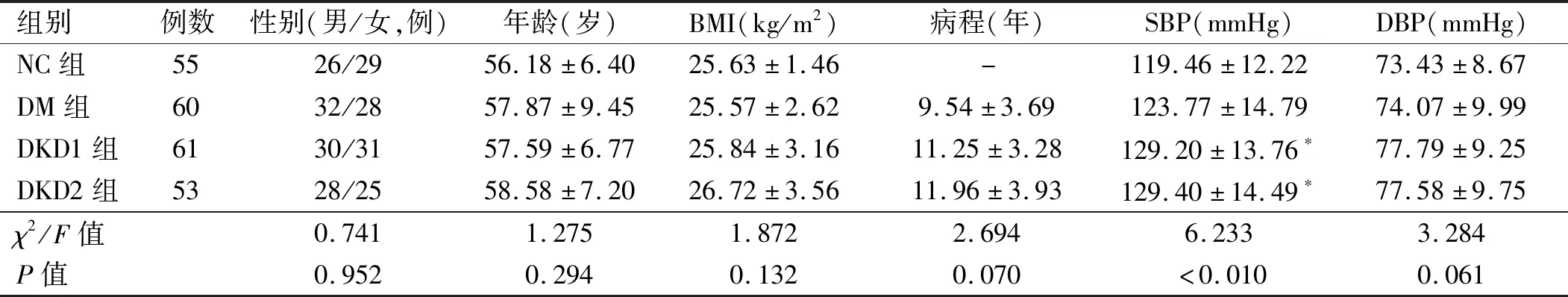
表1 4组研究对象一般资料比较
1.2 研究方法 ①收集研究对象的临床资料:记录4组研究对象的性别、年龄及3组糖尿病患者糖尿病病程,同时测量4组研究对象次日清晨在安静的房间内静坐10~15 min后的收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP)、身高及体质量,计算BMI=体质量(kg)/身高2(m2)。②检测生化指标:收集NC组研究对象当日及3组糖尿病患者次日空腹8 h后的外周静脉血,采用日立全自动7600生化仪器检验空腹静脉血糖(fasting blood glucose, FBG)、总胆固醇(total cholesterol, TC)、三酯甘油(triacylglycerol, TG)、血肌酐(serum creatinine, sCr)、尿素氮(serum urea nitrogen, BUN)、谷草转氨酶(aspartate aminotransferase, AST)、总蛋白(total protein, TP)、清蛋白(albumin, ALB);HA8180仪器测定糖化血红蛋白(hemoglobin Alc, HbA1c);留取3组糖尿病患者次日清晨07∶00至第2天07∶00时间段24 h尿液,记录24 h尿液总量,并充分混匀后取出样本10 mL,应用博士泰全自动特定蛋白分析仪BA400检测尿白蛋白(urinary albumin, UALB)、尿肌酐及24 h尿蛋白,并计算尿白蛋白排泄率(urine albumin excretion rate, UAER)、UACR;电化学发光法(德国罗氏电化学发光仪E601)测定空腹胰岛素(FINS);计算稳态模型-胰岛素抵抗指数(HOMA-IR),HOMA-IR=FBG(mmol/L)×FINS(mU/L)/22.5。肾小球滤过率(estamited glomerular filtration rate, eGFR)的计算采用CKD-EPI法[8]。③采用酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)测定血清Ptx3及α-klotho蛋白水平,试剂盒购自上海酶联免疫生物有限公司(Elabscien)。根据试剂盒说明书的说明,Ptx3有效检测范围是0.75~64 ng/mL,α-klotho蛋白有效检测范围是42.5~2 000 pg/mL。批内变异系数<10%,批间变异系数<15%。操作步骤严格按照试剂盒说明书进行。
1.3 观察指标 ①记录比较4组研究对象的临床资料(年龄、BMI、糖尿病病程等)、血液生化指标(FBG、TG、sCr、ALB、HbA1c等)、血清Ptx3及α-klotho蛋白检测结果。②比较3组糖尿病患者尿液指标(UALB、UAER、UACR及24 h尿蛋白)水平差异。③分析血清Ptx3及α-klotho蛋白与临床指标的相关性及独立影响因素。

2 结果
2.1 4组研究对象血清生化检测及相关指标比较 NC组FBG与HbA1c低于3组糖尿病患者,差异有统计学意义(P均<0.05),但DM组、DKD1和DKD2组之间比较,差异无统计学意义(P>0.05)。DKD2组ALB水平低于NC组、DM组、DKD1组,差异均有统计学意义(P<0.05)。3组糖尿病患者的Ptx3水平均高于NC组,其中以DKD2组最高,差异均有统计学意义(P<0.05)。DM组α-klotho蛋白水平低于NC组,DKD1和DKD2组α-klotho蛋白水平低于DM组,且以DKD2组最低,差异均有统计学意义(P<0.05)。见表2。
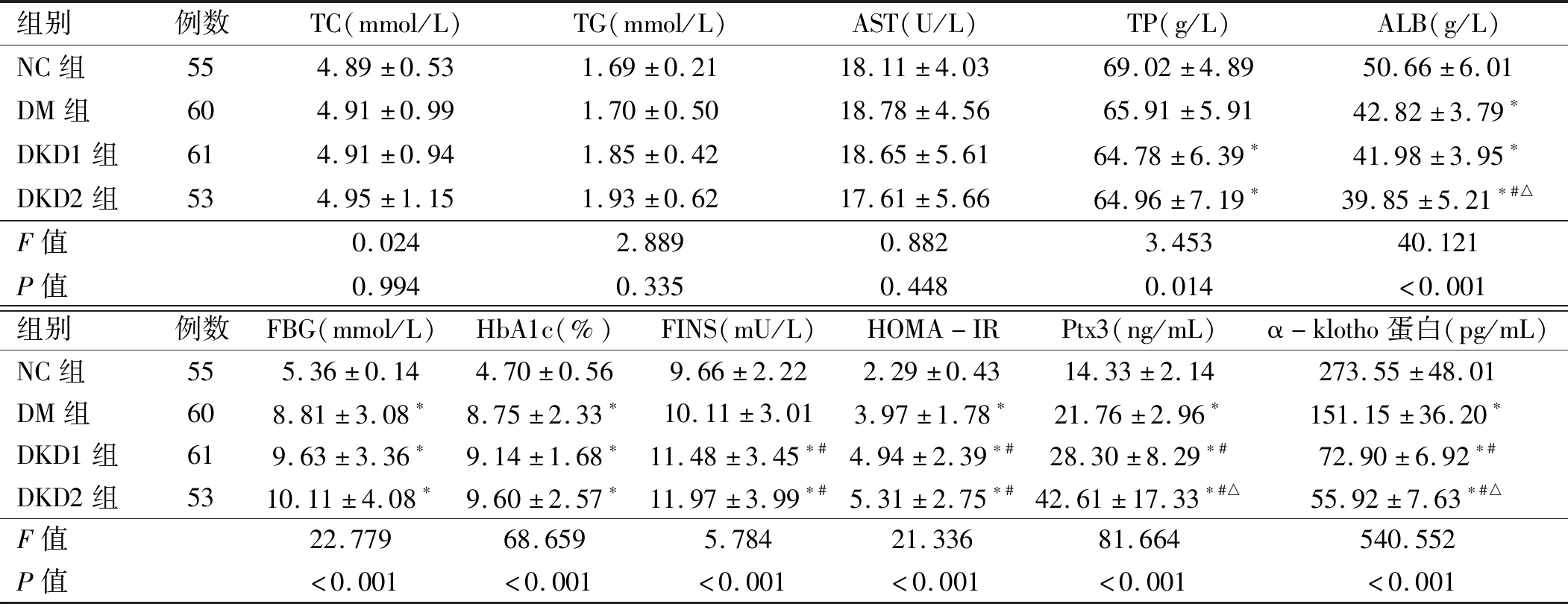
表2 4组研究对象血清生化检测及相关指标比较
2.2 4组研究对象肾功能及3组糖尿病患者尿液相关指标比较 DKD2组sCr水平高于NC组、DM组及DKD1组,差异有统计学意义(P<0.05)。DKD1组及DKD2组eGFR水平低于NC组,且DKD2组eGFR水平低于DM组,差异均有统计学意义(P<0.05)。见表3。DKD2组UALB、UAER及UACR水平高于DM组、DKD1组,任意两组比较差异均有统计学意义(P<0.05)。DKD2组24 h尿蛋白高于DM组、DKD1组,差异均有统计学意义(P<0.05)。见表4。
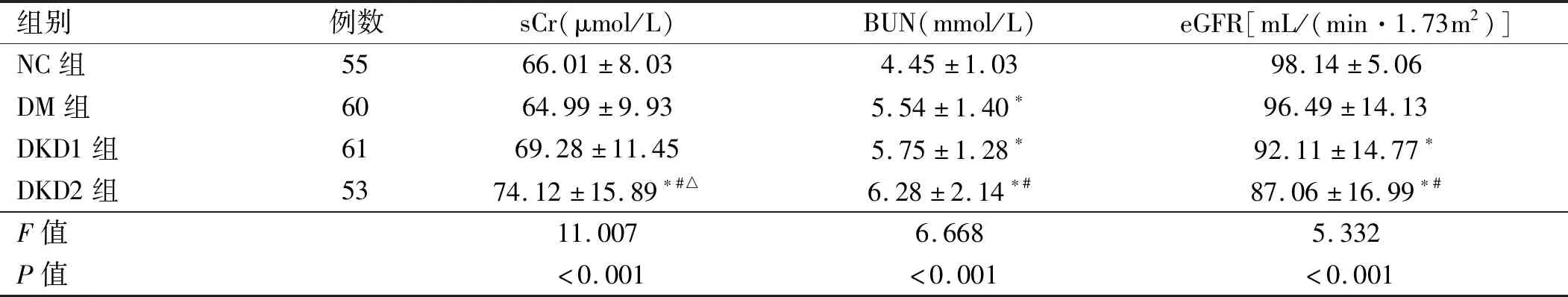
表3 4组研究对象肾功能比较

表4 3组糖尿病患者尿液相关指标比较
2.3 血清Ptx3及α-klotho蛋白与各指标间Spearman相关分析 根据Spearman相关分析,血清Ptx3水平与糖尿病病程、SBP、TG、sCr、BUN、FBG、HbA1c、HOMA-IR、UALB、UAER、UACR及24 h尿蛋白呈正相关(P<0.05),与eGFR、AST、TP、ALB及α-klotho蛋白呈负相关(P<0.05)。血清α-klotho蛋白水平与eGFR、AST、TP及ALB呈正相关(P<0.05),与糖尿病病程、SBP、TG、sCr、BUN、FBG、HbA1c、INS、HOMA-IR、UALB、UAER、UACR、24 h尿蛋白及Ptx3呈负相关(P<0.05)。见表5。
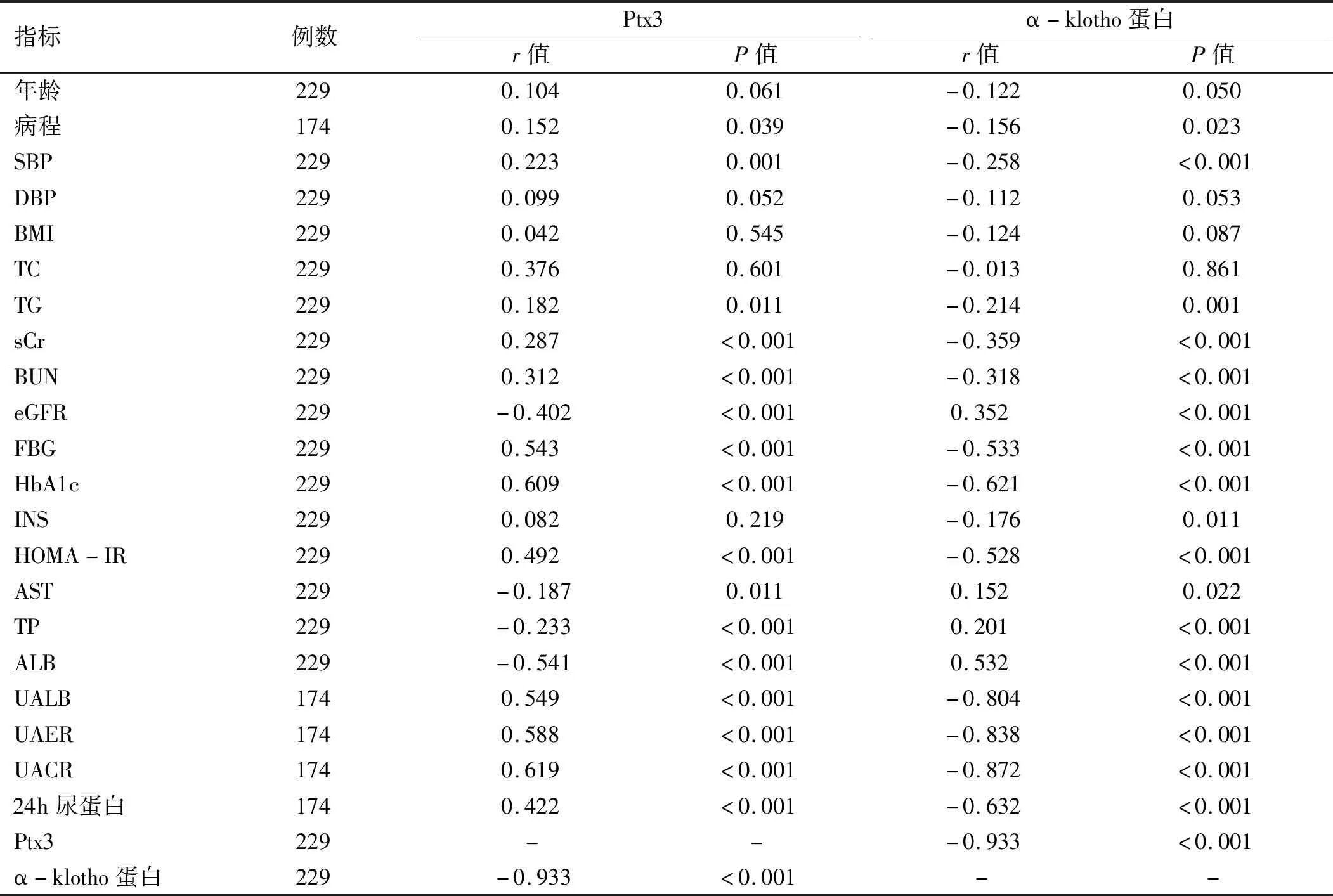
表5 血清Ptx3及α-klotho蛋白与各指标间Spearman相关分析
2.4 血清Ptx3及α-klotho蛋白水平的多元线性回归分析 分别以Ptx3、α-klotho蛋白为因变量,将Spearman相关分析后得出的差异有统计学意义的指标为自变量行多元线性回归分析,即Ptx3的自变量为病程、SBP、TG、sCr、BUN、eGFR、FBG、HbA1c、HOMA-IR、AST、TP、ALB、UALB、UAER、UACR、24 h尿蛋白及α-klotho蛋白;α-klotho蛋白的自变量为病程、SBP、TG、sCr、BUN、eGFR、FBG、HbA1c、INS、HOMA-IR、AST、TP、ALB、UALB、UAER、UACR、24 h尿蛋白及Ptx3,结果显示显著影响血清Ptx3表达的因素为α-klotho蛋白、eGFR、ALB及UACR(P<0.05)。影响血清α-klotho蛋白表达最显著的因素为UACR、Ptx3、24 h尿蛋白及eGFR(P<0.05)。见表6。
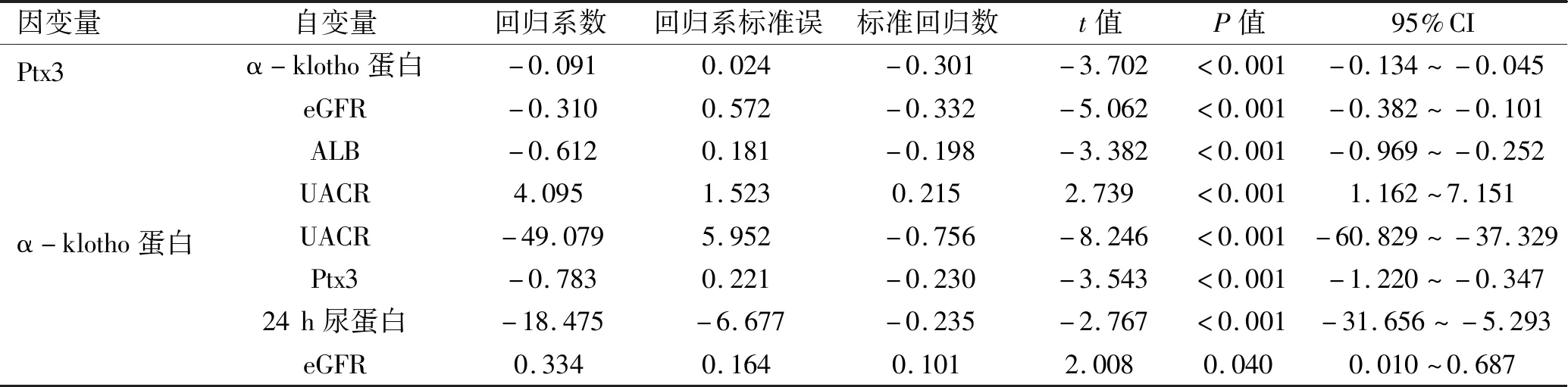
表6 血清Ptx3及α-klotho蛋白的多元线性回归分析
2.5 血清Ptx3及α-klotho蛋白水平对DKD的预测价值 分别以Ptx3及α-klotho蛋白浓度为检验变量,以分组有无糖尿病肾病为状态变量,默认状态变量数值为1,以敏感性为纵坐标,(1-特异性)为横坐标,绘制ROC曲线,将最接近左上方的点为最佳临界点。ROC结果显示Ptx3的AUC为0.84(95%CI 0.78~0.89,P<0.01),α-klotho蛋白的AUC为0.95(95%CI 0.93~0.98,P<0.01),选取敏感度与特异度之和最大者为截断值,Ptx3及α-klotho蛋白的最佳临界值分别为23.29 ng/mL及116.19 pg/mL,Ptx3的敏感度与特异度为67.50%及86.40%;α-klotho蛋白的敏感度与特异度为95.60%及84.50%。见图1。
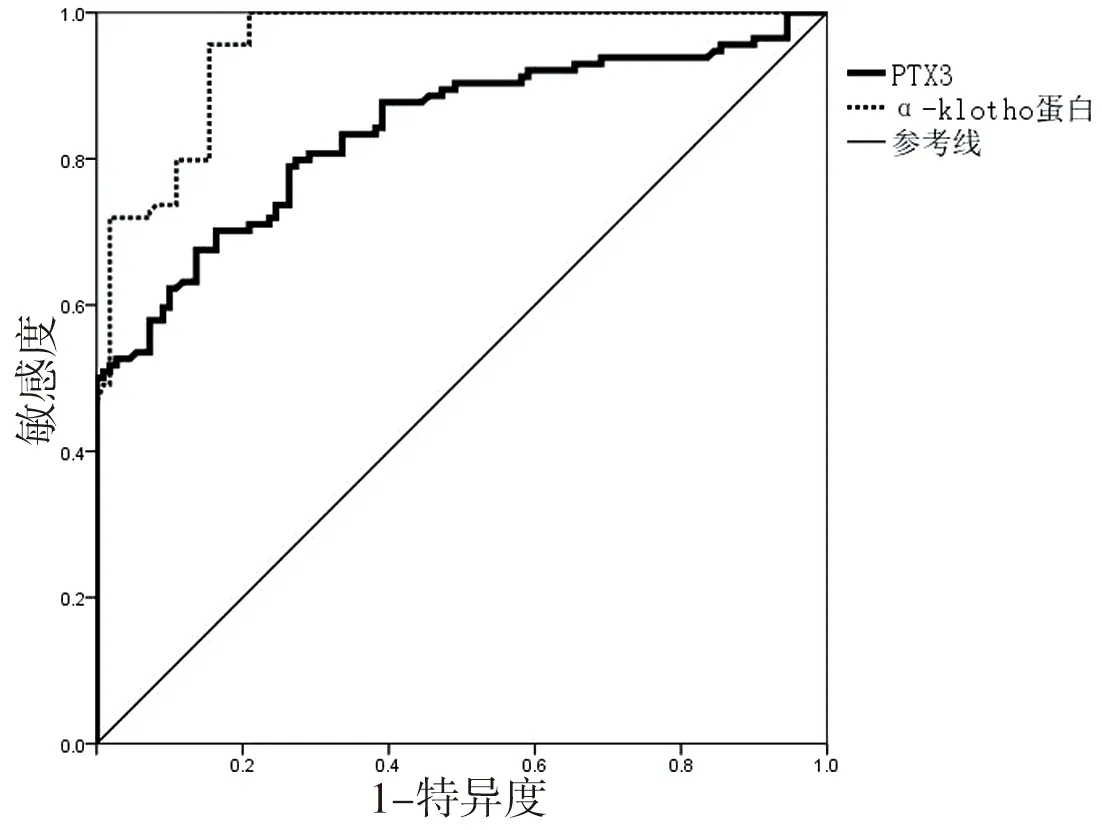
图1 血清Ptx3及α-klotho蛋白诊断DKD的ROC曲线
3 讨论
DKD是最常见的糖尿病微血管并发症之一,一旦进入大量蛋白尿期患者生活质量明显减低且预后不佳[9]。现如今尿微量白蛋白的增加和eGFR的下降被认为是提示DKD发生的主要指标[10],但是当这些指标异常时已发生了明显的肾损伤。因此,寻找能够早期发现及判断严重程度的血清生物学标志物对提高患者存活率意义重大。本研究探讨血清Ptx3和α-klotho蛋白的水平变化,并研究二者与多种影响因素的相关关系,进一步为DKD的早期诊治提供更多的思路。
Ptx3为长链正五聚体蛋白,可由肝脏细胞、肾脏原始系膜细胞及肾小管上皮细胞等表达[11]。研究[12]发现,该基因近侧启动子含有核转录因子-κB(nuclear factor κB,NF-κB)结合位点,NF-κB在炎症趋化因子、细胞黏附蛋白等有关DKD炎症机制起关键作用[13]。DKD患者血清Ptx3水平在eGFR指标尚未变化时就已升高,且与UAER呈独立正相关,提示血清Ptx3的水平可较早反映糖尿病肾脏损伤[14],DKD患者由于高血糖引起的氧化应激及炎症因子的表达导致肾脏病变发生[15]。本研究发现,与NC组比较,糖尿病各组的Ptx3水平升高,以DKD2组最高,说明Ptx3在肾脏炎症反应中起重要作用,随着病情加重炎症因子Ptx3的含量发生变化,Spearman相关分析结果提示Ptx3水平与患者长期血糖控制不佳、尿白蛋白的排出密切相关。多元线性回归分析发现,α-klotho蛋白、eGFR、ALB及UACR是血清Ptx3的独立影响因素,提示Ptx3可能通过增加糖尿病肾脏病患者肾小球滤过率、排泄尿白蛋白水平影响患者肾脏功能。
α-Klotho蛋白由α-klotho基因编码的跨膜蛋白[16],生理情况下可溶性α-klotho蛋白主要是由肾脏及心脑等组织表达,可通过调节抑制炎症反应及抗氧化衰老等途径发挥作用[17]。Su[18]等发现,α-klotho蛋白可通过抑制NF-κB途径、肾素-血管紧张素-醛固酮系统及转化生长因子-β1途径等信号通路,进而抑制炎症反应引起的肾脏纤维化。本研究血清α-klotho蛋白水平在糖尿病人群中显著下降,且以DKD2组最低,且α-klotho蛋白水平与eGFR呈正相关,而与糖尿病病程、BUN、sCr及UACR呈负相关,说明血清α-klotho蛋白可能反映长期慢性高血糖环境对肾脏功能的损伤,进而提示DKD的发生及病情的严重程度。α-klotho蛋白也可由胰岛β细胞特异性表达[19],保护β细胞功能,促进胰岛素分泌降低血糖,延缓肾脏疾病进程[20]。动物实验发现,缺失α-klotho基因的小鼠会明显出现内皮细胞损伤及能量代谢异常等变化,给予α-klotho蛋白补充后发现血管内皮细胞一氧化氮表达增加,逆转血管炎症反应保护肾脏功能[21]。本研究相关分析显示,α-klotho蛋白与糖尿病病程、FBG、HbA1c及Ptx3呈负相关,提示α-klotho蛋白可能抑制高血糖环境导致的肾脏炎症反应,减慢肾小球硬化、肾间质增殖与分化的进展速度,延缓DKD进程。ROC曲线分析血清Ptx3及α-klotho蛋白预测早期糖尿病肾脏病的发生均具有一定的诊断价值,且α-klotho蛋白较 Ptx3指标更有优势,间接提示两指标对糖尿病肾脏病筛查诊断价值提供帮助。
综上所述,血清Ptx3水平在糖尿病肾脏病患者体内均升高,血清α-klotho蛋白水平均降低,且与糖尿病肾脏病严重程度密切相关,UACR、eGFR为两者独立影响因素,两者可能参与糖尿病肾脏病的发生及判断严重程度,具体机制需进一步研究。但本研究样本量较小,各变量之间可能存在一定关联,有待继续增加样本量进行更全面的分析。
