酶解牛骨肽促进骨骼生长功效的研究
2020-09-10陈丽娜温宇旗韩国庆王耀新王继明杜芳魏鹏飞李颖苏秀兰
陈丽娜 温宇旗 韩国庆 王耀新 王继明 杜芳 魏鹏飞 李颖 苏秀兰


摘 要:采用低钙鼠粮饲喂Wistar大鼠,造大鼠低钙模型,口服给予模型组大鼠酶解牛骨肽3个月,研究酶解牛骨肽对低钙大鼠促进骨骼生长的作用,测定各实验组大鼠体重指数以及大鼠股骨重量、股骨强度、骨钙含量及血清钙离子含量等多项生理生化指标,同时做体外细胞实验,研究酶解牛骨肽对成骨细胞MC3T3-E1增殖情况的影响。结果表明:酶解牛骨肽对低钙大鼠骨钙含量水平的升高有明显作用(P<0.05),酶解牛骨肽可以在体外促进成骨细胞MC3T3-E1的增长,说明酶解牛骨肽在一定程度上能够促进骨骼生长发育。
关键词:酶解牛骨;多肽;低钙模型;成骨细胞
牛骨肽是酶解法获得的活性肽,其分子量易控制、没有苦味、分子量小(≤1 000 U),这些小分子肽不需消化直接吸收,与生物体相容性好,具有优于蛋白质和氨基酸的营养功能[1]。相较蛋白质抗原性低,不容易出现过敏现象,不容易发生变性而失去活性,相较于氨基酸风味更好,比游离氨基酸容易吸收。它具有良好的溶解性,且耐热、耐酸性好,同时不同来源和不同酶解工艺得到的小分子肽具有不同的生物活性,如免疫调节、降血压、降血糖、降血脂、抗菌、抗衰老、抗氧化、抗癌、抗微生物、抗毒素、增加骨密度、改善骨骼韧性等[2]。研究发现,骨骼中的蛋白质90%为胶原蛋白、骨胶原及软骨素,可以有效防止老年人随着年龄增加导致生理性的钙缺乏,骨胶原减少等现象,能起到促进皮层细胞代谢和防止人体老化的作用[3-5]。大鼠长期低钙饮食造成的大鼠低钙模型是目前研究营养因素导致钙缺乏使用最多的动物模型,本文研究牛骨肽对低钙模型大鼠增加骨密度的功效。体外细胞实验是一种广泛用于补钙促进骨骼生长研究的实验方案[6],该研究为探讨骨骼胶原蛋白肽补充机体钙质,增加骨骼强度,为研究骨骼胶原蛋白肽新功效,及牛骨肽方面的新产品提供科学依据。
1 材料与方法
1.1 材料
1.1.1 牛骨胶原蛋白肽的制备 制备工艺为:牛骨→前处理→脱脂(要求最终脂肪含量<5%→牛骨粉碎→过100目标准筛→提取骨胶料液比1∶ 5→氢氧化钠溶液调pH值至8.0→加入2 500U/g胰蛋白酶1%→50 ℃,酶解7 h→沸水高温灭活10 min→柠檬酸溶液调pH值至6.0→加入复配蛋白酶酶解,酶与底物比1%→50 ℃,酶解4 h→沸水高温灭活10 min→过滤5 000 r/min离心5 min→保留滤液→加少量蒸馏水清洗滤渣→活性炭脱色脱苦→冷冻干燥→牛骨多肽原液,得到的牛骨多肽原液多肽含量为2.1%,其中90%以上的多肽其分子量<1 000U。
1.1.2 试剂 胰蛋白酶,广西南宁庞博生物有限公司;复配蛋白酶,安占美-安琪酵母有限公司;硫酸铜、 硫酸钾、 硼酸、 氢氧化钠、 浓硫酸、 盐酸、 溴甲酚绿指示、甲基红指示剂 (以上试剂均为分析纯),国药集团化学试剂有限公司;硝酸、高氯酸、氧化镧、EDTA、碳酸钙、钙标准品,中国化学计量院;碳酸钠标准品,中国化学计量院;福林酚试剂盒,北京鼎国;朗迪碳酸钙D3颗粒,OTC,北京康远制药有限公司生产(生产批号20171207);低钙鼠粮、正常鼠粮、MC3T3-E1小鼠成骨细胞,中国科学院上海生科院细胞资源中心;胎牛血清(FBS),天津市灏洋生物制品科技有限公司;MTT,北京鼎国昌盛生物技术有限责任公司(批号:51L10156);DMSO、青链霉素双抗、DMEM培养基、胰酶,上海源叶生物科技有限公司。
1.1.3 仪器 精密卡尺;动物解剖器械;EX125DZH电子天平奥豪斯;红外石英消化炉SKD-20S2,上海沛欧分析仪器有限公司;SKD-800沛欧自动定氮仪,上海沛欧分析仪器有限公司;LDZM-80KCS-Ⅱ立式压力蒸汽灭菌锅,上海申安医疗器械;SY-300 型标准分析筛,新乡市筛分设备有限公司;XW-80A微型涡旋混合仪,上海沪西分析仪器;FE28数显酸度计,梅特勒托利多(中国)公司;BGZ-246 电热鼓风干燥箱,上海博迅;FW500 500 g高速中药粉碎机,天津华鑫仪器;YLS-16A小动物骨骼强度测定仪,北京众实迪创科技发展有限责任公司;DG50酶标仪,华东电子;XSP-ZCA电子显微镜。
1.1.4 实验动物 出生 4周的断乳Wistar大鼠72只,清洁级,体重60~75 g,雄性,每组12只。
1.2 方法
1.2.1 Wistar大鼠低钙模型的建立 参考保健食品检验与评价技术规范实施手册(2003版)[7]上的方案以及周轶琳等[8]方法,建立低钙大鼠模型。将出生4周的断乳Wistar大鼠适应1周后,禁食12 h,称体重,按体重随机分组,分笼饲养,实验设置:高(2倍中剂量)、中(以人体推荐剂量的5倍设置剂量)、低剂量组(1/2中剂量),同時设1个低钙对照组和与相应剂量受试物钙水平相同的碳酸钙对照组(如仅设1个碳酸钙对照组,推荐设立与高剂量钙水平相同的碳酸钙对照组)。低钙饲料标准(150 mg钙/100g饲料),同时饮用去离子水以避免从饮水中获得钙。
低钙对照组(模型组)每天饲喂低钙鼠粮,饮用去离子水,灌胃给予3.5 mL/(kg·d)蒸馏水,阳性药物碳酸钙对照组每天饲喂低钙鼠粮,饮用去离子水,按83 mg/(kg·d)灌胃给药;空白组大鼠每天正常饮食,饮用凉白开水,给予3.5 mL/(kg·d)蒸馏水;高、中、低剂量组每天饲喂低钙鼠粮,饮用去离子水,均按照3.5 mL/(kg·d)给予受试药物,牛骨酶解肽原液作为中剂量,高剂量在原液的基础上进行2倍浓缩,低剂量在原液基础上进行2倍稀释(表1)。实验大鼠饲养3个月,每3 d测1次体重,依据体重计算给药剂量。
1.2.2 实验大鼠股骨重量的测定 给药饲养3个月后,处死,剥离出右侧股骨,剥离股骨的时候注意要剥离完整的右侧股骨,包括股骨头部分(图1)。于105 ℃烤箱中烤至恒重,称量骨干重。
1.2.3 实验大鼠股骨强度的测定 首先确定股骨中点:测量股骨全长,通过其中点,沿横截面方向画一直线,此为股骨中点(截面),然后使用骨骼强度测定仪,对准中点位置测试股骨最大载荷。将大鼠骨骼取下后,剔除骨骼上附着的肌肉和韧带,使其保持清洁干燥,放置于载物架上,盖上防护盖,运行仪器,显示屏上显示骨骼从中点折断时所受的压力,即骨骼的最大横向承压力,通过骨骼力学性能检测,可以直接反映骨骼强度,间接反映骨密度。该试验是研究骨质疏松的有效手段,可以加快研究速度,降低研究成本,实现快速筛选药物和食品对骨骼组织影响情况。
1.2.4 大鼠骨钙含量的测定 骨骼中钙离子含量的测定,依照食品安全国家标准食品中钙的测定检测方法——第二法 EDTA滴定法测定[9-10]。钙与指示剂形成络合物,以 EDTA 滴定,在达到当量点时,在适当的pH 范围内,EDTA与钙形成稳定的金属络合物,指示剂游离,此时溶液呈现游离指示剂的颜色,所以根据EDTA用量,计算钙的含量。试样中钙的含量按式(1)计算:
式(1)中:X——试样中钙的含量(mg/kg或 mg /L);T——EDTA 滴定度(mg/mL);V1——滴定试样溶液时所消耗的稀释10倍的 EDTA 溶液的体积(mL);V0——滴定空白溶液时所消耗的稀释10倍的 EDTA 溶液的体积(mL);V2——试样消化液的定容体积(mL);1 000——换算系数;M——试样质量或移取体积(g或 mL);V3——滴定用试样待测液的体积(mL)。
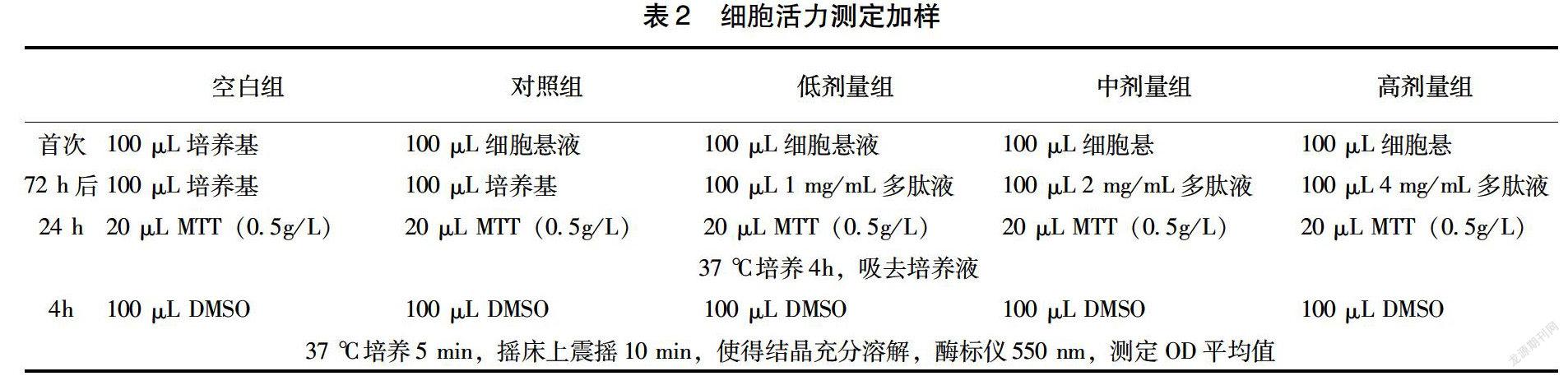
1.2.5 酶解牛骨肽对MC3T3-E1成骨细胞的增殖作用 本实验通过体外培养小鼠成骨细胞实验,探讨酶解牛骨胶原肽对成骨细胞增殖作用的影响,研究胶原短肽的增加骨密度功能。取酶解牛骨胶原蛋白肽适量,用PBS缓冲液稀释,使浓度成为1、2、4 mg/mL的胶原蛋白肽溶液。MC3T3-E1细胞在含有10%胎牛血清和青链双抗(100×,使用时100倍稀释,使得青霉素终浓度为100 U/mL,链霉素终浓度为100 μg/mL)的DMEM完全培养基中培养,37 ℃,5%的二氧化碳恒温培养箱中培养。每3 d换1次培养液,培养5~6 d后做细胞传代。吸去原培养基,用PBS溶液清洗2~3次,然后加入0.5 mL 0.25%的含有1 mmol/L EDTA-4Na的胰蛋白酶,37 ℃消化30 s,显微镜下观察细胞收缩情况,细胞变圆,不再贴壁,且成单一个体,不连接成片,加入10 mL DMEM培养基终止消化,轻轻反复吹打细胞,使细胞悬浮,将液体转移至灭菌离心管中,1 000 r/min,离心5 min,吸去上清液,加入适量培养液,轻轻吹打,将细胞均匀的悬浮于液体培养基中,然后进行细胞计数,稀释,计数,使得培养液中的细胞浓度为1×105/mL,然后将已知细胞浓度的培养液,加入96孔板中,加样量为100 μL/孔,分为空白组(调零)、对照组、低剂量组、中剂量组、高剂量组等5个组,每组设定6个复孔。按照表2进行加样操作。实验需要注意,MTT一般最好现用现配,或是将MTT配制成0.5 g/L的溶液,小剂量分装到EP管中,用避光袋或锡纸等可以遮光的材料包裹好,避免被光分解,-20 ℃长期保存,避免反复冻融。
1.3 统计分析方法
采用SPSS软件进行ANOVA方差分析,LSD多重比较。
2 结果与分析
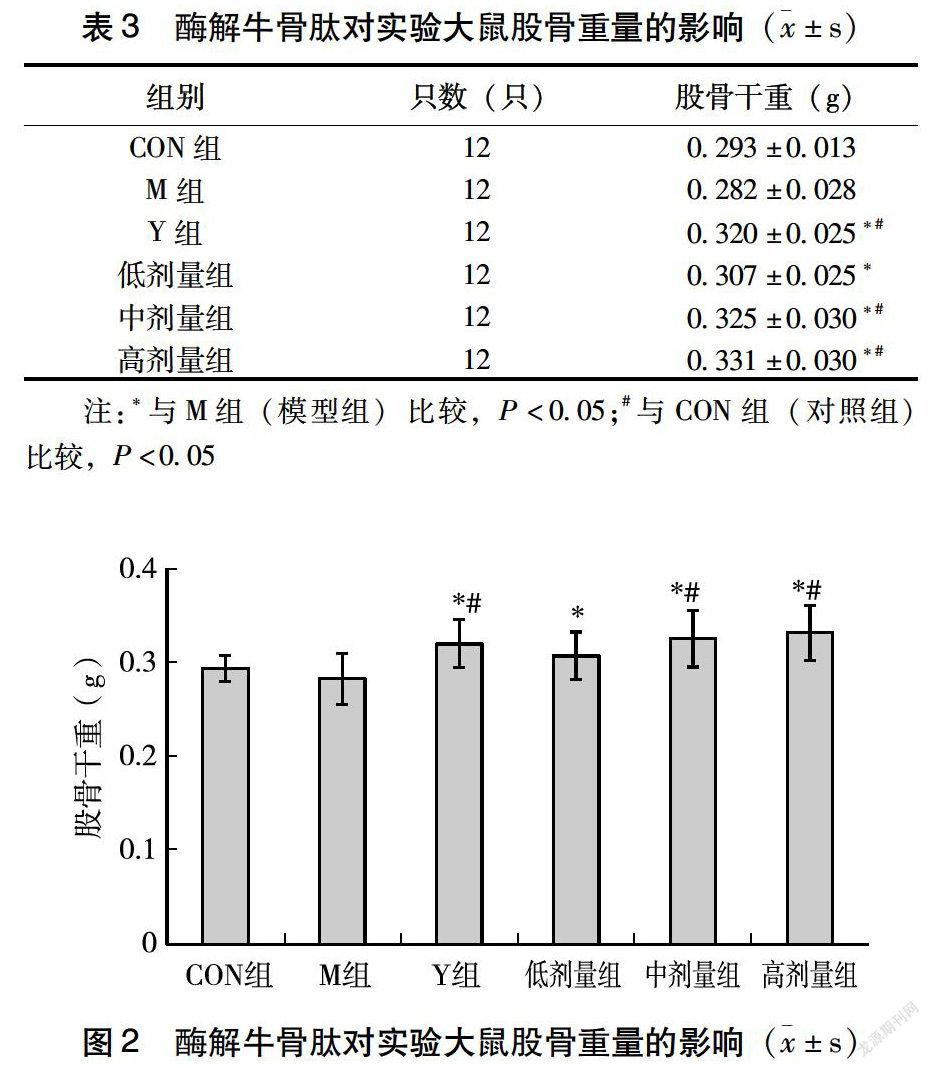
2.1 酶解牛骨肽对大鼠股骨重量的影响
与M组对比,阳性药碳酸钙D3颗粒对大鼠股骨重量的影响具有显著性差异,低剂量组、中剂量组、高剂量组均有显著性差异;与CON组(正常饲养对照组)相比,阳性药组、中剂量组、高剂量组的受试药物对大鼠股骨长度和股骨重量的影响具有显著性差异(表3、图2)。
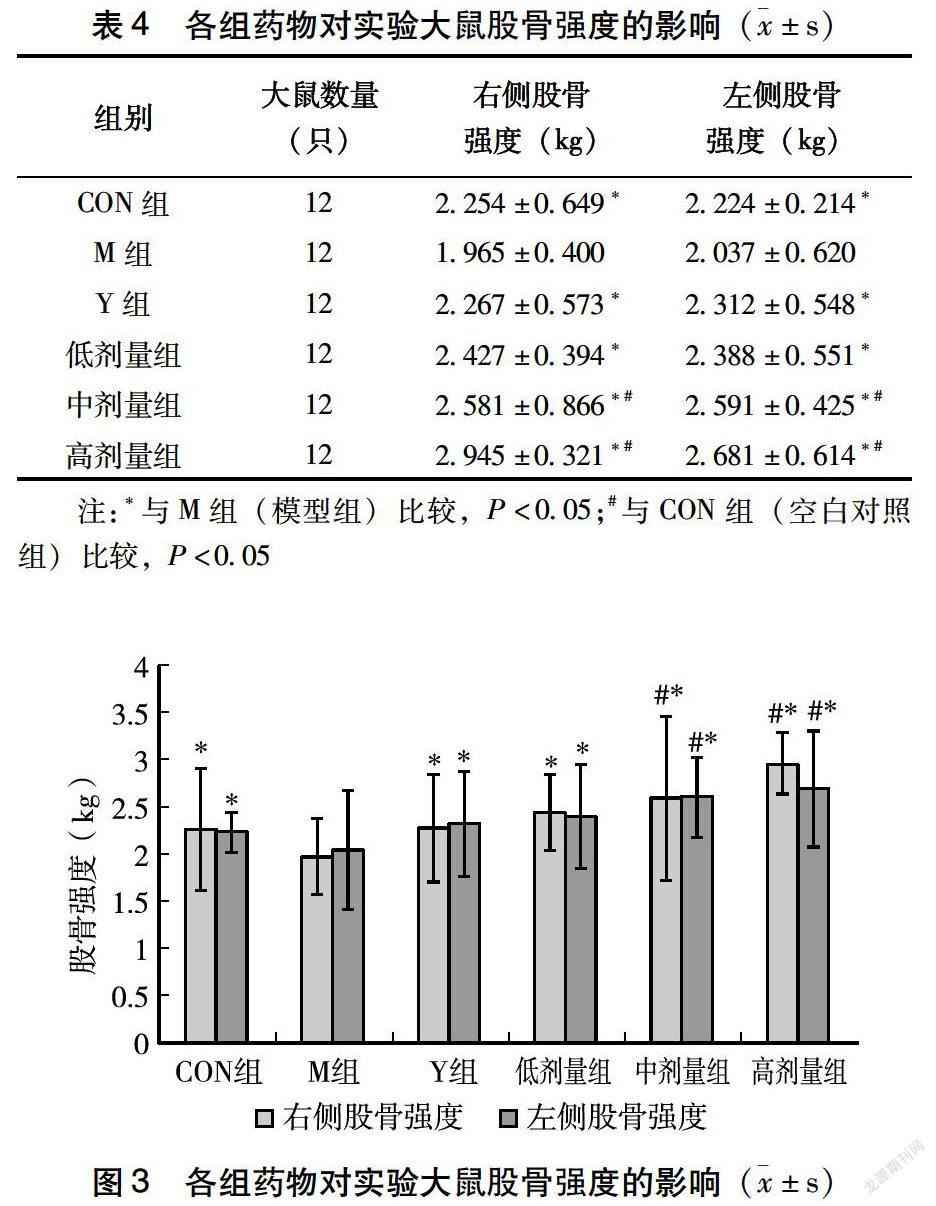
2.2 酶解牛骨肽对大鼠股骨硬度的影响
由表4、图3可知,与M组(低钙模型组)对比,阳性药碳酸钙D3颗粒对大鼠左右股骨强度的影响均具有显著性差异,低剂量组、中剂量组、高剂量组均有显著性差異,空白组,即正常饲养组股骨强度有显著差异,说明造模成功;与CON组(正常饲养对照组)相比,阳性药组、中剂量组、高剂量组的受试药物对大鼠左右股骨强度的影响具有显著性差异。
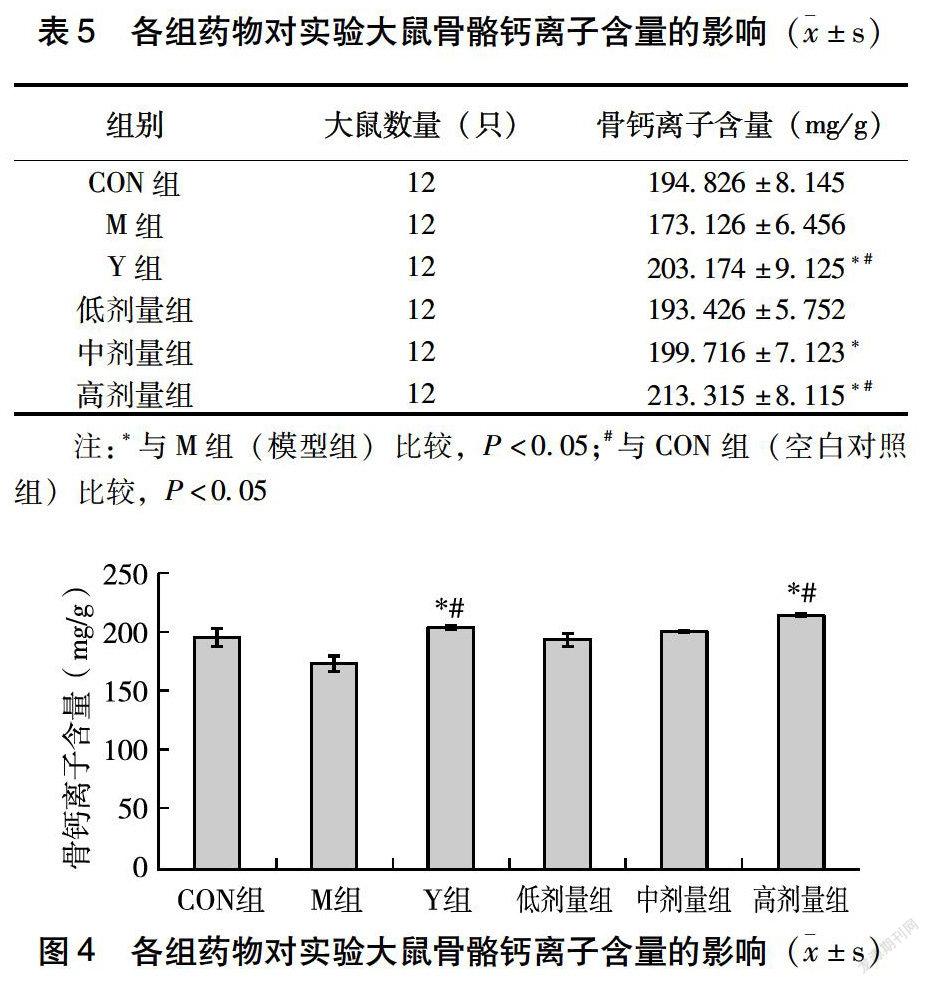
2.3 酶解牛骨肽对大鼠骨骼含钙量的影响
由表5、图4可知,与M组(低钙模型组)对比,阳性药碳酸钙D3颗粒对大鼠骨骼中钙离子含量的影响具有显著性差异,中剂量组、高剂量组也具有显著性差异,低剂量组比低钙模型组骨骼中钙离子含量高,但是在P<0.05时不具有显著性差异;与CON组(正常饲养对照组)相比,阳性药碳酸钙D3颗粒对大鼠骨骼中钙离子含量的影响具有显著性差异,高剂量组也具有显著性差异,中剂量组无显著性差异,但是钙离子含量比CON组(正常饲养对照组)高,低剂量组与CON组(正常饲养对照组)相比没有明显差异。
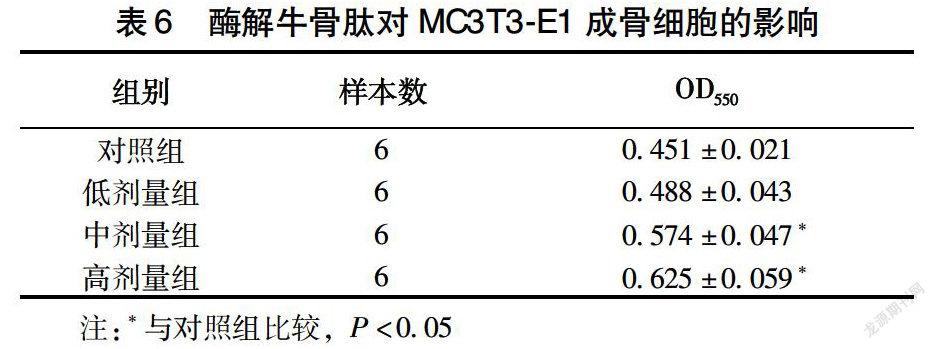
2.4 酶解牛骨肽对MC3T3-E1成骨细胞的影响
由表6、图5可知,与对照组相比,P<0.05,中剂组量组和高剂量组的吸光度值有显著性差异,对照组是在96孔板上正常培养的细胞,经过MTT反应后测得的吸光度值,反映了经过72 h生长后活细胞的数量,各个剂量组是在正常培养的细胞中,加入低、中、高剂量的酶解多肽,经过72 h培养后,发现吸光度值比对照组有所增加,且中剂量组与高剂量组与对照组相比,其活细胞数具有显著性差异(P<0.05)。正常情况下,细胞培育72 h后,在这一段时间内,细胞会发生一系列生理生化反应,经历生长、增长、衰老、凋亡等一系列变化,整个体系中会存在凋亡的细胞,也有正在生长的活细胞,通过MTT法可以检测到体系中活细胞的数量,以吸光度值(OD值)间接反映活细胞数量,OD值越大,说明活细胞数量越多,以上数据显示,与对照组相比,中剂量组和高剂量组活细胞数更多,且存在统计学意义,说明中剂量和高剂量的酶解多肽对体外培养小鼠成骨细胞的增殖活性具有较强的促进作用。成骨细胞是形成骨组织的细胞,合成并分泌骨基质,参与骨的钙化,口服胶原蛋白水解物能提高骨骼的新陈代谢和骨密度,低分子量的胶原肽以肽的形式被吸收进入血液,并能通过增加骨骼的有机物部分达到治疗骨质疏松的效果[11-12]。
3 讨论
以上动物实验数据分析结果表明,酶解牛骨肽可以增加大鼠股骨强度,增加股骨中钙离子含量,促进大鼠钙离子的吸收,促进MC3T3-E1成骨细胞的增殖。实验设立了模型组,空白组(正常饲养组),高、中、低剂量组,阳性药组,长时间低钙饮食可以造成Wistar大鼠暂时性的缺钙,正常饮食的实验大鼠体内钙离子含量与造成低钙模型后给予低剂量酶解牛骨肽后体内钙水平相当,说明当大鼠缺钙时,可以通过恢复正常饮食补钙,也可以通过服用酶解多肽快速补钙,高、中剂量组大鼠体内骨钙含量高于正常饲养组,酶解骨肽可以提高正常饮食大鼠骨钙含量,说明大鼠需要额外摄入钙离子,以满足生长需要,给予中剂量和高剂量牛骨酶解肽组大鼠体内钙离子水平相差不大,但是说明高剂量的钙离子不能被人体全部利用,当钙离子满足人体正常生理需求之后,就不再增加,多余的钙离子不沉积在骨骼上,而是被代谢排出体外,因为钙的代谢受多种因素调节和影响,摄入的钙只有一部分能被肠道吸收,多余的都随粪便排出体外[13]。酶解牛骨肽可以促进成骨细胞的增殖,促进骨细胞的生长,对大鼠生长有促进作用,动物骨钙含量和骨强度都明显增加,而且不低于碳酸钙对照组,说明该药物具有增加骨密度的功效。该酶解牛骨肽既可以增加骨密度,提高骨骼强度,又可以促进骨细胞的快速生长,促进骨的快速形成。1986年Harvey提出了新的钙吸收理论,认为钙先是与肠道内的氨基酸或者短链多肽结合,然后再以整体的分子状态被吸收,已有大量试验证明,多肽可以与金属离子结合进入粘膜细胞,促进机体对矿质元素的吸收,推测在大鼠的消化肠道内,酶解牛骨肽也可以与钙离子发生结合形成可溶性复合物,避免钙离子的沉淀,保证钙离子能顺利到达钙吸收位点被大鼠吸收[14-16],从而提高骨钙含量。酶解牛骨肽可以促进成骨细胞快速生长,推测其对骨细胞表现出类生长因子作用。酶解牛骨肽促进骨骼生长及增加骨骼强度等作用机理仍需做进一步验证和研究。◇
参考文献
[1]邹远东.酶法多肽:人类健康卫士[M].知识产权出版社,2015:7-8.
[2]庞广昌,陈庆森,胡志和,等.蛋白质的消化吸收及其功能评述[J].食品科学,2013,34(9):375-391.
[3]张根生,王子谛,郭洁,等.畜禽骨骼营养成分提取分离技术及应用进展[J].肉类研究,2011,25(12):49-50.
[4]肖厚荣,杨红,黄书铭,等.牛骨和鹿骨中氨基酸分析与比较[J].食品科技,2015,40(3):170-175.
[5]孙肖明,孟宪梅,霍学芹.小肽的吸收机制与营养功能的研究进展[J]. 畜牧与饲料科学,2011,32(7):31-32.
[6]蒋智然.胶原肽的制备及其促进成骨细胞增殖分化活性的研究[D]. 南宁:广西大学,2014.
[7]卫生部.保健食品检验与评价技术规范实施手册[M].卫生部,2003:776-779.
[8]周轶琳,赵敏,谭剑斌,等.保健食品增加骨密度动物模型的建立及应用研究[J].中国热带医学,2007(7):328-331.
[9]中华人民共和国国家标准GB 5009.92—2016[S].
[10]郭利萍,周小刚.国标食品中钙含量滴定测定方法的优化[J].食品工业,2012,33(5):130-132.
[11]Watanabe-Kamiyama M,Shimizu M,Kamiyama S,et al.Absorbtion and effectiveness of orally administered low molecular weight collagen hydrolysate in rats [J]. Journal of Agricultura and Food Chemistry,2010,58(2):835-841.
[12]Ohara H,Iida H,Ito K,et al.Effect of Pro-Hyp,a coaalgen hydrolysate-derived peptide,on hyaluronic acid synthesis using in vitro cultured synovium cells and oral ingestion of collagen hydrolysates in a guinea pig model of osteoarthritis[J]. Bioscience Biotechnology and Biochemistry,2010,74(10):2096-2099.
[13]谢静.自制猪骨胶原多肽对去卵巢骨质疏松大鼠与成骨细胞增殖的影响[D]. 长沙:湖南农业大学,2009.
[14]卢玉坤.鳕鱼皮胶原蛋白肽的促钙吸收作用研究[D].山东青岛:中国海洋大学,2013.
[15]刘中天,刘吉华,洪勇,等.不同来源鹿茸肽对成骨细胞作用的比较[J]. 中国生化药物杂志,2012,44(6):701-705.
[16]程妍.骨膠原蛋白酶解工艺及骨营养粉对大鼠补钙功效的研究[D].兰州:甘肃农业大学,2009.
Abstract:Using low-calcium rat food to feed Wistar rats,the low-calcium model was created,and the rats in the oral model group were given enzymolysis of bovine bone peptide for 3 months.The effects of enzymolysis of bovine bone peptide on bone growth in low-calcium rats were studied.The body mass index and weight of the femur of rats in each experimental group were determined.A number of physiological and biochemical indicators such as femur strength,bone calcium content,and serum calcium ion content were also performed in vitro cell experiments to study the effect of enzymatic hydrolysis of bovine bone peptide on the proliferation of osteoblasts MC3T3-E1.The results showed that the enzymatic hydrolysis of bovine osteopeptide had significant effect on the increase of bone calcium in low calcium rats(P<0.05),enzymatic hydrolysis of bovine bone peptide can promote the growth of osteoblasts MC3T3-E1 in vitro,indicating that enzymatic hydrolysis of bovine bone peptide can promote bone growth and development to a certain extent.
Keywords:enzymatic hydrolysis of bovine bone;peptides;low calcium model;osteoblasts
