核桃肽提高SAMP8小鼠生存质量和寿命的研究
2020-09-10樊蕊杜倩郝云涛徐美虹李勇
樊蕊 杜倩 郝云涛 徐美虹 李勇


摘 要:目的:评估核桃肽对衰老和老龄小鼠生存质量和寿命的改善作用。方法:取60只SAMP8小鼠随机分为4组,包括模型对照组和低、中、高剂量3个核桃肽干预组,另设SAMR1小鼠作为正常对照组。通过摄食量、饮水量、体重的变化,以及体脂含量、代谢率、脏器指数,评估其生存质量的改善;通过衰老评分表征其衰老特征和程度;通过寿命分析,表征核桃肽对SAM小鼠寿命的影响。结果:模型对照组小鼠体重、肌肉率均低于正常对照组和各剂量干预组,低剂量干预组腓肠肌质量、呼吸商和代谢率均显著高于模型对照组(P<0.05)。低剂量组生存率和寿命大于模型对照组。结论:低剂量核桃肽缓解SAMP8小鼠衰老、提高生存质量、延长其寿命的效果较明显。本研究对核桃肽延缓衰老的深入研究提供了科学依据。
关键词:SAMP8;衰老;寿命;生存质量;核桃肽
快速老化小鼠SAM是日本京都大学Takeda教授经过20多年精心培育得到的一种近交系衰老模型鼠,包括SAMP(SAMP)和SAMR(SAMR)两种品系[1]。SAMP在进入成熟期(约4~6月龄)后迅速出现行动反应迟缓、被毛光泽减退、脱毛、皮肤溃疡、眼周损害、角膜溃疡、白内障、脊柱弯曲等老化特征,P8是SAMP系中的一个亚系,主要以学习记忆能力障碍为老化特征,其寿命约为12.1个月,是目前比较理想的自然衰老模型小鼠 [2-3]。
目前对于核桃的加工与利用主要是核桃油的加工,但其剩余的核桃粕仍然含有大量的蛋白质,其蛋白质氨基酸组成合理,具有极高的营养价值。利用現代生物酶解技术,对核桃蛋白质进行水解,进一步分离纯化,制备而来的核桃肽(WP),具有高吸收、高活性且安全性高的优点,具有广阔的开发前景和应用价值。实验证实,WP具有显著的抗氧化活性[4-5],能够提高小鼠体内的 SOD 和 GSH-Px,同时降低小鼠体内MDA含量[6]。同时,核桃多肽可以降低D-半乳糖诱导老年小鼠血脂水平[7]。目前对WP的研究多集中在其抗氧化等生理活性方面,而对于衰老的机制其中包活氧化应激理论研究较少。因此,对于WP对衰老的影响研究势在必行。本研究就WP对SAMP8小鼠衰老进程以及生存质量的影响予以探析,以期揭示WP改善增龄带来的生存质量的下降,为衰老的营养干预提供科学依据。
1 材料与方法
1.1 材料
WP:淡黄色固体粉末,主要成分为分子量小于1 000的小分子低聚肽,其中谷氨酸、天冬氨酸、精氨酸、亮氨酸含量较多,由北京天肽生物科技有限公司提供。
1.2 实验动物及饲养条件
4月龄SPF级雄性SAMP8小鼠60只,相同月龄的SAMR1小鼠20只,由北京大学医学部实验动物中心提供[动物合格证号:SCXK(京)2011- 0012],SPF级动物房,单笼饲养,饲养环境温度21~23 ℃,湿度50%~60%。喂饲普通小鼠生长饲料,所有动物自由饮水进食。动物喂养及实验严格按照《北京市实验动物管理条例》执行,并经过北京大学医学部伦理委员会审核通过(批准号:LA2017017)。
1.3 方法
1.3.1 动物分组和饲养 小鼠适应性喂养1周,按照体重随机分为4组,即SAMP8模型对照组,WP低、中、高剂量干预组[WP(A)、WP(B)、WP(C)]。同时采用同月龄SAMR1小鼠作为正常对照组。对照组给予普通饮水,WP干预组分别给予低、中、高浓度WP(浓度依次为110、220、440 mg/kg·BW),均随饮水摄入。所有动物均自由饮水进食,并记录每日饮水量、进食量及体重变化。
1.3.2 动物一般状态观察及体格指标测定 每周观测并记录动物的活动度、毛发光泽、摄食量、饮水量、体重。
1.3.3 脏器指数 各组小鼠饲养临近至寿命终点时,小鼠称重后脱颈椎处死,无菌快速剥离腓肠肌及其他肌肉,记录腓肠肌质量、其他肌肉质量。分别取并称重小鼠的心脏、肝脏、肾脏、脾脏、胸腺,计算脏器指数。脏器指数=脏器重(g)/体重(kg)
1.3.4 爬网实验 分别在小鼠70周龄时,将小鼠放在垂直的金属网上,金属网(长度1.5 m、宽度0.5 m)置于距地面0.5 m处,记录每只小鼠在金属网上停留时间。
1.3.5 老化度评分 采用日本京都大学竹田俊男和细川昌则教授制定的老化度评分标准[8]适当修改,分别将小鼠外在形体及行为的老化改变从外观衰老(光泽及粗糙程度、脱毛程度)、组织病变(皮肤溃病、眼周损害、白内障、阴茎、肿瘤、断尾)、体态衰老(脊柱后凸、颤抖)、反应迟钝(反应性、被动逃避)等12项进行综合评价,再根据严重程度不同,将每项指标标定分值,客观进行评分,分值越高则老化度越高。
1.3.6 呼吸代谢 取70周龄的各组小鼠放在TSE LabMaster 呼吸代谢分析系统的树脂检测笼内,每个检测笼每次只放1只,测前称定小鼠体质量,供应新鲜的空气保持室内充分干燥,湿度不超过70%,室温控制在20~25 ℃,实验人员不能频繁地进出房间,以免影响测量的准确性,采样流速持续控制在0.80 L/min。测定结束后,计算呼吸商(RER)和产热。RER是单位时间内的二氧化碳的产量与耗氧量之比:RER=VCO2/VO2,其中VCO2是指单位时间内与参比笼相比,测试笼产生的二氧化碳的量;VO2是测试笼消耗氧气的量,是反映机体能量代谢的重要指标,根据TSE LabMaster 呼吸代谢分析系统计算参数[9],呼吸代谢作为反映能量代谢特征最直接的指标,与机体的功能调节有着非常密切的关系。
1.3.7 体脂成分测定 将70周龄的小鼠称重后,放置在相应型号的透明塑料动物舱内,动物舱插入Echo MR ITM(上海汇佳生物科技有限公司)内,扫描得到小鼠的肌肉和脂肪含量。
1.4 统计分析
所有数据应用SPSS统计软件进行分析,结果以±s表示,采用单因素方差分析,两组间比较采用最小显著差异法(LSD),P<0.05为统计检验界值。用SPSS 18.0对小鼠生存状态进行寿命表和Kaplan-Meier分析。
2 结果与分析
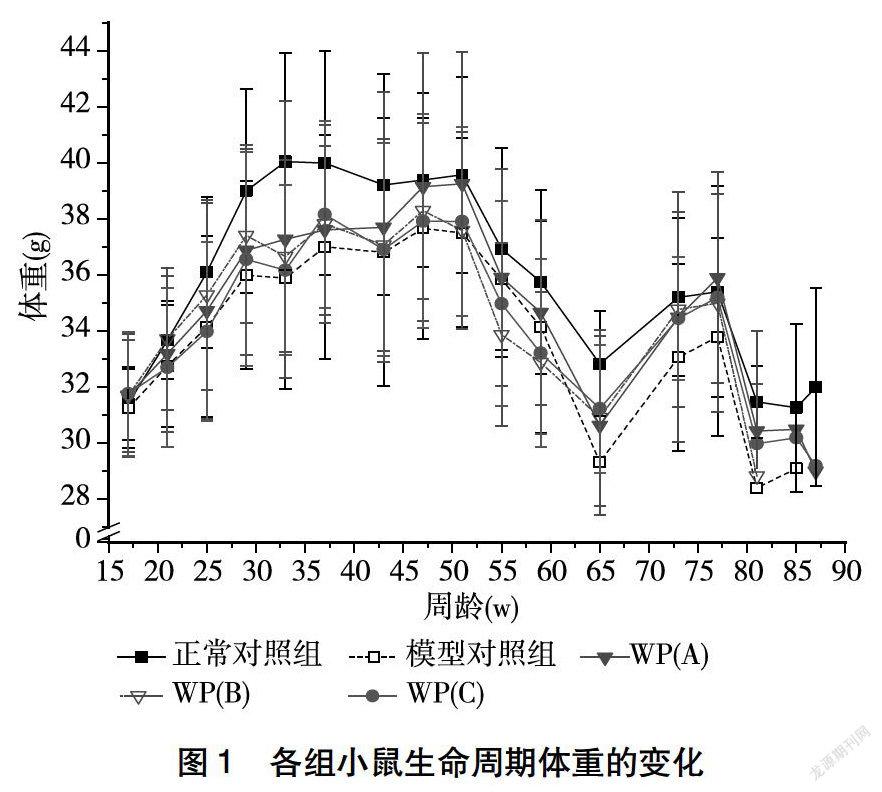
2.1 各组SAM小鼠体重变化
由图1可以看出,随着SAM小鼠周龄的增加,其体重呈现先增加后降低的趋势,各组小鼠体重的变化大体趋势相似,但是在整个生命周期中,模型对照组小鼠整体体重均低于正常对照组和各干预组。整个生命周期,小鼠体重经历了增长期Ⅰ、降低期Ⅰ、增长期Ⅱ和降低期Ⅱ。各组小鼠体重变化期间的差别主要集中在体重增长期Ⅰ,即正常对照组小鼠在17~33周龄时,体重呈现曲折增加的趋势,而模型对照组小鼠体重則在17~45周之间呈现曲折增加的趋势,但低、高剂量干预组SAMP8小鼠体重增长期Ⅰ均延长至49周,随着周龄的增加,之后体重变化时期经历的时间相同。
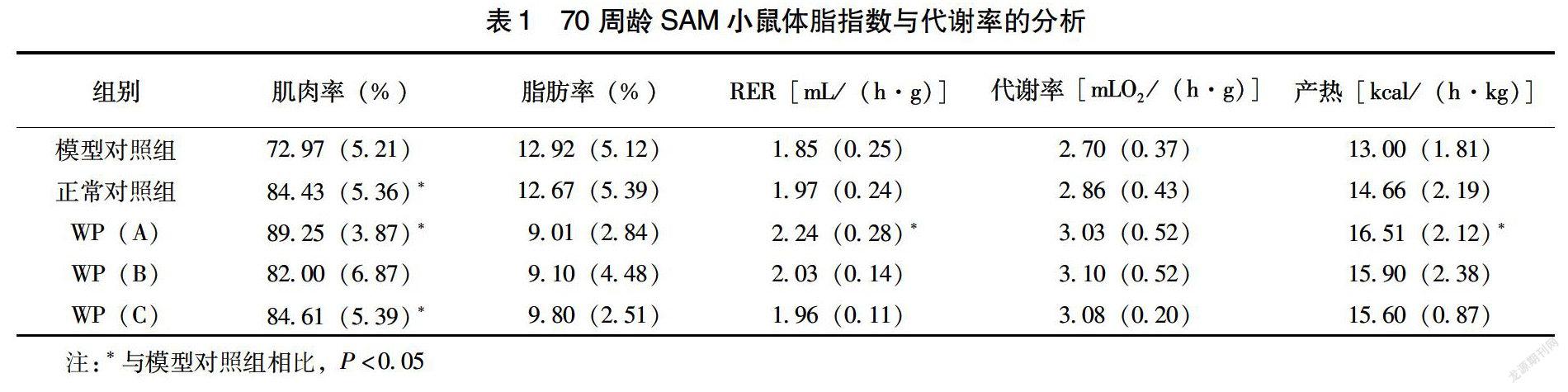
由表1可知,各组SAM小鼠肌肉率呈现显著差别,其中,模型对照组小鼠肌肉率最低,显著低于正常对照组小鼠和低、高剂量干预组小鼠(P<0.05),而低剂量干预组小鼠肌肉率最高为89%。同时,模型对照组小鼠的脂肪率高于正常对照组和各剂量干预组小鼠,甚至各剂量干预组小鼠的脂肪率低于正常对照组小鼠,但未呈现统计学差异(P>0.05)。模型对照组小鼠RER最低,其显著低于低剂量干预组小鼠(P<0.05),而各剂量干预组小鼠的代谢率均高于对照组小鼠,但未存在统计学差异(P>0.05),同时,各剂量干预组小鼠产热均高于对照组小鼠,其中,低剂量干预组小鼠与模型对照组小鼠存在统计学意义(P<0.05)。
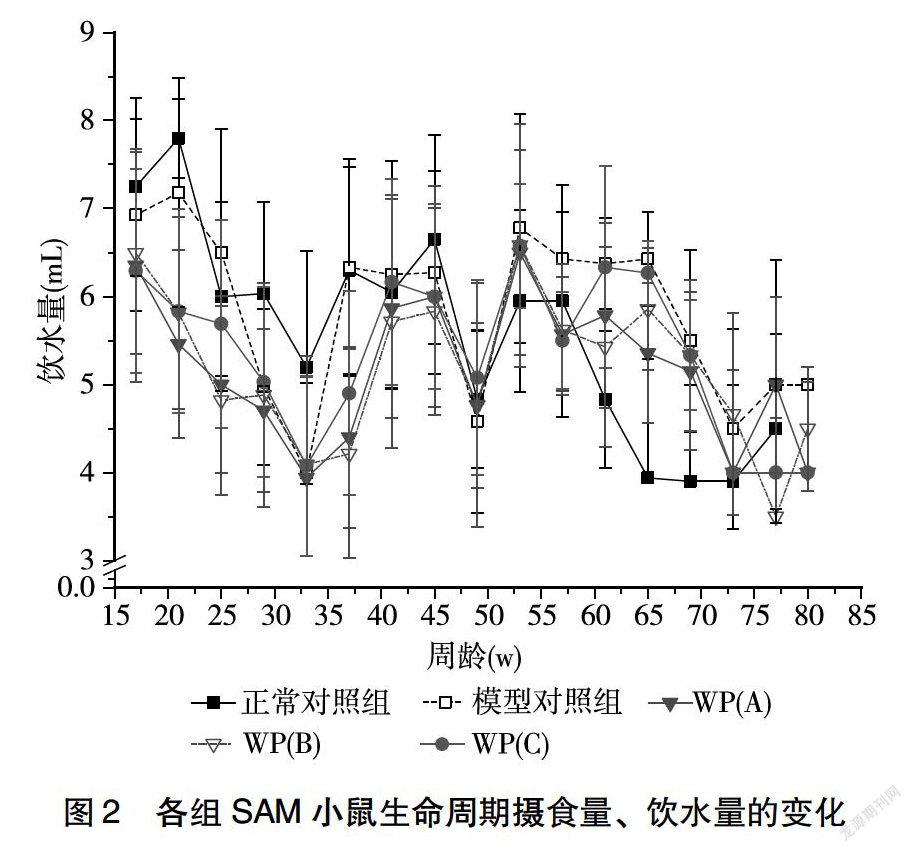
2.2 各组SAM小鼠摄食量、饮水量的变化
由图2可以看出,从整体趋势看,各剂量干预组小鼠摄食量>模型对照组>正常对照组,且随着整个生命进程,各组小鼠摄食量呈现降低趋势。各剂量干预组小鼠摄食量显著下降期出现在34~45周龄,而正常对照组和模型对照组小鼠摄食量下降期持续更长至54周,在45~70周龄的各剂量干预组小鼠摄食量呈现曲折变化,当正常对照组和模型对照组小鼠经历了摄食量增加期(54~74周)后,各组小鼠摄食量再一次出现下降的趋势。从整体趋势看,在50周前,正常对照组饮水量>模型对照组>各剂量干预组,而随着周龄增加,模型对照组>各剂量干预组>正常对照组。在17~21周之间,模型对照组和正常对照组小鼠饮水量增加,而后随着周龄增加,各组小鼠饮水均呈现降低趋势,直至34
周后,经历一个短暂的饮水量增加期后,各组饮水量又经历了急剧下降,在50~55周之间,各组饮水量小幅升高后再一次呈现降低趋势。
2.3 各组SAM小鼠脏器指数
由表2可知,临近寿命终点的模型对照组小鼠的肝脏指数、脾指数、肾指数均小于正常对照组和各剂量干预组小鼠,其中正常对照组小鼠的肾脏指数显著高于模型对照组和各剂量干预组小鼠(P<0.05),模型对照组小鼠的胸腺指数显著低于中剂量干预组小鼠(P<0.05),但其显著高于正常对照组和高剂量干预组小鼠(P<0.05)。而各组小鼠的心脏指数并无特征性差异(P>0.05)。
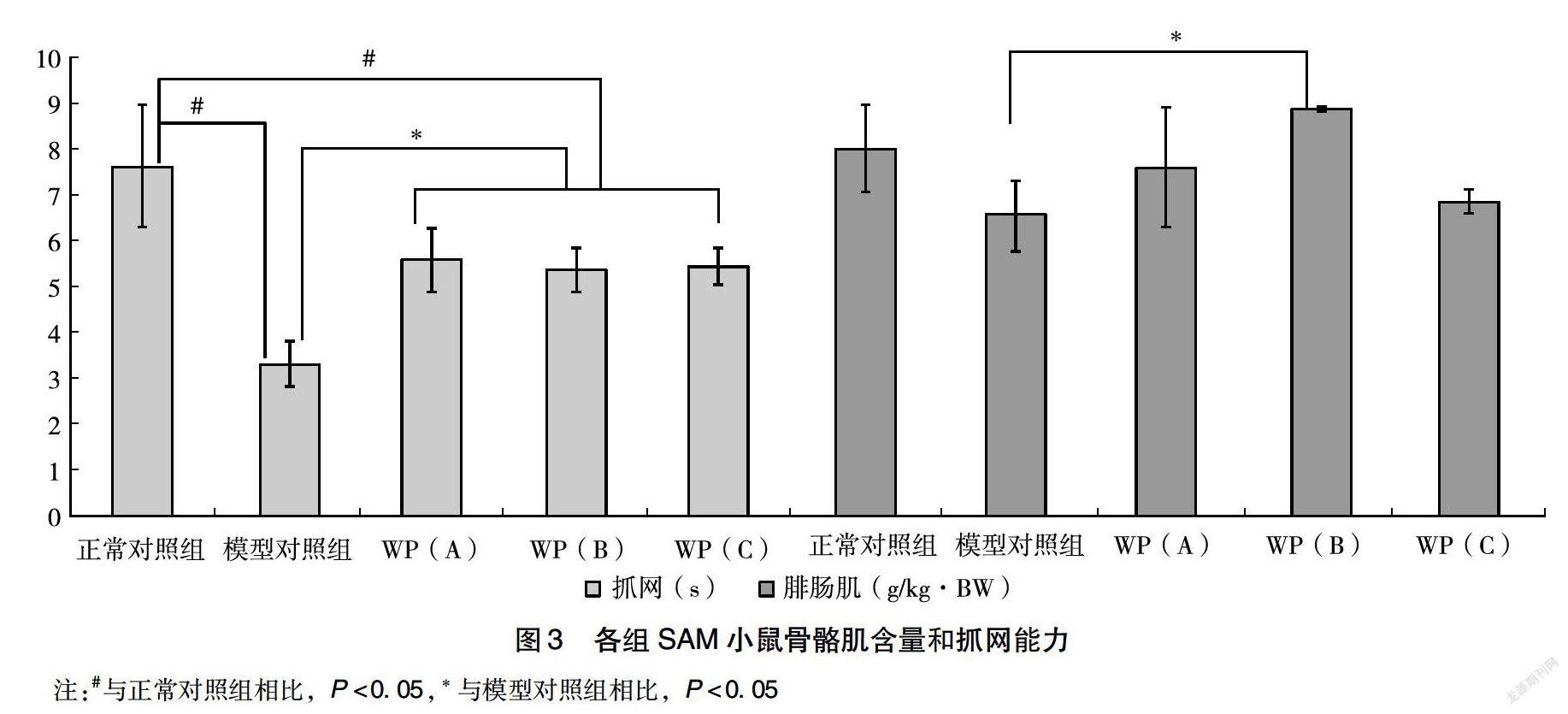
2.4 各组SAM小鼠运动能力和骨骼肌含量比较
由图3可以看出,临近寿命终点的模型对照组小鼠的腓肠肌质量均小于正常对照组和各剂量干预组小鼠,其中,模型对照组小鼠的腓肠肌质量显著低于中剂量干预组小鼠(P<0.05),相似现象也反映在其抓网能力,模型对照组小鼠抓网能力显著低于各剂量干预组和正常对照组小鼠(P<0.05),同时,虽然各剂量干预组小鼠抓网能力均有改善,但其依然显著低于正常对照组小鼠(P<0.05)。
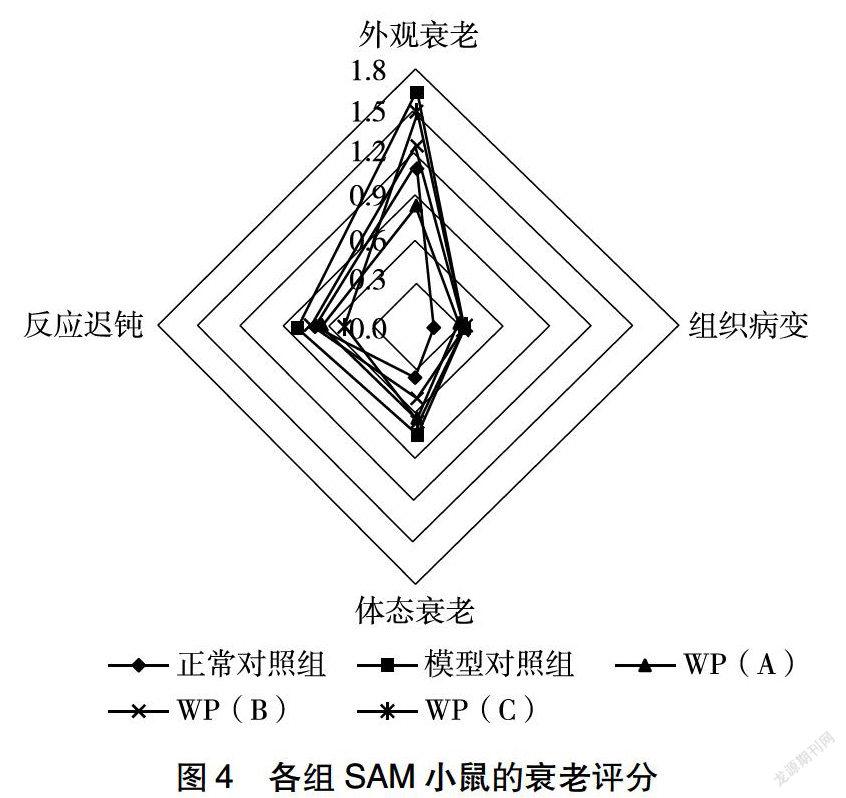
2.5 各组SAM小鼠衰老程度评价
从图4可以看出,70周龄的SAM小鼠衰老表现在外观衰老、体态衰老、组织病变和反应迟钝方面,除组织病变方面,各剂量干预组和模型对照组小鼠表现相当,其严重程度均高于正常对照组小鼠,其中外观衰老、体态衰老和反应迟钝方面的衰老程度,模型对照组均表现为最明显。在反应方面,各剂量干预组的评分较低,在外观和组织病变方面,低剂量干预组和正常对照组得分较低。可见,低剂量WP缓解SAMP8小鼠衰老的效果较明显。
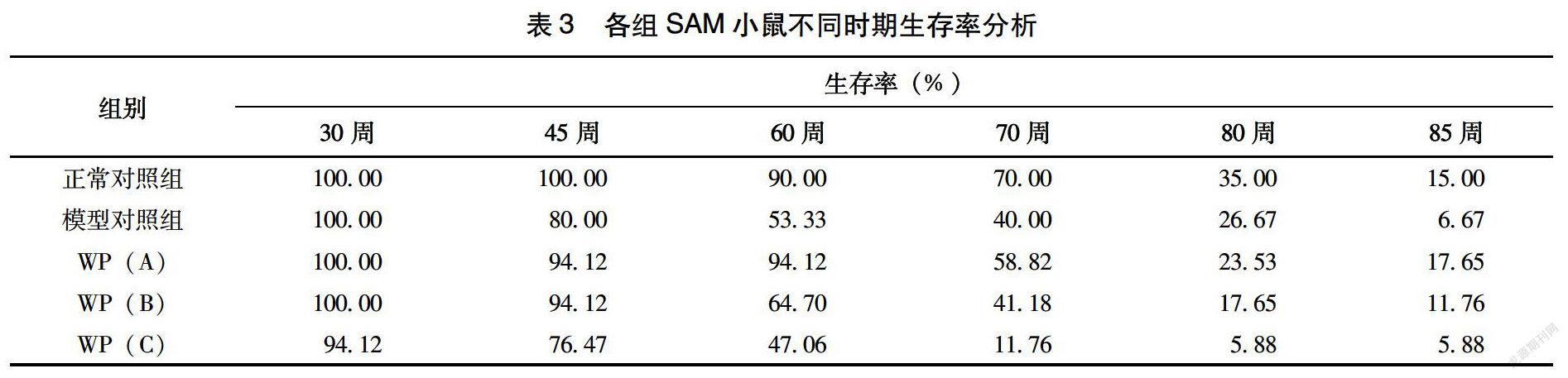
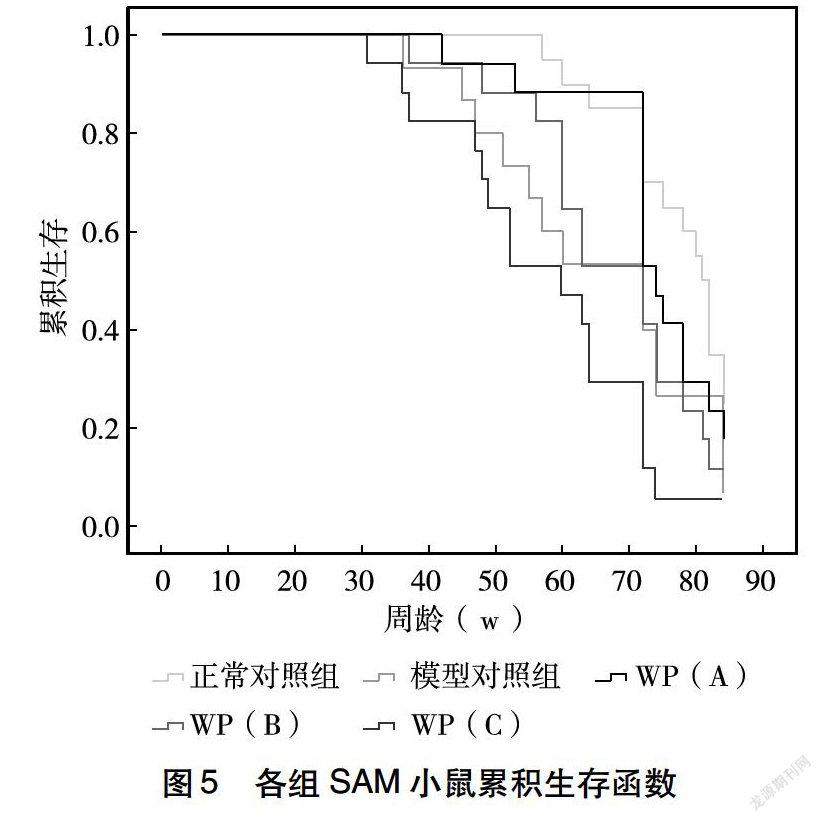
2.6 SAM小鼠寿命分析
由表3可以看出,最早出现死亡的为高剂量干预组,当喂养60周时,正常对照组和低剂量、中剂量干预组存活率较高,其中低剂量干预组存活率达到94%,甚至高于正常对照组,当寿命终点时,依然是低剂量存活率最高。
由图5可知,正常对照组小鼠在55~56周龄时,开始出现死亡,此时段死亡比例为5%,但模型对照组小鼠在34~35周龄时,便开始出现死亡,此时段死亡比例为7%。在整个生命进程中,模型对照组小鼠在40~60周龄之间,其生存率急速下降,而正常对照组小鼠在60~67周龄之间、73~80周龄之间出现两个死亡率急速上升期。通过WP进行干预后,其衰老进程减缓。低、中、高剂量干预组小鼠分别在40~41周、45~46周、29~30周龄出现死亡,此时段死亡比例分别为6%、7%和6%。且52周龄时,低、中、高剂量干预组累计生存比例分别为94%、88% 、53%,在饲养60周后,低、中、高剂量干预组累计生存比例分别为88%、65%、47%,其中,低剂量干预组生存率远远高于模型对照组的生存比例,甚至高于正常对照组的生存比例。由图5可以看出,低剂量干预组死亡率急剧增加期与正常对照组,同样发生在70周。通过分析,正常对照组、模型对照组以及低、中、高剂量干预组小鼠的中位数生存时间分别为79、70、74、71、60周。通过生存函数曲线可以看出,模型对照组较正常对照组和低剂量干预组小鼠的生存率下降更快,通过Log Rank (Mantel-Cox)(P<0.05)、Breslow (Generalized Wilcoxon)(P<0.05)、Tarone-Ware(P<0.05)分析,可知正常对照组小鼠以及各剂量干预组的生存率均显著高于模型对照组小鼠。
3 讨论
SAM系小鼠所表现出的特异性与衰老直接相关的病理生物学表型与许多人类老年性疾病的病理改变类似[10-11]。因此,SAMP8小鼠是研究衰老与学习记忆功能障碍作用机制以及探讨神经内分泌免疫调节平衡的较理想模型。动物自然衰老时,其体重和体力不断下降,记忆力逐渐减退,行动变得迟缓。动物体重的下降是由于构成机体的主要物质如蛋白质、核酸、脂肪的代谢率下降,合成量少于分解量,结构物质的不断损耗,使细胞结构受到破坏,細胞间及细胞质中的水分失去依托也逐渐丧失,因而体重下降。本研究发现,随着周龄的增加,模型对照组在24周时体重开始出现下降,而WP(A)干预,在51周之前,体重呈现持续增长,表明其有效地延迟了衰老伴随的体重减轻,并且在整个生命周期,WP各干预组的体重均高于模型对照组,其中WP(A)效果更加显著。与之对应,整个生命周期,干预组摄食量高于模型对照组,甚至正常对照组小鼠,这在一定程度上表明WP提高了衰老小鼠的生存质量。
从图3临近寿命终点的模型对照组小鼠的腓肠肌质量均小于正常对照组和各剂量干预组小鼠,70周龄的模型对照组小鼠抓网能力低于各剂量干预组和正常对照组小鼠。体力的下降是由于骨骼肌中蛋白质合成量不足,细胞结构破坏后氧化磷酸化功能受损,ATP合成减少所致[12]。研究表明,随着年龄的增长,机体通常会出现脂类代谢紊乱,而这种紊乱可导致体重增加,脂肪含量增加[13]。本研究显示,各剂量干预组肌肉质量高于模型对照组和正常对照组,腓肠肌含量也高于对照组,而体脂率低于模型对照组和正常对照组。一方面,衰老的程度加深,骨骼肌内自由基积累增多,肌蛋白分解增加,导致骨骼肌组织总蛋白含量的降低,文献报道,WP具有显著的抗氧化作用,提高血清中SOD活力,降低MDA含量,从而提高SOD/MDA 比值,降低骨骼肌脂褐素的含量,可以有效提高机体的抗氧化能力,减少自由基的生成,减轻大鼠机体衰老的程度[4-6];另一方面,随着年龄的增长,骨骼肌蛋白更新率下降,骨骼肌中蛋白质合成减少而分解增加,最终导致衰老机体骨骼肌蛋白含量的减少,而肽的吸收和利用均强于蛋白质,因此,可以补偿衰老带来的负担平衡。
衰老的免疫学假说认为,免疫功能的衰退是造成机体衰老的重要原因。胸腺和脾是重要的免疫器官,其内脏在一定程度上可以反映一个身体的免疫功能[14]。本研究显示,通过WP干预,可以提高SAMP8小鼠的胸腺和脾脏脏器指数,这一结论不仅表现在对于衰老小鼠的免疫调节上,对于免疫低下小鼠和正常小鼠补充核桃提取物和WP依然可以提高其免疫器官的脏器指数[6,15],有利于促进体液免疫和细胞免疫应答提高其免疫力,不少学者通过实验证实,生物活性肽具有提高免疫的作用,可能的机制为提高小鼠免疫力是通过增强Th细胞功能、促进体内抗体生成以及抑制Tr细胞功能而实现的[16-17]。
文献报道,SAMP8平均生存期限为12~13个月,4~6月龄后开始出现衰老征象,故9月龄已进入老化阶段[18]。通过WP进行干预后,其衰老进程减缓。低剂量干预组生存比例远远高于模型对照组,甚至高于正常对照组。SAMR1、SAMP8对照组小鼠以及低、中剂量干预组小鼠和正常对照组的中位数生存时间均高于模型对照组。低、中剂量干预组的生存率均显著高于模型对照组小鼠。有文献报道,二甲双胍对延长SAMP8雄性小鼠的寿命起到积极的作用。通过中剂量组二甲双胍干预的SAMP8小鼠12月龄生存率达到70%[19-20],而本研究发现,经过低剂量WP干预,自然生长的SAMP8小鼠12月龄的生存比例为均大于90%。日本两项研究表明,SAMP8小鼠摄入1975年的日本膳食模式,可以显著延长其寿命,其周龄80周时,其生存率为22%。此生存率与本研究中低剂量WP干预的SAMP8小鼠寿命相当[21]。在膳食中加入葵花籽油和鱼油,虽然可以小幅度的延长SAMP8寿命(中位数生存时间分别为葵花籽油56周、鱼油48周),但其效果并没有WP显著[22]。
实验证实,机体对于衰老的调节,可以通过多种通路(AMPK 通路[23-24]、Nrf2/ARE信号通路[25]、RhoA/Rho激酶通路[26])共同进行,降低氧化应激,可以调节以上通路中的因子[27-28]。推测WP延缓SAMP8小鼠衰老的机制部分源于其抗氧化性[4-5]。对于WP延缓衰老的机制将在后续研究中予以探索。◇
参考文献
[1]Takeda T,Matsushita T,Kurozumi M,et al.Pathobiology of the senescence-accelerated mouse (SAM)[J]. Experimental Gerontology,1997,32(1-2):117-127.
[2]Takeda T.Senescence-accelerated mouse (SAM):a biogerontological resource in aging research[J]. Neurobiology of Aging,1999,20(2):105-110.
[3]Miyamoto M.Characteristics of age-related behavioral changes in senescence-accelerated mouse SAMP 8 and SAMP 10[J].Exp Geront,1997,32(1-2):139-148.
[4]Chen N,Yang H,Sun Y,et al.Purification and identification of antioxidant peptides from walnut (Juglans regia L.)protein hydrolysates[J]. Peptides,2012,38(2):344-349.
[5]Ren D,et al.Antioxidant hydrolyzed peptides from Manchurian walnut (Juglans mandshurica Maxim.)attenuate scopolamine-induced memory impairment in mice[J]. Journal of the Science of Food and Agriculture,2018(98):5142-5152.
[6]崔玲玉.长白山核桃蛋白肽的制备及功能活性研究[D].长春:吉林农业大学,2013.
[7]郝常艳.核桃多肽的制备条件优化及其抗氧化活性研究[D]. 太原:山西大学,2014.
[8]Hosokawa M,Kasai R,Higuchi K,et al.Grading score system:A method for evaluation of the degree of senescence in Senescence Accelerated Mouse (SAM)[J]. Mechanisms of Ageing & Development,1984,26(1):91-102.
[9]Vrang N,et al.PYY(3-36)reduces food intake and body weight and improves insulin sensitivity in rodent models of diet-induced obesity[J]. Am J Physiol Regul Integr Comp Physiol,2006,291(2):R367.
[10]Shinde V,et al.Ageing and its different perspectives[J].Pharmacognosy Reviews,2007,1(2):265-270.
[11]Kiso M,Manabe N,Komatsu K,et al.Abnormal structural luteolysis in ovaries of the senescence accelerated mouse (SAM):expression of Fas ligand/Fas-mediated apoptosis signaling molecules in luteal cells[J]. Journal of Reproduction & Development,2003,49(6):457.
[12]Sack CA,et al.Antioxidant treatment with phenyl-alph a-tert-butylni rone improves the cognitive perfromance and survival of aging rats[J].Neurosci Lett,1996,205(2):18.
[13]Brunk U T,Teman A.Lipofuscin:mechanisms foagerelated accumulation and influence on cell function [J]. Free Radic Biol Med,2002,33(5):611-619.
[14]Yang Q,Xie Y,Depierre JW.Effects of peroxisome proliferators on the thymus and spleen of mice[J].Clinical and experimental immunology,2000,122(2):219-226.
[15]盛強,秦侠.核桃仁水提液对免疫功能低下模型小鼠免疫功能的影响[J]. 中国中医药科技,2006,13(4):242-243.
[16]杨睿悦,张召锋,裴新荣,等.海洋蛋白肽对小鼠免疫调节作用的实验研究[J]. 中华预防医学杂志,2008,42(4):221-226.
[17]何丽霞,刘睿,任金威,等.吉林人参低聚肽的免疫调节作用[J]. 科技导报,33(18):62-66.
[18]乌兰,刘睿,杜倩,等.核桃肽对小鼠抗疲劳作用的研究[J]. 中国食物与营养,2018,24(12):50-53.
[19]Shino A,Tsukuda R,Omori Y,et al.Histopathologic observations on the senescence-accelerated mice (SAM)reared under specific pathogen free conditions[J]. Acta Pathol Jpn,2010,37(9):1465-1475.
[20]田枫,张颖,李文婷,等.二甲双胍对快速老化模型SAMP8小鼠行为学及生存率的影响[J]. 中国老年学杂志,2017,37(19):4722-4723.
[21]Yamamoto K,Shuang E,Hatakeyama Y,et al.The Japanese diet from 1975 delays senescence and prolongs life span in SAMP8 mice[J]. Nutrition,2016,32(1):122-128.
[22]Tsuduki T,et al.Long-term intake of fish oil increases oxidative stress and decreases lifespan in senescence-accelerated mice[J]. Nutrition,2011,27(3):334-337.
[23]Lin W S,Chen J Y,Wang J C,et al.The anti-aging effects of Ludwigia octovalvis on Drosophila melanogaster and SAMP8 mice[J]. Age,2013,36(2):689-703.
[24]Vingtdeux V,et al.AMPK signaling activation by resveratrol modulates amyloid-beta peptide metabolism[J]. Journal of Biological Chemistry,2010,35(8):500-504.
[25]Tomobe K,Shinozuka T,Kuroiwa M,et al.Age-related changes of Nrf2 and phosphorylated GSK-3β in a mouse model of accelerated aging (SAMP8)[J]. Archives of Gerontology & Geriatrics,2012,54(2):e1-7.
[26]Fengqin Y,et al.Effect of RhoA/Rho-kinase on the expression of anti-aging klotho protein in the brain of mouse[J]. Stroke and Nervous Diseases,2010,17(1):3-6.
[27]Wang C H,Wu S B,Wu Y T,et al.Oxidative stress response elicited by mitochondrial dysfunction:implication in the pathophysiology of aging[J]. Experimental Biology & Medicine,2013,238(5):450-460.
[28]Na H K,Surh Y J.Modulation of Nrf2-mediated antioxidant and detoxifying enzyme induction by the green tea polyphenol EGCG[J]. Food & Chemical Toxicology,2008,46(4):1270-1278.
Abstract:Objective To evaluate the effect of walnut peptide(WP)on improving the life quality and life span of SAMP8.Method Totally 60 SAMP8 were randomly divided into 4 groups including the model control group,low,middle and high-dose WP intervention group,and the senescence accelerated resistant mouse (SAMR 1)were the normal control group.The improving in the life quality during the life cycle of SAM series mice was evaluated by the food intake,water intake,body weight,body fat content,metabolic rate and organ index.The aging characteristics and degree were characterized by the aging scores,and the effect on the life span was investigated by life span analysisResult The weight and muscle rate of the model control group were lower than those in the normal control group and each intervention group,and the gastrocnics muscle mass,respiratory quotient and metabolic rate in the low-dose intervention group were significantly higher than those in the model control group(P<0.05).The survival rate and life span in the low-dose group were higher than those in the model control group.Conclusion The low-dose WP intervention showed the obvious influences of improving the aging,life quality and life span in SAMP8 mouse.This paper provideed scientific evidence for the further study on the anti-aging effect of WP.
Keywords:SAMP8;aging;life span;life quality;walnut peptide(WP)
