喹诺酮类抗生素对两种水生生物氧化应激系统的影响研究
2020-09-10郑栋赫杨雷沈洪艳
郑栋赫 杨雷 沈洪艳
摘 要:为探究水生生物受喹诺酮类抗生素影响的作用机制,选取2种典型的喹诺酮类抗生素——氧氟沙星和诺氟沙星,将斜生栅藻和斑马鱼分别置于其溶液中暴露,在第5,10,15 d,检测并比较氧氟沙星和诺氟沙星质量浓度为0,30,60,120,360 mg/L时对斑马鱼和斜生栅藻体内SOD和CAT氧化应激指标的影响。结果表明:喹诺酮类抗生素对斑马鱼和斜生栅藻SOD活性的影响趋势相似,说明斑马鱼和斜生栅藻SOD活性受影响的程度基本相同;喹诺酮类抗生素对斑马鱼和斜生栅藻CAT活性的影响呈现不同趋势,说明不同水生生物维持体内细胞抗氧化环境平衡的能力不同;喹诺酮类抗生素对斑马鱼试验组SOD活性、CAT活性影响的最大值及最小值均高于斜生栅藻试验组,说明2种喹诺酮抗生素对斑马鱼和斜生栅藻SOD活性和CAT抗氧化应激反应强度的影响存在明显差异。研究结果为进一步研究喹诺酮类抗生素对水生生物的生态毒性效应提供了科学根据。
关键词:环境毒理学;斑马鱼;斜生栅藻;氧氟沙星;诺氟沙星;SOD;CAT
中图分类号:X171.5 文献标识码:A
文章編号:1008-1542(2020)04-0374-07
doi:10.7535/hbkd.2020yx04011
氧氟沙星(OFXL)和诺氟沙星(NFXL)都属于喹诺酮类抗生素,普遍用于疾病防治[1]。环境中的抗生素一方面来源于工业污染[2],另一方面来源于生活和生产,科研人员对此进行了大量研究。例如,李彦文等[3]检测出广州市蔬菜中含有喹诺酮药物残留;章强等[4]发现养殖业用于生物体治疗的抗生素随粪便等进入了环境中。在海洋水体环境[5]、水产养殖场废水[6]、山东境内地表水[7]及深圳河[8]都曾检出过喹诺酮类抗生素且处于高浓度水平范围[9-11]。此外,土壤中的抗生素对土壤生态也有着重要影响[12]。
2011年,王荻等[13]研究了诺氟沙星对鲟鱼体内超氧化物歧化酶(SOD)活性的影响。结果表明,当诺氟沙星质量分数为40 mg/kg时,SOD活性出现最大值。喹诺酮抗生素容易引起动物细胞活性发生变化[14],导致人类SOD含量显著下降[15]。抗生素是微生物的代谢产物,对藻类具有抑制作用和毒性[16-18]。陈柳芳[19]采用不同浓度的氧氟沙星处理斜生栅藻,发现其半数致死量均高于50 mg/L,安全质量浓度为5 mg/L以下。研究表明,抗氧化防御系统能够保持机体内自由基的平衡[20-22],使系统内的SOD将氧自由基转化成H2O2和O2[23]。抗氧化防御系统对于活性氧自由基的清除能力也反映出机体的生理生化状况[24]。
SOD活性和过氧化氢酶(CAT)活性是生物氧化应激系统的重要指标。本文采用室内试验方法,将斜生栅藻和斑马鱼分别置于诺氟沙星和氧氟沙星溶液中暴露,通过测定并比较斜生栅藻和斑马鱼SOD活性和CAT活性2项生化指标,分析喹诺酮类抗生素对水生生物氧化应激系统的影响。
1 试验材料
1.1 试验生物
斑马鱼,购自当地水产市场,平均体长为(4.0±0.2)cm,平均体质量为(0.22±0.03)g,试验前用曝气3 d的脱氯自来水驯养斑马鱼7 d,水温为(25±1)℃,pH值为6.8~7.5。
斜生栅藻(FACHB-13),购自中国科学院淡水藻种库,采用BG-11型培养基扩大培养,置于人工气候培养箱中,设置水温为(25±1)℃,pH值为6.8~7.5,光照昼夜比为12 h/12 h。
1.2 喹诺酮类抗生素
氧氟沙星,购自上海阿拉丁生化科技股份有限公司,CAS:100986-85-4,纯度大于98%;诺氟沙星,购自上海阿拉丁生化科技股份有限公司,CAS:70458-96-7,纯度大于98%。
1.3 测定试剂盒
SOD试剂盒(羟胺法)、CAT可见光试剂盒(可见光法)、蛋白定量测定试剂盒(考马斯亮蓝法),均购自南京建成生物工程研究所。
2 试验方法
2.1 生物培养
设置喹诺酮类抗生素的质量浓度为0.2,0.4,0.6,0.8,1.0 g/L,试验周期为96 h,探究斑马鱼急性毒性96 h-EC50。利用Origin 8.0软件对斑马鱼死亡率进行线性拟合,进而求得喹诺酮类抗生素对斑马鱼在不同质量浓度的死亡率。
由喹诺酮类抗生素对斑马鱼的急性致死作用可见,随着药物质量浓度的增大,斑马鱼死亡率显著上升。诺氟沙星和氧氟沙星对斑马鱼的96 h-EC50分别为0.229 g/L和0.427 g/L。结合本试验设计方案,设置抗生素质量浓度为0,30,60,120,360 mg/L。
采用暴露染毒法,将斑马鱼直接暴露在一定质量浓度的抗生素脱氯自来水中。配制抗生素溶液:用0.1%(质量分数,下同)的盐酸溶液溶解制备成1 mmol/L的母液,然后用NaOH调节pH值为6.8~7.5。随机选取生长健康的斑马鱼分为5组,每组30尾。每组脱氯自来水4 L,分别设置0,30,60,120,360 mg/L 5个浓度组进行试验,试验期间不投喂食物。于试验的第5,10,15 d测定斑马鱼内脏团中的SOD活性和CAT活性。
在无菌条件下,将斜生栅藻接种入盛有BG-11培养基的250 mL锥形瓶中,在光照培养箱中进行培养,光照强度为3 500 lux,昼夜光照周期为(12 h光照+12 h黑暗),温度设置为(25±1)℃,每日定时人工摇晃4次。配制抗生素溶液:用0.1%盐酸溶液溶解制备成1 mmol/L的母液,然后用NaOH调节pH值为6.8~7.5。将配制完毕的抗生素母液按照一定比例混入斜生栅藻培养基中,分别设置0,30,60,120,360 mg/L 5个浓度组进行试验。于试验的第5,10,15 d测定斜生栅藻的SOD活性和CAT活性。
2.2 指标测定
从各试验组取10尾斑马鱼,解剖取出内脏团,用0.9%生理盐水清洗,称重后按质量(g)∶體积(mL)=1∶9的比例,加入9倍体积的生理盐水,并置于匀浆器进行充分匀浆,2 500 r/min离心10 min。采用考马斯亮蓝总蛋白试剂盒测定斑马鱼内脏团蛋白质的含量,然后分别用SOD试剂盒、CAT可见光试剂盒测定相应指标。
取藻液20 mL进行离心 (5 000 r/min,5 min),弃去上清液,用PBS缓冲溶液清洗底部藻泥3次。取20 mL藻液,在冰浴条件下使用超声波进行细胞破碎,单次超声时间为5 s,使用2 mm探头,设置功率为300 W,破碎时间为10 min。随后在低温条件下进行离心(8 000 r/min,10 min)。取上清液,检测SOD活性和CAT活性。
2.3 数据处理
采用SPSS17.0对试验数据进行统计分析,用Origin8.0进行作图处理,结果以(平均数±标准差)表示。其中:*(P<0.05)表示与空白对照组相比有显著差异;**(P<0.01)表示与空白对照组相比有极显著差异。
3 结果与分析
3.1 诺氟沙星对斑马鱼内脏团及斜生栅藻SOD和CAT的影响
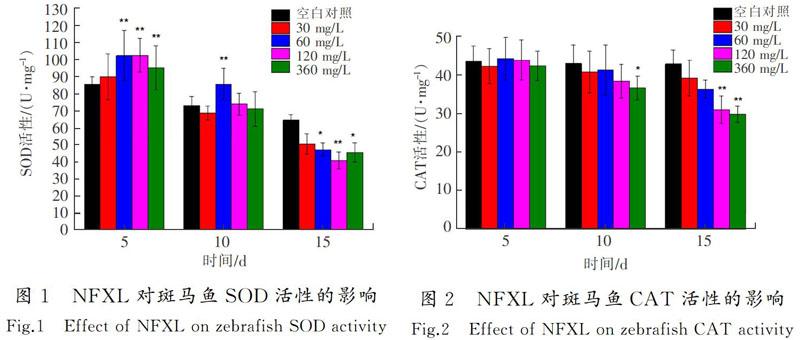
暴露期间,斑马鱼SOD活性出现先诱导后抑制的变化趋势(见图1)。与对照组相比,最大诱导率为19.7%,试验组呈现极显著差异(P<0.01);最大抑制率为36.4%,并呈现极显著差异(P<0.01)。
斑马鱼CAT活性出现逐渐抑制的趋势(见图2)。与对照组相比,最大抑制率为30.3%,并呈现极显著差异(P<0.01)。
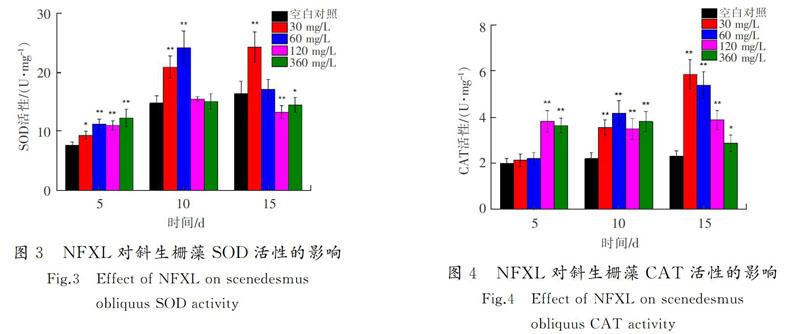
暴露期间,斜生栅藻SOD活性出现先诱导后抑制的变化趋势(见图3)。与对照组相比,最大诱导率为64.9%,试验组呈现极显著差异(P<0.01);最大抑制率为19.4%,并呈现极显著差异(P<0.01)。
斜生栅藻CAT活性出现逐渐诱导的趋势(见图4)。与对照组相比,最大诱导率为152.6%,并呈现极显著差异(P<0.01)。
3.2 氧氟沙星对斑马鱼内脏团及斜生栅藻SOD和CAT的影响
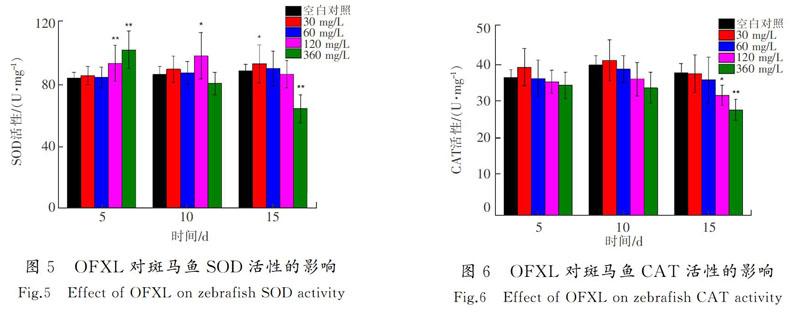
斑马鱼SOD活性出现先诱导后抑制的变化趋势(见图5)。与对照组相比,最大诱导率为21.8%,呈现极显著差异(P<0.01);最大抑制率为27.5%,并呈现显著差异(P<0.05)。
斑马鱼CAT活性出现逐渐抑制的趋势(见图6),最大抑制率为26.2%,试验组呈现极显著差异(P<0.01)。
暴露期间,斜生栅藻SOD活性出现先诱导后抑制的变化趋势(见图7)。与对照组相比,最大诱导率为124.3%,试验组呈现极显著差异(P<0.01),最大抑制率为5.27%。
斜生栅藻CAT活性出现逐渐诱导的趋势(见图8)。与对照组相比,最大诱导率为98.0%,并呈现极显著差异(P<0.01)。
研究发现,在试验周期和抗生素质量浓度相同的条件下,诺氟沙星对斑马鱼抗氧化指标的影响均大于斜生栅藻,其中斑马鱼CAT活性的最小值大于斜生栅藻CAT活性的最小值,两者最大值差距15.08倍。氧氟沙星对斑马鱼抗氧化指标的影响均大于斜生栅藻,其中斑马鱼CAT活性的最小值大于斜生栅藻CAT活性的最小值,两者最大值差距27.38倍。这可能表明喹诺酮类抗生素在藻类和鱼类所引起的抗氧化应激反应的强度不同。受试生物抗氧化指标见表1。
4 讨论与分析
随着暴露时间的延长,诺氟沙星对斑马鱼内脏团和斜生栅藻SOD活性的影响均表现为先诱导后抑制的趋势,这可能是由于前期受试生物的氧化应激系统被激活,从而能适应环境中的诺氟沙星。第15 d,由于诺氟沙星的积累,细胞受到一定的氧化损伤,无法清除多余的活性氧并造成SOD活性的降低,使受试生物受到一定的损害[25]。氧氟沙星对斑马鱼内脏团和斜生栅藻SOD活性的影响表现为先诱导后抑制的趋势。其对斑马鱼和斜生栅藻氧化应激系统的作用效果如下:前期斑马鱼体内受到氧氟沙星的影响,产生大量机体活性自由基激活氧化应激系统,SOD活性被诱导;后期组织细胞受到一定氧化损伤,氧自由基过量积累导致SOD活性被抑制。由此可见,受胁迫的斑马鱼和斜生栅藻SOD的活性变化趋势具有一定的相似性,喹诺酮类抗生素对不同水生生物的抗氧化作用效果可能也相同。
诺氟沙星试验组中斑马鱼CAT活性出现逐渐抑制的趋势,试验第15 d时360 mg/L质量浓度组的抑制率为30.3%。CAT能够清除SOD和机体长链脂肪酸代谢产生的H2O2[26],由于SOD诱导率比抑制率低,可能未引起CAT活性的增加;第15 d时SOD活性抑制效果显著,产生的H2O2含量降低,从而引起CAT活性降低。氧氟沙星试验组中CAT活性出现逐渐抑制的趋势,试验第15 d时360 mg/L质量浓度组的抑制率为26.2%。这可能是在后期SOD活性受到极显著抑制(P<0.01),使CAT活性逐渐降低的缘故。研究指出,机体内抗氧化酶类如CAT可以反映机体受损伤的状态[27]。本研究中诺氟沙星和氧氟沙星造成斜生栅藻CAT活性上升,表明当藻细胞受到胁迫时,CAT增多用于清除H2O2,保持藻细胞抗氧化环境平衡;但后期斜生栅藻CAT活性没有下降,可能是试验期间内藻细胞内多余的H2O2未清除完毕,这表明斑马鱼和斜生栅藻受胁迫后氧化应激系统中CAT的作用强度有所不同。
5 结 论
1)喹诺酮类抗生素对斑马鱼和斜生栅藻SOD活性的影响趋势相似,表明喹诺酮类抗生素对斑马鱼和斜生栅藻SOD活性的影响程度相同。由于斑马鱼和斜生栅藻SOD活性的最大值和最小值出现较大差异,且喹诺酮类抗生素对斑马鱼SOD活性的影响均高于对斜生栅藻SOD活性的影响,说明喹诺酮类抗生素对不同水生生物氧化应激反应的强度存在明显差异。
2)喹诺酮类抗生素对斑马鱼和斜生栅藻CAT活性的影响呈现不同趋势,其中对斑马鱼CAT活性的影响有抑制作用,对斜生栅藻CAT活性的影響有诱导作用,说明不同水生生物维持体内细胞抗氧化环境平衡的能力存在差异。由于喹诺酮类抗生素对斑马鱼CAT活性最大值和最小值的影响均高于对斜生栅藻CAT活性的影响,说明喹诺酮类抗生素对不同水生生物氧化应激反应的强度存在明显差异。
3)喹诺酮类抗生素对水生生物氧化应激系统的影响过程非常复杂,本文仅比较了斑马鱼和斜生栅藻受喹诺酮类抗生素影响的作用机制,并对SOD活性和CAT活性的最大值和最小值进行了分析。今后将进一步采用更加系统全面的分析方法,探究更多种类抗生素对水生生物氧化应激系统的影响。
参考文献/References:
[1] ANGULO F J,COLLIGNON P,POWERS J H,et al.The World Health Organization ranking of antimicrobials according to their importance in human medicine[J].Clinical Infectious Diseases,2009,49(1):132-141.
[2] 叶赛,卢江涛,宗虎民,等.液相色谱-串联质谱测定养殖海水中氟苯尼考残留[J].沈阳农业大学学报,2008,39(3):368-370.
YE Sai,LU Jiangtao,ZONG Humin,et al.Determination of florfenicol residues in aquiculture seawater by high performance liquid chromatography-tandem mass specterometry [J].Journal of Shenyang Agricultural University,2008,39(3):368-370.
[3] 李彦文,张艳,莫测辉,等.广州市蔬菜中喹诺酮类抗生素污染特征及健康风险初步研究[J].环境科学,2010,31(10):2445-2449.
LI Yanwen,ZHANG Yan,MO Cehui,et al.Preliminary study on occurrence and health risk assessnment of quinolone antibiotics in vegetables from Guangzhou,China[J].Environmental Science,2010,31(10):2445-2449.
[4] 章强,辛琦,朱静敏,等.中国主要水域抗生素污染现状及其生态环境效应研究进展[J].环境化学,2014,33(7):1075-1083.
ZHANG Qiang,XIN Qi,ZHU Jingmin,et al.The antibiotic contaminations in the main water bodies in China and the associated environmental and human health impacts[J].Environmental Chemistry,2014,33(7):1075-1083.
[5] LINDBERG R,JARNHEIMER P A,OLSEN B,et al.Determination of antibiotic substances in hospital sewage water using solid phase extraction and liquid chromatography/mass spectrometry and group analogue internal standards[J].Chemosphere,2004,57(10):1479-1488.
[6] LI W,SHI Y,GAO L,et al. Investifation of antibiotics in mollusks from coastal water in the Bohai Sea of China[J].Environmental Pollution,2012,162:56-62.
[7] 张慧,郭文建,朱晨,等.山东省主要河流中抗生素污染组成及空间分布特征[J].中国环境监测,2019,35(1):89-94.
ZHANG Hui,GUO Wenjian,ZHU Chen,et al.Composition and spatial distribution characteristics of antibiotics in main rivers of Shandong Province[J]. Environmental Monitoring in China,2019,35(1):89-94.
[8] 叶计朋,邹世春,张干,等.典型抗生素类药物在珠江三角洲水体中的污染特征[J].生态环境,2007,16(2):384-388.
YE Jipeng,ZOU Shichun,ZHANG Gan,et al. Characteristics of selected antibiotics in the aquatic environment of the Pearl River Delta,south China[J].Ecology and Environment, 2007,16(2):384-388.
[9] 朱婷婷,宋战锋,尹魁浩,等.深圳西丽水库抗生素残留现状及健康风险研究[J].环境污染与防治,2014,36(5):49-53.
ZHU Tingting,SONG Zhanfeng,YIN Kuihao,et al.Study on current sitation and health risk of antibiotics residue in source water of Xili Reservoir in Shenzhen[J].Environmental Pollution & Control,2014,36(5):49-53.
[10]欧丹云,陈彬,陈灿祥,等.九龙江下游河口水域抗生素及抗性细菌分布[J].中国环境科学,2013,33(12):2243-2250.
OU Danyun,CHEN Bin,CHEN Canxiang,et al.Distribution of antibiotics residue and resistant bacteria in the downstream and estuarine area in Jiulong River[J].China Environmental Science,2013,33(12):2243-2250.
[11]吴青峰,洪汉烈.环境中抗生素污染物的研究进展[J].安全与环境工程,2010,17(2):68-72.
WU Qingfeng,HONG Hanlie.Progress of research on antibiotic contamination[J].Safety and Environmental Engineering,2010,17(2):68-72.
[12]王加龙,刘坚真,陈杖榴,等.恩诺沙星残留对土壤微生物功能的影响[J].生态学报,2005,5(12):523-530.
WANG Jialong,LIU Jianzhen,CHEN Zhangliu,et al.Effects of enrogloxacin residues on the functions of soil microbes[J].Acta Ecologica Sinica,2005,5(12):523-530.
[13]王荻,李绍戊,马涛,等. 諾氟沙星对两种鲟体内SOD活力影响的比较研究[J].中国畜牧兽医,2011,38(7):34-37.
WANG Di,LI Shaowu,MA Tao,et al. A comparison study on the effects of norfloxacin on the superoxide
dismutase activities in two kinds of sturgeons[J].China Animal Husbandry &Veterinary Medicine, 2011,38(7):34-37.
[14]李萍,王永铭,程能能,等.喹诺酮类药物对离体兔软骨细胞的毒性[J].中国新药与临床杂志,2004,23(6):331-335.
LI Ping,WANG Yongming,CHENG Nengneng,et al.Chondrotoxicity of quinolones on cultured chondrocytes of rabbit[J].Chinese Journal of New Drugs and Clinical Remedies,2004,23(6):331-335.
[15]TALLA V,VEERARDDY P.Oxidative stress induced by fluoroquinolones on treatment for complicated urinary tract infections in Indian patients[J].Journal of Young Pharmacists,2011,3(4):304-309.
[16]管超,毛杰.抗生素对水生态环境毒性效应研究概述[J].资源节约与环保,2014(2):136.
[17]王志强,朱琳.常用抗菌药对藻类的急性毒性效应研究[J].中兽医医药杂志,2006,25(6):17-20.
WANG Zhiqiang,ZHU Lin.The acyte toxicity tests of antibiotic on algae[J].Journal of Traditional Chinese Veterinary Medicine,2006,25(6):17-20.
[18]皋德祥,宋国梁,葛利云,等.2种抗生素对球等鞭金藻的毒理学研究[J].浙江农业科学,2013(2):179-182.
[19]陈柳芳.三种喹诺酮类抗生素对斜生栅藻的毒性效应[D].长春:东北师范大学,2010.
CHEN Liufang.The Toxicity Effect of Three Quinolone Antibiotics on Scenedesmus Obliquus[D].Changchun:Northeast Normal University,2010.
[20]南芝润,范月仙.植物过氧化氢酶的研究进展[J].安徽农学通报,2008,14(5):27-29.
NAN Zhirun,FAN Yuexian.Advance of researches on catalase in plants[J].Anhui Agricultural Science Bulletin,2008,14(5):27-29.
[21]张坤生,田荟琳.过氧化氢酶的功能及研究[J].食品科技,2007,35(31):8-10.
ZHANG Kunsheng,TIAN Huilin.Research and function of catalase in organism[J].Food Science and Technology,2007,35(31):8-10.
[22]陈金峰,王宫南,程素满.过氧化氢酶在植物胁迫响应中的功能研究进展[J].西北植物学报,2008,28(1):188-193.
CHEN Jinfeng,WANG Gongnan,CHENG Suman. Progress about catalase function in plant stress reactions[J].Acta Botanica Boreali-Occidentalia Sinica,2008,28(1):188-193.
[23]朱友芳,嚴志洪,洪万树.高锰酸钾对中国花鲈的毒性效应[J].生态毒理学报,2011,6(2):176-181.
ZHU Youfang,YAN Zhihong,HONG Wanshu. Toxic effects of potassium permanganate on perch lateolabrax maculates[J].Asian Journal of Ecotoxicology,2011,6(2):176-181.
[24]高问,武鹏鹏,沈洪艳.土霉素废水对斑马鱼的生物毒性效应研究[J].河北科技大学学报,2019,40(1):38-44.
GAO Wen,WU Pengpeng,SHEN Hongyan.Study of the biological toxicity of oxytetracycline wastewater on zebrafish[J].Journal of Hebei University of Science and Technology, 2019,40(1):38-44.
[25]LIU H, GOONERATE R, HUANG X, et al. A rapid in vivo zebrafish model to elucidate oxidative stress-mediated PCBI126:Induced apoptosis and developmental toxicity[J]. Free Radical Biology and Medicine, 2015, 84: 91-102.
[26]FRIDOVICH I.Superoxide dismutase:An adaptayion to a paramagnrtic gas[J].The Journal of Biological Chemistry,1989,264:7761-7764.
[27]ZHOU Z,SON J,HARPER B,et al.Influence of surface chemical properties on the toxicity of engineered zincoxide nanoparticles to embryonic zebrafish[J].The Beilstein Journal of Nanotechnology,2015,6:1568-1579.
