食管癌术后急性呼吸窘迫综合征再次行机械通气的危险因素与预后分析
2020-09-10陈文杰
陈文杰 钟 镭 薛 磊
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是食管癌术后常见的并发症,为患者围术期死亡的重要因素之一[1-5]。ARDS起病急、病情进展快[6-8],患者往往需要行气管插管、呼吸机支持治疗。已有大量研究[1-3,5,9-14]对食管癌术后呼吸系统并发症或ARDS发生的危险因素进行分析,而ARDS对患者预后影响的研究鲜见报道。本研究旨在探讨影响食管癌术后发生ARDS的患者再次行机械通气的危险因素,并对其预后进行分析,以期为临床合理评估食管癌的手术风险提供参考。
1 对象与方法
1.1 研究对象 选择2010—2019年在上海长征医院胸心二科行开胸食管癌根治性手术的患者522例,男427例、女95例;年龄范围50~80岁,平均年龄为(63.55±7.84)岁;术中行经右胸-胸顶吻合393例(75.29%),经左胸-弓下吻合129例(24.71%)。将术后5 d内发生ARDS再次行机械通气治疗的患者纳入ARDS组(54例),未发生ARDS的患者纳入对照组(468例);根据ARDS患者行机械通气后的病情转归,将患者进一步分为好转组(经治疗后最终出院,24例)和死亡组(30例)。所有患者术前均经胃镜和活组织病理学检查明确诊断为食管癌。既往有冠心病史、肝肾功能异常者除外。本研究符合2013年修订的《赫尔辛基宣言》的要求,患者及其家属均知情同意。
1.2 方法 所有患者均于全身麻醉下行开胸食管癌根治性手术,术前30 min予青霉素类或第二代头孢菌素类抗生素静脉注射,并在术后常规应用2 d后停药。术后3 d连续行痰液培养。如患者出现肺炎表现,给予第三代头孢菌素+喹诺酮类药物治疗,再根据痰液培养、药物敏感试验结果或患者病情调整抗感染治疗方案。两组患者术后均常规配置镇痛泵(舒芬太尼100 μg+右美托咪定100 μg,容量100 mL,维持剂量2 mL/h,脉冲给药0.5 mL/次),维持48 h后撤去镇痛泵,按需临时给予NSAID,镇痛效果满意。ARDS组均无吻合口瘘、伤口愈合不良等非呼吸道并发症,行机械通气后采用保护性肺通气策略,合理液体管理,充分营养支持,积极对症支持治疗。对照组患者住院期间病情平稳,围术期无相关并发症发生,术后逐步开放饮食至进半流质饮食2 d后予出院。
1.3 ARDS诊断标准 根据2012年ARDS柏林定义[7],以PEEP≥5 cmH2O(1 cmH2O=0.098 kPa)为标准诊断ARDS的临床实际操作难度大,故本研究采用中华医学会重症医学分会2006年《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南》[15]的标准诊断ARDS:①急性发病;②胸部正位X线摄片示双肺斑片状影;③肺动脉嵌顿压≤18 mmHg(1 mmHg=0.133 kPa)或无左心房压力增高证据;④氧合指数(paO2/FiO2)≤200 mmHg。
1.4 观察指标 记录患者的一般资料,包括年龄、性别、BMI;有无合并症,包括高血压,糖尿病,中、重度COPD[FEV1占预计值百分比(FEV1%)<70%且FEV1/FVC占预计值百分比(FVC%)<80%];吸烟史,以及手术方式和手术时间。记录患者术前paCO2,术前肺功能指标:FVC%、FEV1%、FEV1/FVC%、呼气峰流速值占预计值百分比(PEF%)[16]、最大自主通气量占预计值百分比(MVV%)、一氧化碳弥散量占预计值百分比(DLCO%)。

2 结 果
2.1 一般资料比较 ARDS组患者年龄显著大于对照组(P<0.05),中、重度COPD,有吸烟史患者构成比均显著高于对照组(P值均<0.01),手术时间显著长于对照组(P<0.01),行经右胸-胸顶吻合的患者构成比显著高于对照组(P<0.05)。两组间患者性别构成、BMI,以及高血压、糖尿病患者构成比的差异均无统计学意义(P值均>0.05)。见表1。
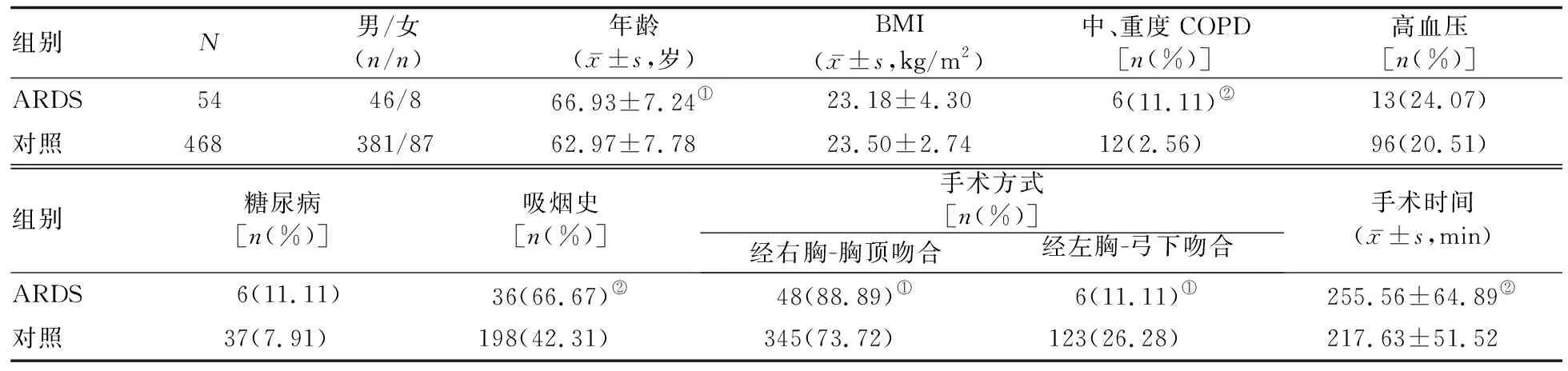
表1 ARDS组与对照组一般资料比较
2.2 术前paCO2和肺功能指标比较 两组间术前paCO2和PEF%的差异均无统计学意义(P值均>0.05)。ARDS组术前FVC%、FEV1%、FEV1/FVC%、MVV%、DLCO%均显著低于对照组(P值分别<0.05、0.01)。见表2。

表2 ARDS组与对照组术前paCO2和肺功能指标比较
2.3 术后ARDS再次行机械通气的危险因素和患者预后分析 将患者年龄,中、重度COPD,吸烟史,手术时间,手术方式,以及术前FVC%、FEV1%、FEV1/FVC%、MVV%、DLCO%作为自变量,以发生ARDS再次行机械通气为因变量,行多因素logistic回归分析,结果显示:年龄(OR=1.882,95%CI为1.160~3.154)、吸烟史(OR=2.120,95%CI为1.089~4.127)、手术时间(OR=2.410,95%CI为1.750~3.319)、术前DLCO%(OR=1.415,95%CI为1.137~1.761) 是食管癌术后发生ARDS患者需再次行机械通气的独立危险因素(P值均<0.05),年龄(OR=4.296,95%CI为1.415~13.045)、术前FVC%(OR=3.273,95%CI为1.373~7.803)是ARDS患者再次行机械通气后死亡的独立危险因素(P值均<0.05)。
2.4 术后ARDS再次行机械通气后不同结局患者的一般资料和肺功能指标比较 ARDS组插管时机为术后第(2.52±1.16) d。术后ARDS再次行机械通气的患者中死亡组年龄显著大于好转组(P<0.05),FVC%显著低于好转组(P<0.05)。见表3、4。

表3 术后ARDS再次行机械通气的患者中死亡组与好转组一般资料比较

表4 术后ARDS再次行机械通气的患者中死亡组与好转组paCO2和肺功能指标比较
3 讨 论
ARDS的基本病理生理改变是肺毛细血管内皮与肺泡上皮损伤、通透性升高造成的弥漫性肺间质和肺泡水肿,导致广泛的肺泡塌陷、有效肺容积减少、严重的通气/血流比例失调,从而发生进行性加重的低氧血症[6-8,15]。以肺泡为基础单位的气体交换功能障碍伴随其结构塌陷是ARDS的首发改变。既往研究[3,11,14,17]结果显示,以术前FEV1%为代表的肺功能指标被认为是食管癌术后发生ARDS的独立危险因素,其原因可能为存在肺通气功能减退(即术前FEV1%下降)的患者虽未达到COPD或哮喘等典型疾病的肺功能诊断,但中、小气道受长期慢性通气障碍的影响已存在,进而发生肺泡-毛细血管结构损害、基底膜增厚的病理生理改变,当机体遭遇相关致病因素打击时更易进展为ARDS。上述结论与COPD、哮喘等患者更易发生ARDS的观点[18]相符。本研究结果显示,ARDS组术前FVC%、FEV1%、FEV1/FVC%、MVV%、术前DLCO%均显著低于对照组,但仅术前DLCO%是食管癌术后发生ARDS患者需再次行机械通气的独立危险因素。分析其原因可能为FEV1%、FVC%、FEV1/FVC%、MVV%间本身存在一定联系,易在总体统计中被剔除,而DLCO%作为衡量气体通过肺泡壁-毛细血管膜进行交换的指标,在受试气体(相对分子质量、溶解度)、个体特性(血氧结合力)基本稳定的前提下,能更好地反映机体肺内弥散面积、弥散距离(厚度)、肺泡毛细血管血流等情况,是ARDS致病的病理生理基础,故在预测个体应对ARDS的代偿能力时,较传统的肺通气功能指标更为直接和确切。DLCO%作为评估肺手术耐受性的指标已在临床广泛应用[19-22],近年来有学者将其应用于食管癌术后呼吸道并发症的预测[11,13]。
发生ARDS时,肺泡-毛细血管壁通透性升高,大量白细胞浸润肺泡、间质组织,多条细胞炎性因子通路在此过程中发挥致病作用,导致上皮组织损伤→血管通透性改变→肺水肿→肺组织纤维化的恶性循环路径持续反复,从而加重病情[6,23-24]。宋元林等[8]的研究结果表明,ARDS患者的好转是其自身的肺组织修复占主导作用,即经治疗积极地阻断致病因素,打破上述恶性循环,辅助并支持机体渡过急性进展期转入恢复阶段。在ARDS行机械通气治疗的患者以呼吸机控制呼吸频率为主的支持治疗中,术前FVC%所反映的内容可理解为机体通气容量的储备(上限),显然更高的FVC%意味着机体在应对ARDS打击和因病程迁延进展为肺纤维化[23-24]时,具备更好的肺功能代偿能力,故该指标与ARDS患者的预后相关[25]。另一方面,ARDS患者行机械通气治疗时,根据其体重简单估算潮气量,以术前FVC实测值为参照估算的潮气量更适合病理状态下患者对通气量的需求[26]。这也许可解释在食管癌术后发生ARDS并最终死亡的患者各项肺功能指标中,仅FVC%显著低于好转组。
吸烟对呼吸系统的损害是多方面的[27-29],长期烟雾的刺激可使支气管上皮坏死、纤毛脱落、细小支气管痉挛、杯状细胞增殖、分泌亢进。烟草燃烧产生的一氧化碳、尼古丁、氧自由基等有毒物质具有明确的破坏肺泡上皮细胞、增加毛细血管通透性、促使炎症细胞浸润肺泡,最终破坏肺泡结构的作用。这一系列损伤在微观上类似COPD[29],随时间推移有累加效应,且难以逆转,被认为与食管癌术后ARDS的发生有关。本研究结果显示,ARDS组有吸烟史患者构成比显著高于对照组,且吸烟史是食管癌术后发生ARDS患者需再次行机械通气的独立危险因素。
随着年龄的增长,肺的衰老涉及肺组织结构、功能和细胞等,具体反映在结构重塑、肺功能减退、呼吸肌力量减弱,以及对急、慢性肺部疾病的易感性增高等多个方面[30]。年龄作为衰老最直观的参考依据,被认为与食管癌术后呼吸系统并发症的发生有关。本研究结果显示,ARDS组患者年龄显著大于对照组,且年龄是食管癌术后发生ARDS患者需再次行机械通气的独立危险因素。
由此可见,吸烟、年龄是反映个体肺功能改变和代偿能力下降的两个不同因素。但遗憾的是,在术前评估时,个体间年龄、吸烟情况存在差异,即使结合肺功能、血气分析结果,也难以确定具体的禁忌阈值或考量标准,仍有待进行更多的前瞻性研究总结出可靠且成体系的评判标准。
本研究结果显示,ARDS组手术时间显著长于对照组,且手术时间是食管癌术后发生ARDS患者需再次行机械通气的独立危险因素。术中操作困难[31]、术中发生意外(术中出血,胸腔、腹腔广泛粘连等)、单肺通气[14,32]或低血压时间长[5]等因素可导致手术时间延长,给肺和机体所带来的直接或间接的不利影响可综合归结为手术创伤对ARDS发生的驱动作用[6-8,15]。在短时间内难以有效改善患者肺功能的情况下,充足的术前准备、个体化的手术预案、快速高效的手术流程,以及微创技术的应用将有利于患者耐受手术创伤,并减少ARDS的发生[33-34]。
综上所述,年龄、吸烟史、手术时间、术前DLCO%是食管癌术后发生ARDS患者需再次行机械通气的独立危险因素,年龄、术前FVC%是ARDS患者行再次机械通气后死亡的独立危险因素。因此,充足的术前肺功能评估、缩短手术时间、减少术中创伤将有助于降低食管癌术后ARDS患者再次行机械通气的概率,改善其围术期的预后。
