响应面优化复合酶制备干酪素工艺
2020-09-10蔡丽莎王东鹏
蔡丽莎,王东鹏,曾 珍,李 诚
(四川农业大学食品学院,四川 雅安 625000)
凝乳酶干酪素是以新鲜牛乳或“曲拉”为原料,用酶使酪蛋白凝结沉淀,经洗涤、脱水、干燥、粉碎而成白色或微黄色产品[1],具有高营养、低脂肪、低胆固醇等优点,广泛应用于食品、皮革、造纸、纺织、医药、包装等行业[2]。国内大部分生产凝乳酶干酪素企业均以“曲拉”为原料,但品质较差,近年来更多企业转向以鲜奶为原料生产干酪素[3]。
干酪素生产凝乳酶包括动物源凝乳酶、植物源凝乳酶和微生物源凝乳酶等。最常用凝乳酶为小牛皱胃酶,以小牛皱胃酶凝乳制备干酪素,颗粒细腻雪白,乳香持久,乳化性、起泡性等特性优异,但小牛皱胃酶来源有限、价格高,不适合大规模生产需求。
Moschopoulou等研究发现小牛皱胃酶主要由凝乳酶(EC3.4.23.4)、胃蛋白酶A和胃亚蛋白酶组成,是复合酶,为制备高品质干酪素原因之一[4]。杨勤等使用胃蛋白酶制备干酪素,产品功能性质与小牛皱胃酶制品差异不显著,制备成本降低,但产品颜色偏黄[5]。Luo等从白首乌干叶中提取粗蛋白酶并研究其凝乳活性,发现其在凝乳过程中有过度水解及产生苦味小肽缺陷[6]。黄梦瑶等发现凝乳酶具有极高蛋白水解能力,在凝乳时破坏生成干酪素,产品纯度下降[7]。本研究采用新鲜牛乳为原料,选取胃蛋白酶、风味蛋白酶和中性蛋白酶组成复合凝乳酶,采用混料设计、单因素设计和响应面试验研究复合酶制备干酪素最佳生产工艺条件,分析酪素红外光谱特性等理化性质,比较复合酶制备干酪素与小牛皱胃酶制备干酪素产品性质差异,以期为复合凝乳酶干酪素制备研究提供参考。
1 材料与方法
1.1 材料与试剂
鲜牛乳,购自四川农业大学农场;小牛皱胃酶(酶活≥100 000 U·g-1),购自潍坊悦祥化工有限公司;胃蛋白酶(酶活≥30 000 U·g-1)、风味蛋白酶(酶活≥40 000 U·g-1)、中性蛋白酶(酶活≥50 000 U·g-1),均购自上海瑞永生物科技有限公司;溴化钡、氢氧化钠、盐酸、硫酸铜、硫酸钾、硫酸、硼酸等试剂均为分析纯,购自四川雅安万科公司。
1.2 仪器设备
pH3C+型pH计,购自成都世纪方舟科技有限公司;X3R冷冻离心机,购自美国Thermo公司;DHG-9245A型电热恒温鼓风干燥箱,购自上海一恒科技有限公司;FW-100高速粉碎机,购自北京市光明医疗仪器有限公司;Frontier傅里叶变换红外光谱仪,购自美国PerkinElmer公司;SC-80C型全自动色差计,购自北京康光仪器有限公司。
1.3 试验方法
1.3.1 小牛皱胃酶制备干酪素工艺
小牛皱胃酶制备干酪素工艺参见文献[8]方法。
1.3.2 复合酶制备干酪素制备工艺
1.3.2.1 制备工艺流程
新鲜牛奶→离心脱脂→巴氏杀菌→冷却→加酶凝乳→切割与灭活→过滤洗涤→干燥→粉碎→成品。
1.3.2.2 操作要点
离心脱脂:新鲜牛乳于4℃下、8 000 r·min-1离心15 min后除去上层凝固脂肪。
加酶凝乳:取100 g灭菌后脱脂乳,按照试验设计调节体系pH、温度、复合酶添加量,添加酶时需充分搅拌,使酪蛋白充分沉淀,凝乳时间为5~25 min。
切割与灭活:凝乳时间结束后,迅速将凝乳划分为1 cm×1 cm方块以便乳清析出,加热至70℃并保持10 min灭酶活处理,再冷却至室温。
过滤洗涤与干燥:将布氏漏斗连接到真空泵后对干酪素作抽滤,以5倍脱脂乳体积室温下超纯水洗涤过滤后,于38℃条件下干燥2.5 h,粉碎得成品。
酪蛋白出品率按下式计算:出品率(%)=(干酪素质量/脱脂鲜牛乳质量)×100%。
1.3.3 试验设计
1.3.3.1 复合酶混料设计
采用单纯形格子设计模型,用Design-Expert 8.0软件对胃蛋白酶、风味蛋白酶和中性蛋白酶混合比例作设计优化,确定3种酶最适宜配比,每次试验重复3次。
在该混料设计中,设定基础凝乳条件为复合酶添加量为0.010%(以原料脱脂乳质量百分比计,wt%)、凝乳温度45℃、pH 6.0,时间15 min。混合酶由A(胃蛋白酶)、B(风味蛋白酶)、C(中性蛋白酶)组成,3种酶占比总和A+B+C=1,设定上下限,即为0≤A≤1,0≤B≤1,0≤C≤1,研究不同组分配比对干酪素出品率影响。
1.3.3.2 复合酶制备干酪素单因素试验设计
在混料设计试验基础上,取100.00 g新鲜脱脂乳,在复合酶添加量0.015%(其中胃蛋白酶、风味蛋白酶和中性蛋白酶配比为混料试验设计结果)、pH 6.0、凝乳温度45℃、凝乳时间15 min条件下,保持其他工艺条件不变,改变其中任一个因素,以干酪素出品率为指标,研究复合酶添加量(0.010%、0.015%、0.020%、0.025%、0.030%)、凝乳温度(35、40、45、50、55℃)、pH (5.7、6.0、6.3、6.6、6.9)和凝乳时间(5、10、15、20、25 min)对出品率影响,确定复合酶制备干酪素最佳凝乳条件,每组试验重复3次。
1.3.3.3 复合酶制备干酪素响应面试验设计
在单因素试验基础上,以Box-Behnken模型对试验作响应面设计优化。试验以复合酶添加量(A)、凝乳温度(B)、凝乳pH(C)和凝乳时间(D)为自变量,以干酪素出品率(Y)为响应值,试验因素及水平设计见表1。

表1 响应面试验因素水平Table 1 Response surface test factor level table
1.3.4 常规理化指标检测
干酪素中蛋白质测定参照GB 5009.5-2016,酪蛋白含量测定参照GB 31638-2016,脂肪含量测定参照GB 5009.6-2016、水分含量参照GB 50009.3-2016。
1.3.5 测定聚丙烯酰胺电泳(SDS-PAGE)
参见文献[9]方法,采用12%分离胶浓度、5%浓缩胶浓度、酪蛋白浓度为2 mg·mL-1、上样量为10 μL、浓缩胶部分电泳电压为60 V、分离胶部分电泳电压为100 V条件电泳,停止电泳后考马斯亮蓝R-250染色液染色2 h后脱色,凝胶成像系统拍照。
1.3.6 色度检测
采用SC-80C型全自动色差计测定,记录测定结果以亮度值L*,红度值a*值和黄度值b*值。
1.3.7 傅里叶变换红外光谱分析
参照文献[10]检测条件,准确称取2.0 mg蛋白样品,与预先干燥溴化钾粉末充分研磨后倒入模具,压制成透明薄片,采用傅里叶变换红外光谱仪在扫描范围为400~4 000 cm-1、分辨率为4 cm-1、扫描次数32次条件下扫描。在原谱图分析特征结构基础上,利用Peak Fit对红外谱图中酰胺Ⅰ区(1 700~1 600 cm-1)作二阶导数谱图拟合,以初步分析干酪素二级结构。
1.3.8 数据统计分析
试验均重复3次,结果以平均值±标准差表示,数据采用SPSS 25分析,Origin2018软件作图。
2 结果与分析
2.1 复合酶混料试验结果
通过Design-Expert 8.0软件作混料设计,以胃蛋白酶(A),风味蛋白酶(B),中性蛋白酶(C)为自变量,以干酪素出品率(Y)为响应值,通过Design-Expert 8.0软件处理,试验设计与结果如表2所示。
以干酪素出品率为指标作二次多项式回归,得到Y(出品率)与A(胃蛋白酶)、B(风味蛋白酶)和C(中性蛋白酶)之间回归方程模型。
设计复合酶混料试验,回归方程模型作方差分析,结果见表3。可知,该回归方程模型极显著(P<0.0001),失拟项P值为0.215,不显著;模型决定系数R2为0.992,调整后决定系数Radj为0.984,信噪比30.263表明变量与响应值拟合程度较好,该拟合方程可分析预测复合酶中各组分最优比例。AB、AC和BC影响显著(P<0.0001),表明3种酶胃蛋白酶(A)、风味蛋白酶(B)和中性蛋白酶(C)对出品率(Y)均有显著影响,与响应值间非简单线性关系。3种凝乳酶交互作用见图1。
由图1可知,复合酶制备干酪素出品率明显高于胃蛋白酶、风味蛋白酶和中性蛋白酶单独使用时的出品率,分别为2.04%、1.84%和1.94%。当复合酶中胃蛋白酶、风味蛋白酶和中性蛋白酶比例为0.33∶0.33∶0.33时,出品率最高可达2.45%,分别是单独使用3种酶1.2倍、1.3倍和1.3倍,可见3种酶具有良好协同作用,酶解效率优于单一酶。由3D图可见,干酪素得率上升较缓慢,因为在不增加可用交联位点情况下,酪蛋白胶束崩解,延缓凝胶出现[11]。影响凝乳凝结速度主要因素之一是凝乳酶类型,而凝乳酶过度水解作用使干酪素出品率降低[12]。本研究表明,胃蛋白酶占比较高时,干酪素出品率较大。加入胃蛋白酶后,风味蛋白酶和中性蛋白酶过度水解作用得到缓解,提高干酪素出品率。
为检验预测结果可靠性,通过Design-Expert 8.0软件对模型方程求解得到理想复合酶配比为胃蛋白酶∶风味蛋白酶∶中性蛋白酶配比为0.41∶0.29∶0.30,在此条件下出品率理论值为2.45%,验证配比试验,重复3次,实际出品率为2.44%±0.041,与理论值吻合。该混料试验表明复合酶效率明显高于单一种类蛋白酶。

表2 复合酶混料试验设计及结果Table 2 Experimental design and results of compound enzyme mixture
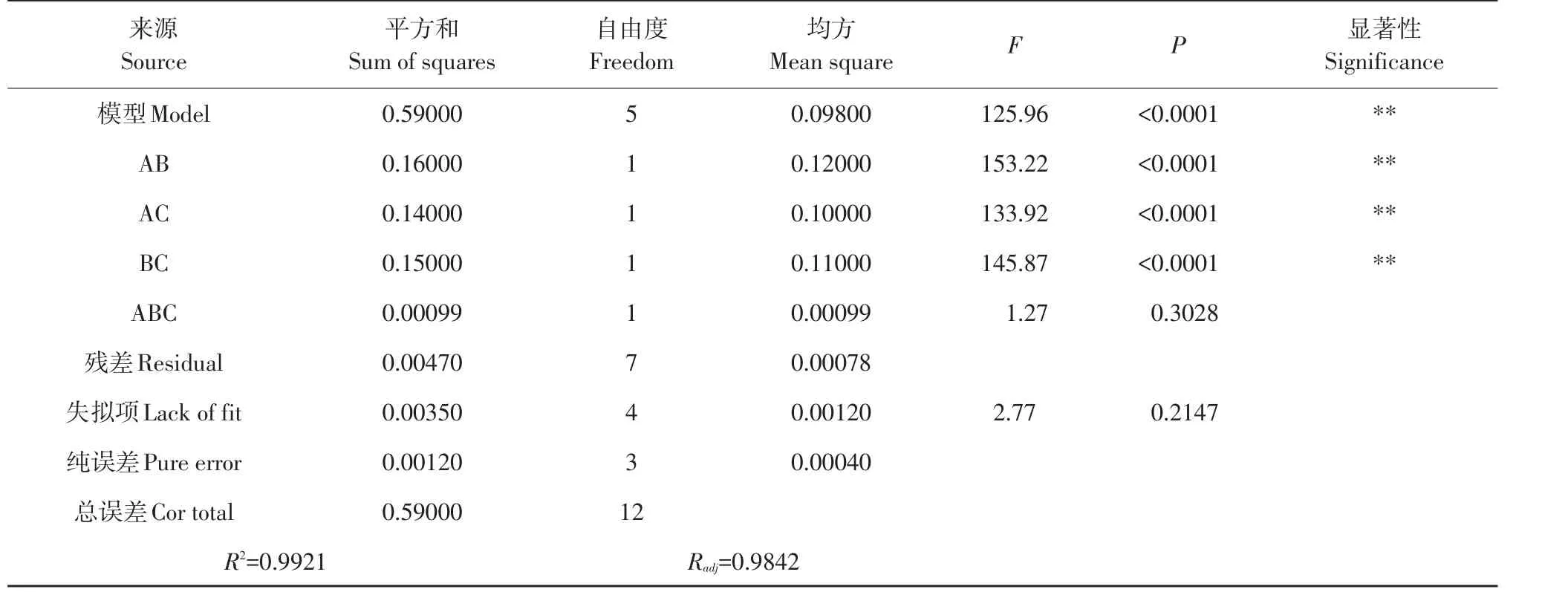
表3 复合酶混料试验设计方差分析Table 3 Analysis of variance of compound enzyme mixture experiment design
2.2 单因素试验结果
2.2.1 复合酶添加量对出品率影响
复合酶添加量对出品率影响见图2。
由图2可知,随酶添加量提高,酪蛋白出品率整体呈先升后降趋势。当酶添加量为0.015%时,出品率达到最高为2.83%;当酶添加量超过0.015%后,复合酶添加量提高,出品率呈下降趋势。牛奶中酪蛋白胶束主要通过静电和空间排斥力而稳定存在,归因于κ-酪蛋白二硫化物聚合物形成具有强大N末端疏水核心外“毛状层”[13]。凝乳酶凝乳作用则是通过裂解κ-酪蛋白导致胶束不稳定和凝结[14],当凝乳酶添加量较小时,κ-酪蛋白与凝乳酶作用位点较少,此时凝乳效果较差。当凝乳酶添加量过多时,过量凝乳酶导致酪蛋白过度水解,酪蛋白出品率降低。在凝乳酶添加量过少或过多时,凝乳易碎,机械性能较差,经水洗后损失更多酪蛋白[15]。因此,本试验考虑酶添加量应控制在0.015%。
2.2.2 凝乳温度对出品率影响
由图3可知,凝乳温度由35℃升至45℃时,酪蛋白出品率随温度上升而增加,45℃时,出品率达最高2.81%,而当温度继续升高时,出品率呈下降趋势。温度对凝乳过程影响一般可分为对酶促反应影响及对酪蛋白胶束影响。温度升高导致凝乳酶失活,出品率降低。温度过高时,凝乳酶底物酪蛋白胶束上κ-酪蛋白因加热而减少,凝乳酶作用位点减少,降低干酪素出品率[16]。因此本试验最佳凝乳温度选择45℃。
2.2.3 凝乳pH对出品率影响
凝乳pH影响复合酶和酪蛋白胶束在溶液中解离状态及构象,适宜pH可稳定凝乳酶活性,增加凝乳效果。
由图4可知,pH 5.7~7.0,出品率随pH升高先增后减,pH 6.0处得到最高出品率为2.84%。原因为pH影响酶空间构象使酶活性降低,影响酪蛋白胶束聚集速率,降低出品率。pH 6.0利于凝乳酶酶活性,增加酪蛋白胶束聚集速率[17]。当溶液pH偏离酶最适pH后,酶空间构象发生显著变化,酶活性降低,凝乳能力显著下降[18]。因此,本试验复合酶凝乳最适pH 6.0。
2.2.4 凝乳时间对出品率影响
凝乳时间对出品率影响见图5。
由图5可知,随凝乳时间延续,出品率呈先增后减趋势,原因为反应初期凝乳酶与蛋白结合位点较多,酶切位点减少,出品率下降。10 min时,出品率最高为2.85%。随凝乳时间延续,酪蛋白被酶水解,出品率下降[19]。凝乳时间过长,降低酪蛋白胶束表面静电荷,导致凝乳中乳清大量析出,凝乳变硬,出品率下降[20]。因此,该复合酶最适凝乳时间选择10 min。
2.3 响应面分析
在单因素试验基础上,采用Design-Expert 8.0软件作中心组合设计,通过Box-Behnken模型,以复合酶添加量(A)、凝乳温度(B)、凝乳pH(C)和凝乳时间(D)为自变量,以干酪素出品率(Y)为响应值,通过Design Expert 8.0.6作试验设计与数据分析,见表4。
经回归拟合后获得复合酶添加量(A)、凝乳温度(B)、凝乳pH(C)和凝乳时间(D)二次回归模型方程为:Y=2.89+0.087A-0.11B-0.068C-0.10D+0.20AB+0.061AC+0.077AD-0.058BC+0.029BD+0.051CD-0.16A2-0.18B2-0.20C2-0.12D2。
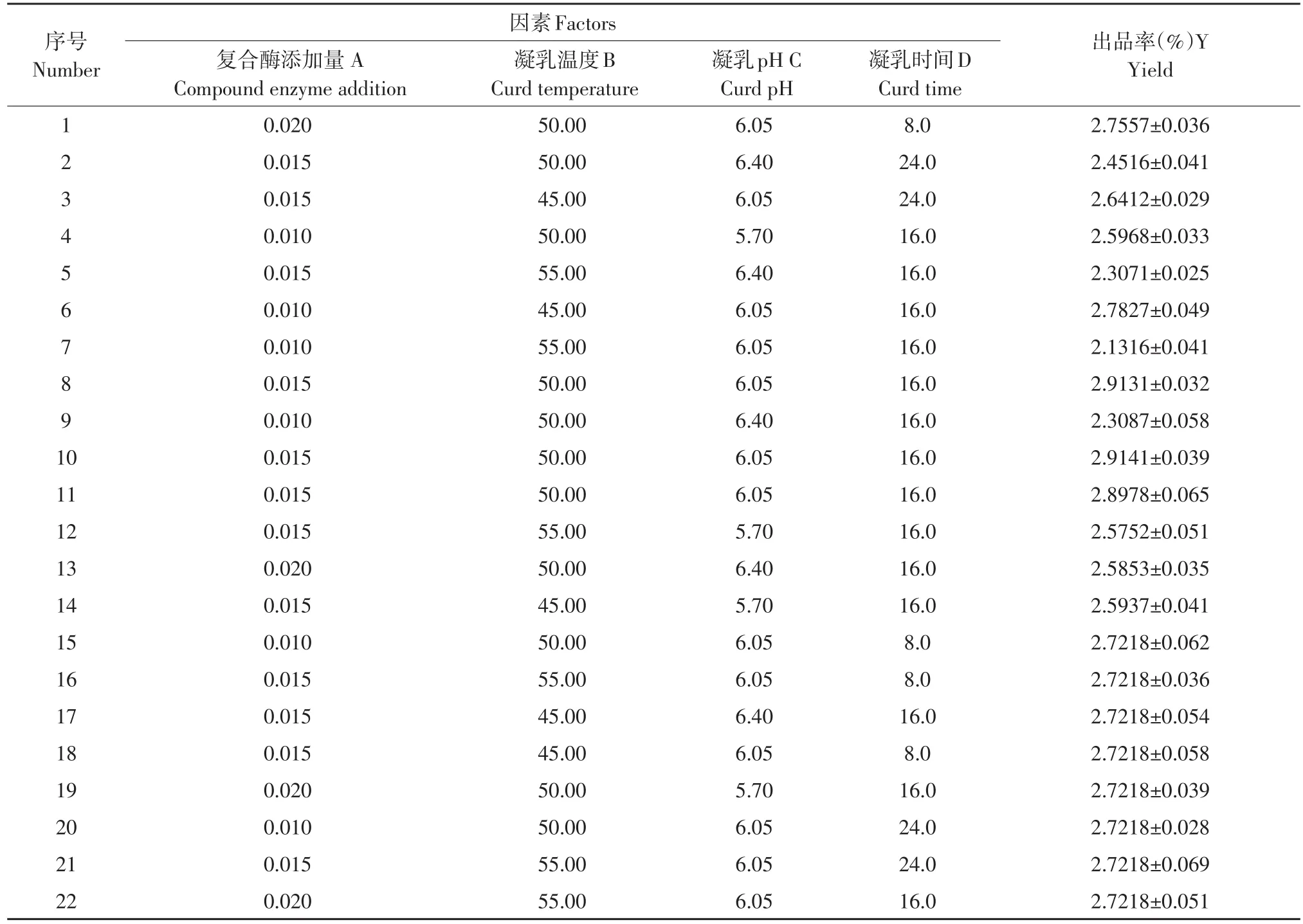
表4 响应面试验设计与结果Table 4 Response surface experimental design and results

续表
应用Design Expert8.0.6软件,方差分析方程和各因子,结果见表5。
由表5可知,该回归模型变量间关系极显著(P<0.001),失拟项(P>0.05)不显著,模型RAdj为0.9307,R2=0.9654,说明该模型试验误差较小,拟合程度高,利用该回归方程模型优化复合酶制备干酪素工艺可行。显著性检验结果可见,一次项A(复合酶添加量)、B(凝乳温度)、C(凝乳pH)、D(凝乳时间)显著,二次项AB、A2、B2、C2和D2极显著(P<0.01),AC、AD和BC显著(P<0.05),因此干酪素出品率变化复杂,各因素对出品率影响非简单线性关系。各因素对出品率(Y)影响依次为:B(凝乳温度)>D(凝乳时间)>A(复合酶添加量)>C(凝乳pH)。
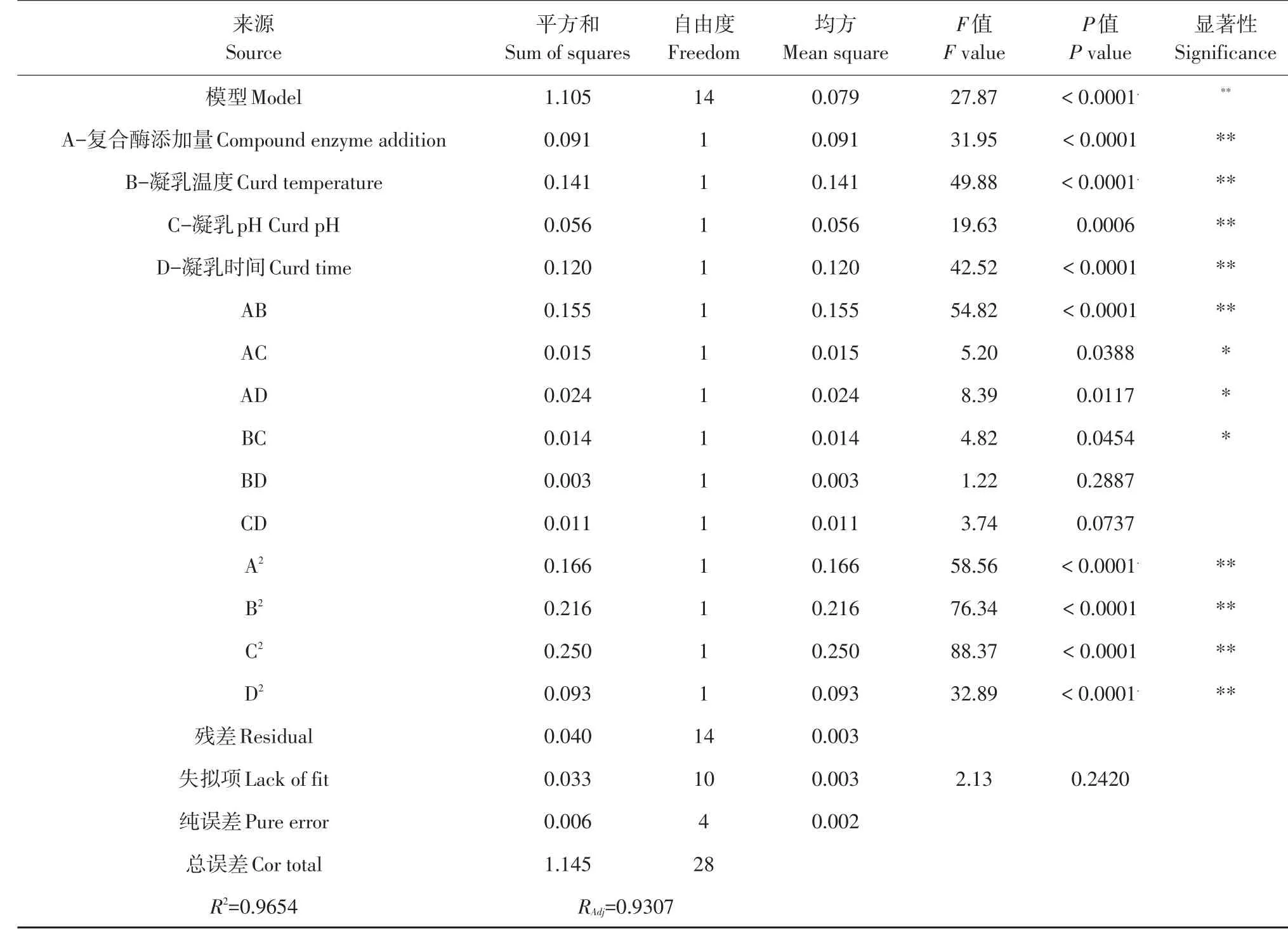
表5 响应面模型方差分析Table 5 Response surface model variance analysis
由图6a可知,复合酶添加量(A)和凝乳温度(B)存在极显著交互作用。随复合酶添加量和凝乳温度上升,干酪素出品率呈先升后降趋势。凝乳酶主要通过水解酪蛋白Phe 105-Met 106肽键,促进凝乳。酶量和温度增加,可提高凝乳酶活力和凝乳反应速率。结合响应面可见,复合酶添加量少,凝乳温度低时,干酪素出品率较低,与单因素分析一致,但过高温度和酶添加量降低酶活力,出品率下降,与吴晗等优化牦牛乳酸凝干酪制备工艺[21]研究结果一致。由图6b可知,干酪素出品率随复合酶添加量和pH增加先升高,添加量约为0.015%时达到最大值后下降。由图6c可知,干酪素出品率随复合酶添加量增加呈先升后降趋势,因凝乳酶水解作用降低出品率。由图6d可知,干酪素得率随温度和pH增加呈先升后降趋势,因较低pH下凝乳酶水解酪蛋白作用较弱,出品率较高,而在中性条件下,水解作用较强,导致出品率下降[22]。由图6e可知,干酪素得率随脱脂乳pH和凝乳时间改变,出品率先增后减。刘佳等也证实凝乳时间过长或过短影响凝乳质地,增加水洗过程中损失,导致出品率降低[23]。
综合单因素及响应面试验结果,得到使用该复合酶制备酪蛋白最佳工艺条件为:复合酶添加量0.014%,凝乳温度48.09℃,脱脂乳pH5.98,凝乳时间11.57 min,在此条件下酪蛋白理论出品率为2.94%。为方便试验操作,将工艺参数调整为:酶添加量0.014%,温度48℃,pH 6.0,时间11.5 min。按照调整后工艺参数作验证试验(n=3),结果为酪蛋白得率2.90±0.052%,与预测值2.94%接近。
2.3 常规理化指标检测结果
将复合酶制备干酪素与小牛皱胃酶制备干酪素作相关理化指标检测,结果见表6。可见,复合酶酪蛋白与小牛皱胃酶酪蛋白相比,蛋白质和酪蛋白含量略低,脂肪和水分含量略高,但差异不显著,均符合GB 3168-2016要求。但本试验制备复合酶成本低于小牛皱胃酶,具有开发前景。

表6 复合酶制备酪蛋白与小牛皱胃酶制备酪蛋白理化指标差异Table 6 Differences in physicochemical indices between casein prepared by mixed protease and casein prepared by calf rennet(%)
2.4 SDS-PAGE分析
SDS-PAGE电泳分析结果如图7所示。酪蛋白电泳谱图主要包括分子质量<25 ku κ-酪蛋白条带,25~35 ku αs-酪蛋白条带和β-酪蛋白条带。由两个泳道条带位置一致,带宽接近,说明两种酪蛋白主要组分一致,无明显差异。
2.5 色度分析
色泽是评价干酪素品质标准之一,引起干酪素色泽变化主要因素为美拉德反应和脂质氧化[24]。a*值、b*值越大,表明红色度和黄色度越高;L*值越大,表明亮度越高,干酪素品质越好。由表7可知,小牛皱胃酶制备干酪素与复合酶制备干酪素在色度上差异不显著,说明该复合酶制备干酪素色泽较好,较接近小牛皱胃酶制备干酪素。
2.6 红外光谱分析
将小牛皱胃酶制备酪蛋白与复合酶制备酪蛋白用傅里叶变换红外光谱仪检测,结果见图8。
由图8可知,两种酪蛋白之间,各特征峰之间位置、峰形十分接近,说明两者组成一致。在3 400 cm-1处有N-H伸缩振动和O-H振动,复合酶制备干酪素3 400 cm-1呈较宽吸收峰,可能是干酪素中存在大量分子内或分子间氢键造成。在2 960 cm-1处有CH3不对称拉伸振动,2 885~2 865 cm-1处有CH3对称振动,1 654 cm-1处有C=O伸缩振动,1 541 cm-1处有C-N伸缩振动和N-H变形振动,1 470~1 440 cm-1处有CH3不对称变形振动,1 443 cm-1处有C-N伸缩在1 390~1 370 cm-1处CH3振动分裂为两个峰,说明有C上连接1个以上甲基。以上均为蛋白质分子特征吸收峰[25],说明采用复合酶制备干酪素与小牛皱胃酶制备干酪素组成接近,不同酶处理并未改变干酪素结构。
根据王晓琳等1 700~1 600 cm-1酰胺Ⅰ区谱图作二阶导数分析可预测蛋白质二级结构[26]。对二阶导数谱图使用Peak Fit软件拟合,拟合后峰面积分析得到各二级结构占比,其中1 660~1 650,1 640~1 620,1 690~1 670,1 650~1 640 cm-1拟合后峰面积之和分别代表α-螺旋、β-折叠、β-转角和无规卷曲所占比例。两种酪蛋白二级结构中各部分占比见表8。
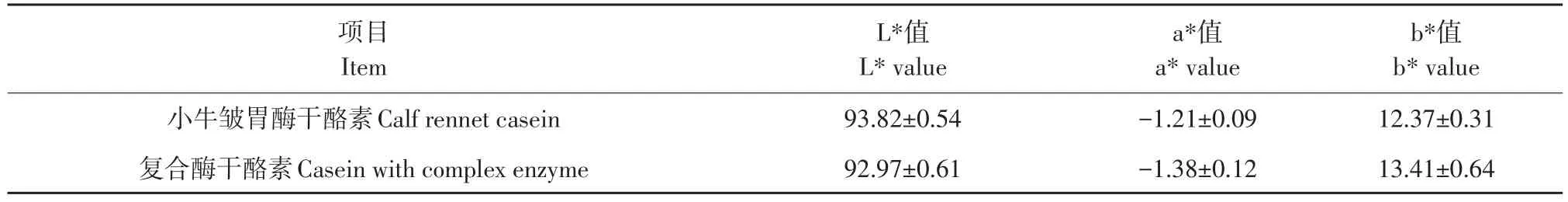
表7 小牛皱胃酶制备酪蛋白与复合酶制备酪蛋白色度Tabie 7 Chroma of casein prepared by calf rennet and casein prepared by complex enzyme

表8 复合酶干酪素与小牛皱胃酶干酪素二级结构组成Table 8 Secondary structure composition of casein with complex enzyme and calf rennet casein (g·100 g-1)
通过分析二级结构,两种酪蛋白,在α-螺旋、β-折叠、β-转角和无规则卷曲所占二级结构比例上存在差异。与小牛皱胃酶制备酪蛋白相比,复合酶制备干酪素α-螺旋含量略多,β-折叠显著增多,β-转角和无规则卷曲略降。蛋白质二级结构显著影响酪蛋白分子三维空间结构,其中α-螺旋结构最紧凑,空间排布有序,不包含空腔结构,β-折叠与β-转角结构相对α-螺旋更松散,但三维空间排布有序,无规则卷曲则为无序松散结构[27],复合酶制备干酪素拥有更多α-螺旋与更少无规则卷曲,表明其三维空间结构更致密,性质更稳定。
3 结论
以鲜牛乳为原料,通过多酶复合试验确定胃蛋白酶、风味蛋白酶和中性蛋白酶最佳配比为0.41∶0.29∶0.30,干酪素出品率可达2.44%。再根据响应面设计优化复合酶制备干酪素工艺条件参数,各因素对干酪素出品率影响依次为凝乳温度>凝乳时间>复合酶添加量>凝乳pH,得到最佳干酪素制备条件,经验证,酶添加量0.014%,温度48℃,pH 6.0,时间11.5 min条件下出品率为2.90%±0.052%,与理论值接近。将复合酶制备干酪素与小牛皱胃酶制备干酪素相比,两者在红外光谱特性等理化指标上差异不显著,均符合酪蛋白产品质量要求,表明本试验制备干酪素品质较高,所需凝乳酶来源广、价格低,可降低高品质干酪素生产成本。
