植物乳杆菌Lp229v 饲喂奶牛效果研究
2020-09-10张永根崔梓琪徐宏建
张永根,崔梓琪,姜 鑫,徐宏建
(东北农业大学动物科学技术学院,哈尔滨 150030)
奶牛泌乳早期和高峰期产奶能量需求与日粮供给不平衡,脂肪组织中脂肪酸动员增加,易引起肝脏中脂质积聚和肝功能受损,影响奶牛健康和泌乳性能。益生菌因具有提高动物饲料效率、生产性能和健康水平作用而备受关注。
益生菌作为一类活性微生物,可调节奶牛瘤胃发酵模式、提高生产性能[1]。乳酸菌作为最常用益生菌,可在奶牛体内作为生长促进剂,预防肠道感染、减缓应激反应、刺激宿主免疫应答、提高产奶量[2]。植物乳杆菌Lp299v(Lactobacillus plantarum 299v,DSM9843)是一种源自人类肠道的革兰氏阳性菌,具有抗炎特性和保护肠道屏障作用。Johansson等研究表明,Lp299v在人类上消化道中具有较高存活率,可增加粪便中乙酸和丙酸浓度[3]。Klarin等研究指出Lp299v可降低梭菌感染患者腹泻发生率[4]。Frida等研究表明,孕期和哺乳期大鼠饲喂Lp299v,对其后代肠道及相关器官生长和功能具有促进作用[5]。Michael等研究指出,Lp299v可增强机体铁吸收能力,提高免疫力[6]。
目前Lp299v研究主要集中在人类和单胃动物方面,奶牛领域研究较少。因此,本试验通过对奶牛添加不同剂量Lp299v,旨在探讨其对奶牛营养物质消化、泌乳性能、血液指标和肠道微生物菌群影响,明确Lp299v饲喂奶牛效果,为Lp299v在反刍动物领域应用提供理论基础。
1 材料与方法
1.1 植物乳杆菌Lp299v培养
Lp299v(菌号:DSM9843)由中国工业微生物菌种保藏管理中心提供。首先在MRS肉汤培养基中于37℃,180 r·min-1活化24 h。将1 mL活化培养物再次接种到MRS肉汤培养基中,在上述条件下继续培养24 h。3 000 r·min-1离心20 min后,获得沉淀物用生理盐水冲洗2次,加入25 mL无菌蒸馏水,调节菌浓度为1×1010cfu·mL-1。使用MRS琼脂培养基作平板计数统计Lp299v菌落数。所得悬浮液饲喂奶牛。
1.2 试验设计
试验于2019年6~8月于哈尔滨完达山奶牛养殖有限公司开展。涉及动物试验均按照东北农业大学动物科技学院动物护理与使用委员会(协议编号:NEAU-[2011]-9)规定执行。试验采用3×3拉丁方设计,选取6头健康荷斯坦奶牛:体重(625±12.3)kg;泌乳天数(52±3.8)d;产奶量(32.1±1.68)kg;胎次=2,随机分为对照组、低剂量组(添加量为0.5×1011cfu·头-1·d-1Lp299v)和高剂量组(添加量为1×1011cfu·头-1·d-1Lp299v)。试验期28 d,21 d为适应期,7 d采样期。奶牛于每日6:00~6:30和18:00~18:30挤奶2次,并在挤奶后投放全混合日粮(日粮配方见表1)。试验期内,奶牛单栏饲养(4 m×5 m),可自由采食(约5%剩料量)和饮水。
1.3 日粮和粪样采集
于试验每期第22~28天称量每日提供和剩余全混合日粮重量(kg),计算干物质采食量(Dry matter intake,DMI)。于试验每期第26、27和28天每日6:30和18:30分别收集饲料和粪便样品各500 g,将两次采集粪便和饲料样品单独混合均匀,-20℃保存,用于测定全消化道表观消化率。此外,取每期第28天收集粪便样品5 g于10 mL冻存管,立即保存至液氮,分析细菌群落组成。
1.4 奶样和血液采集
于试验每期第26、27和28天记录奶牛每日泌乳量,分别收集两次奶样50 mL,按照产奶体积比例将收集奶样混合均匀(50 mL)。添加少量重铬酸钾于混合后奶样,4℃保存,用于乳成分分析。于试验每期第26、27和28天,每日晨饲前使用无菌真空采血针在空腹奶牛尾静脉处收集血液样品15 mL,置于3个5 mL肝素钠管(哈尔滨双环农林生物技术开发有限公司)。2 000 r·min-1离心20 min后,将获得血浆样品转移到10个1.5 mL清洁离心管中,-20℃保存,用于分析血浆相关参数。

表1 全混合日粮原料和化学组成(%干物质)Table 1 Ingredients and chemical composition of total mixed ration(%of dry matter)
1.5 全消化道消化率和乳成分分析
根据Lee和Hristov描述方法,利用日粮和粪便中不可消化中性洗涤纤维(NDF)含量作为内源标志物估计营养成分全消化道消化率[8]。将保存的饲料和粪便样品于65℃下干燥72 h,并通过1 mm筛网粉碎。样品中粗蛋白(CP)和干物质(DM)含量参照AOAC[9]方法测定。根据文献[10]方法,使用全自动纤维分析仪(安康科技公司,马其顿市,纽约州,美国)分析热稳定α-淀粉酶处理后样品中NDF和酸性洗涤纤维(ADF)含量。根据Huhtanen等描述方法[11],将样品在瘤胃原位培养288 h后测定NDF含量。
牛奶样品送至黑龙江农垦科学院,使用全自动近红外牛奶分析仪(MilkoScan,Foss Electric,Hillerød,Denmark)测定CP、脂肪、乳糖和尿素氮(MUN)浓度以及体细胞数(SCC)。
1.6 血浆参数分析
血浆样品送至北京华英生物研究所,采用全自动生化分析仪(HT82-BTS-330,北京西华科技有限公司)测定血浆中甘油三酯(TG)、胆固醇(CHOL)、非酯化脂肪酸(NEFA)、尿素、葡萄糖和β-羟基丁酸(BHBA)浓度。
使用市售试剂盒(南京建城生物工程研究所)测定血浆过氧化氢酶(CAT,试剂盒号:A007-1-1,钼酸铵法)、总超氧化物歧化酶(T-SOD,试剂盒号:A001-1-2,羟胺法)、谷胱甘肽过氧化物酶(GSH-Px,试剂盒号:A005-1-2,比色法)的浓度、丙二醛(MDA,试剂盒号:A003-1-2,硫代巴比妥酸法)、总抗氧化能力(T-AOC,试剂盒号:A015-1-2,比色法)浓度。操作步骤均参照试剂盒说明书。
血浆可溶性CD3(sCD3),可溶性CD4(sCD4),免疫球蛋白A(IgA),免疫球蛋白G(IgG),免疫球蛋白M(IgM),硫代甲状腺素(T3),甲状腺素(T4)和催乳素(PRL)浓度使用ELISA试剂盒(北京中生北控生物科技股份有限公司)测定。操作步骤均参照试剂盒说明书。
1.7 粪便细菌群落分析
1.7.1 DNA提取和PCR扩增
参照omega M5635-02试剂盒说明方法提取粪便样品DNA,使用核酸纯化仪纯化。随后用PCR扩增仪扩增16S rRNA基因V3-V4区域,扩增引物为:338 F(5'ACTCCTACGGGAGGCAGCA 3') 和806 R(5'GGACTACHVGGGTWTCTAAT 3');扩增体系(25 μL)为:5×reaction buffer 5 μL,5×GC buffer 5 μL,dNTP(2.5 mmol·L-1)2 μL,Forwardprimer(10 μmol· L-1)1 μL,Reverseprimer(10 μmol· L-1)1 μL,DNA Template 2 μL,ddH2O 8.75 μL,Q5 DNA Polymerase 0.25 μL;扩增参数为:预变性98℃2 min;变性98℃15 s,退火55℃30 s,延伸72℃30 s,25~30个循环,延伸72℃5 min(注:调整退火温度以确定最佳温度,根据样品微调循环数,确保使用最少循环扩增出合格目标条带)。扩增产物通过2%琼脂糖凝胶电泳检测,采用AXYGEN公司凝胶回收试剂盒切胶回收目标片段。随后参照电泳初步定量结果,对PCR扩增回收产物荧光定量,荧光试剂为Quant-iT PicoGreen dsDNA Assay Kit,定量仪器为Microplate reader。
1.7.2 测序文库制备和Illumina Miseq测序
采用Illumina公司TruSeq Nano DNA LT Library Prep Kit制备测序文库。先质检和定量文库,将合格上机测序文库梯度稀释后,经NaOH变性为单链上机测序。MiSeq测序仪作2×300 bp双端测序,相应试剂为MiSeq Reagent Kit V3(600 cycles)。
1.7.3 生物信息学分析
运用QIIME软件(Quantitative Insights Into Microbial Ecology,v1.8.0)识别疑问序列后,调用USEARCH(v5.2.236)检查并剔除嵌合体序列。经质量过滤后,参照Silva数据库(Release128,http://www.arb-silva.de)划分序列OTU单元。基于OTU分析结果获得其在门和属两个水平上的物种分布柱状图。采用Alpha多样性分析Ace、Chao1、Shannon及Simpson指数。
1.8 统计分析
使用SAS软件包(版本9.2,SAS Institute Inc.,Cary,NC)中Proc Mixed模型,用3×3拉丁方设计程序分析试验数据。模型为:Yijkm=μ+Ti+Pj+Ck+Sm+Eijkm,其中,Yijkm代表观测值,μ代表总体平均值,Ti代表处理固定效应,Pj代表周期固定效应,Ck代表不同处理奶牛随机效应,Sm代表固定平方效应,Eijkm代表残差。
此外,使用SAS软件包中正交试验模型分析Lp299v添加剂量效应。使用邓肯多重校正检验确定不同处理之间差异。其中,P<0.05代表显著差异,0.05<P<0.10表示有变化趋势。
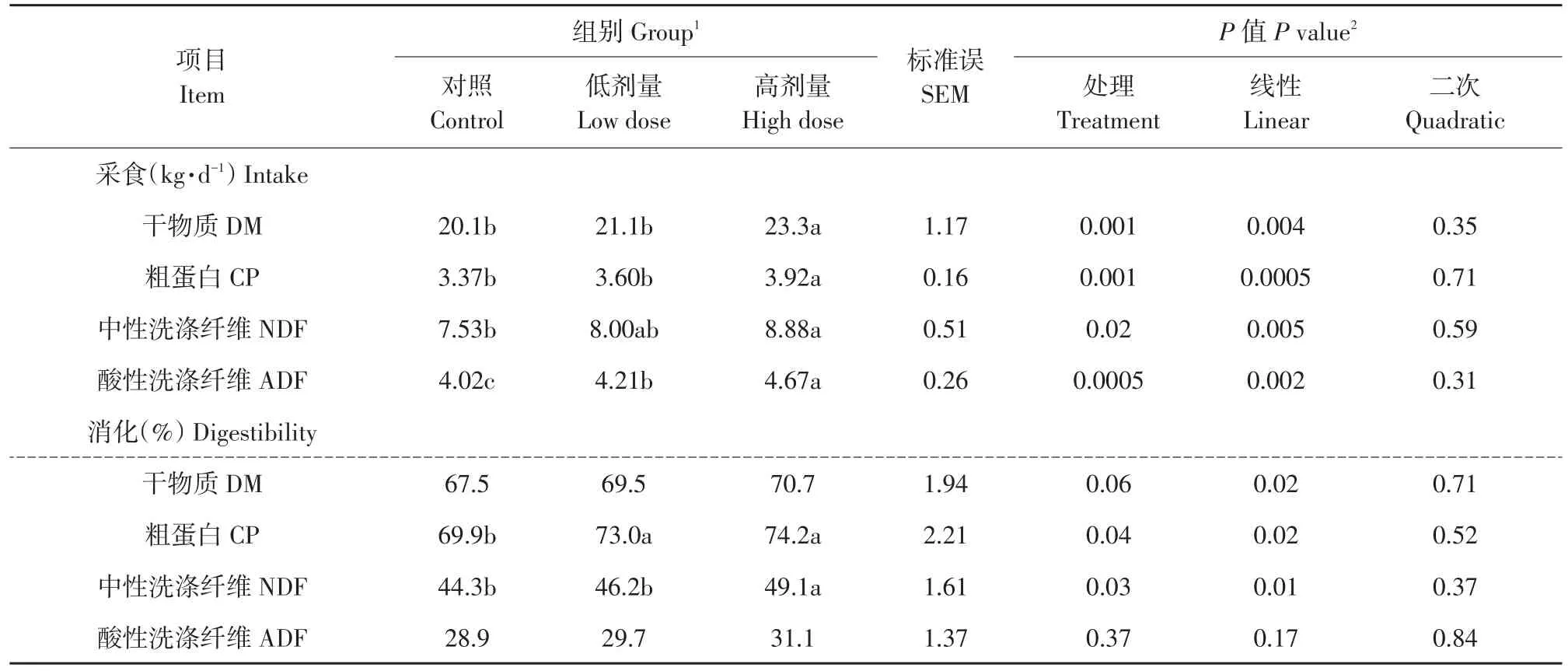
表2 Lp299v对奶牛采食和营养物质消化率影响Table 2 Effects of Lp299v on intake and nutrient digestibility in cows
2 结果与分析
2.1 采食和营养物质消化
Lp299v对奶牛采食和营养物质消化结果见表2。随Lp299v添加量增加,奶牛DM、CP、NDF和ADF采食量均呈线性(P<0.05)升高。与对照组相比,Lp299v饲喂高剂量组奶牛DM、CP、NDF和ADF采食量均显著(P<0.05)升高;Lp299v饲喂低剂量组奶牛ADF采食量显著(P<0.05)增加,而DM、CP和NDF采食量无显著差异(P>0.05)。高剂量组奶牛DM、CP和ADF采食量均显著(P<0.05)高于低剂量组,而两组间NDF采食量无显著差异(P>0.05)。
随Lp299v添加量升高,奶牛DM、CP和NDF全消化道消化率均呈线性(P<0.05)升高。与对照组相比,高剂量组奶牛CP和NDF消化率显著(P<0.05)增加,DM和ADF消化率无显著变化(P>0.05);低剂量组奶牛CP消化率显著(P<0.05)升高,而DM、NDF和ADF消化率无显著不同(P>0.05)。高剂量组奶牛CP消化率较低剂量组显著(P<0.05)增加,其他营养物质消化率在两组间无显著差异(P>0.05)。
2.2 泌乳性能
由表3可知,随Lp299v添加量增加,奶牛乳蛋白和乳糖产量及浓度均呈线性(P<0.05)升高,而乳中体细胞数呈线性(P<0.05)下降。与对照组相比,Lp299v饲喂高剂量组和低剂量组奶牛ECM、乳蛋白、乳糖产量和乳蛋白浓度均显著(P<0.05)增加,体细胞数显著(P<0.05)降低,且高剂量组乳蛋白浓度较低剂量组显著升高(P<0.05)。ECM、乳糖产量、乳蛋白浓度和体细胞数在高剂量组和低剂量组间无显著差异(P>0.05),且奶、4%FCM、乳脂产量、尿素氮、乳脂浓度和饲料转化率在各处理组间无显著差异(P>0.05)。

表3 Lp299v对奶牛泌乳性能影响Table 3 Effect of Lp299v on lactation performance in cows
2.3 血浆生化指标
由表4可知,与对照组相比,Lp299v饲喂高剂量组和低剂量组奶牛血浆葡萄糖浓度均显著(P<0.05)升高,且高剂量组较低剂量组显著(P<0.05)升高,因而呈线性增加,增加比率分别为8.0%和14.8%。各处理组间奶牛血浆甘油三酯、胆固醇、非酯化脂肪酸、尿素和β-羟基丁酸浓度无显著差异(P>0.05)。
2.4 血浆抗氧化指标
由表5可知,随Lp299v添加量增加,奶牛血浆GSH-Px浓度呈线性升高(P<0.05),而MDA呈线性下降(P<0.05)。与对照组相比,Lp299v饲喂高剂量组奶牛血浆GSH-Px浓度显著(P<0.05)增加,MDA浓度显著(P<0.05)降低,而低剂量组血浆GSH-Px和MDA浓度无显著差异(P>0.05)。各处理组间血浆CAT和T-SOD无显著差异(P>0.05)。
2.5 血浆免疫和激素指标
由表6可知,随Lp299v添加量增加,奶牛血浆IgA、IgG和sCD4浓度呈线性升高(P<0.05)。与对照组相比,Lp299v饲喂高剂量组奶牛血浆IgA、IgG和sCD4浓度显著(P<0.05)增加,而低剂量组无显著变化(P>0.05)。此外,各处理组间奶牛血浆IgM、sCD3、T3、T4和PRL浓度无显著差异(P>0.05)。
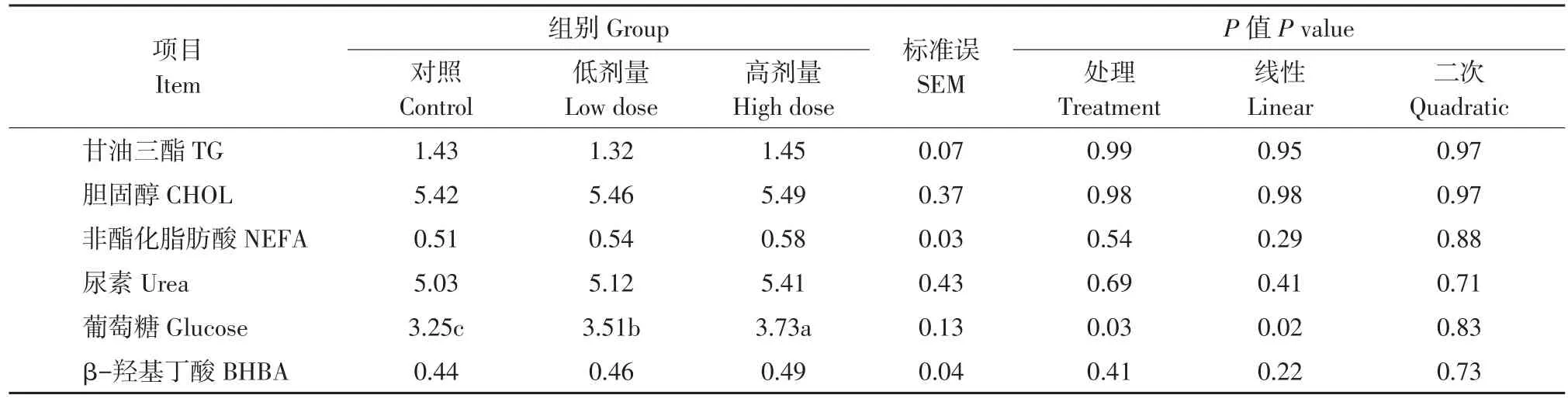
表4 Lp299v对奶牛血浆生化指标影响Table 4 Effect of Lp299v on biochemistry indicesin cows (mmol·L-1)
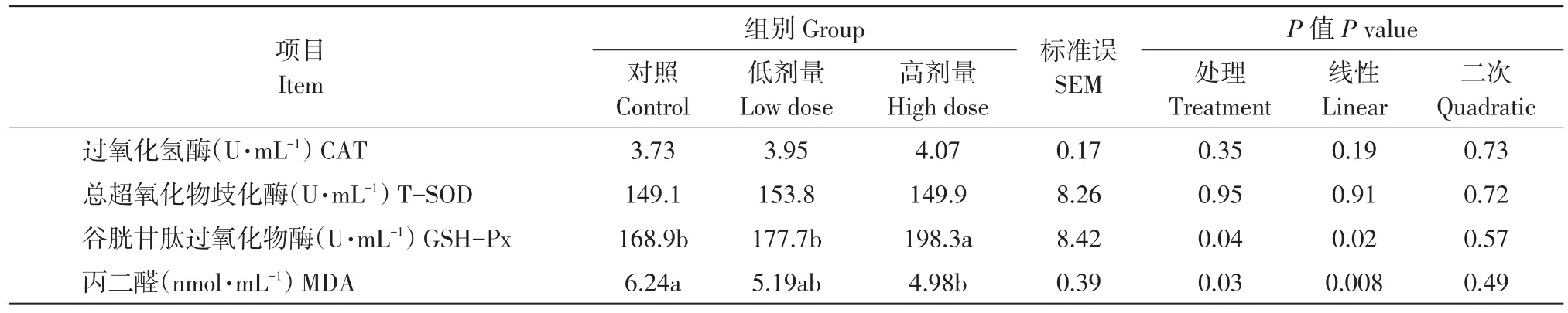
表5 Lp299v对奶牛血浆抗氧化指标影响Table 5 Effect of Lp299v on antioxidant indices in cows
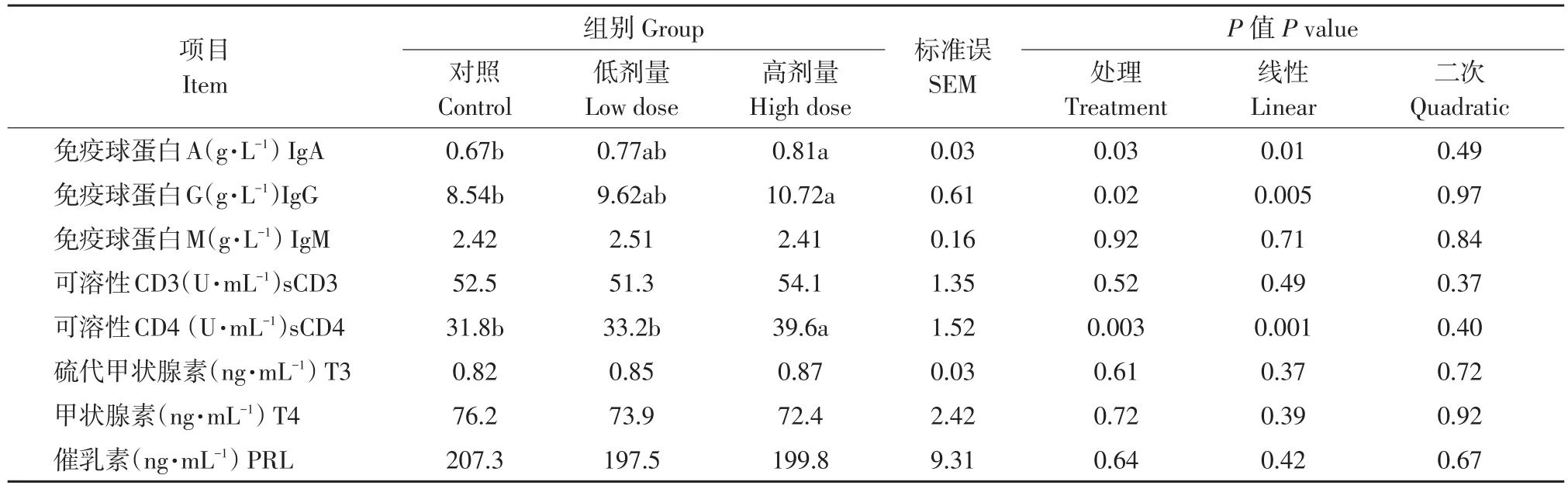
表6 Lp299v对奶牛血浆免疫和激素指标影响Table 6 Effects of Lp299v on immune and hormonal indices in cows
2.6 粪便细菌群落组成
如图1 A所示,在门水平上,随Lp299v添加量增加,奶牛粪便细菌拟杆菌门(Bacteroidetes)相对丰度呈线性(P<0.05)增加(对照vs.低剂量组vs.高剂量组=23.5%vs.27.3%vs.32.9%),且高剂量组拟杆菌门相对丰度较对照组显著(P<0.05)升高。相反,饲喂Lp299v奶牛粪便细菌厚壁菌门(Firmicutes,对照vs.低剂量组vs.高剂量组=69.0%vs.67.7%vs.61.4%)、放线菌门(Actinobacteria,对照vs.低剂量组vs.高剂量组=24.1%vs.20.2%vs.12.9%)和疣微菌门(Verrucomicrobia,对照vs.低剂量组vs.高剂量组=23.5%vs.9.17%vs.12.1%)相对丰度随Lp299v添加呈线性下降(P<0.05),且高剂量组和低剂量组疣微菌门相对丰度较对照组显著(P<0.05)降低,高剂量组厚壁菌门和放线菌门相对丰度较对照组显著(P<0.05)降低。各处理组间其他细菌相对丰度在门水平上无显著差异(P>0.05)。如图1 B所示,在属水平上,随Lp299v添加量增加,理研菌科RC9_gut_群(Rikenellaceae_RC9_gut_group,对照vs.低剂量组vs.高剂量组=6.93%vs.12.5%vs.14.4%)和普雷沃氏菌科UCG-003(Prevotellaceae_UCG-003,对照vs.低剂量组vs.高剂量组=0.84%vs.1.93%vs.4.11%)相对丰度呈线性增加(P<0.05),且均较对照组(P<0.05)显著升高。相反,饲喂Lp299v奶牛粪便细菌罗姆布茨菌属(Romboutsia,对照vs.低剂量组vs.高剂量组=9.04%vs.6.76%vs.3.57%)和普雷沃菌属_1(Prevotella_1,对照vs.低剂量组vs.高剂量组=6.94%vs.5.47vs.2.41%)呈线性降低,且高剂量组较对照组(P<0.05)显著降低。各处理组间其他细菌相对丰度在属水平上无显著差异(P>0.05)。
2.7 粪便细菌Alpha多样性
Lp299v对奶牛粪便细菌Alpha多样性指数影响见表7。随Lp299v添加量增加,奶牛粪便细菌Shannon和Simpson指数呈线性升高(P<0.05)。与对照组相比,Lp299v饲喂高剂量组奶牛粪便细菌Simpson指数显著(P<0.05)提高,而低剂量组无明显变化(P>0.05)。此外,各组间Shannon、Ace和Chao指数无显著差异(P>0.05)。
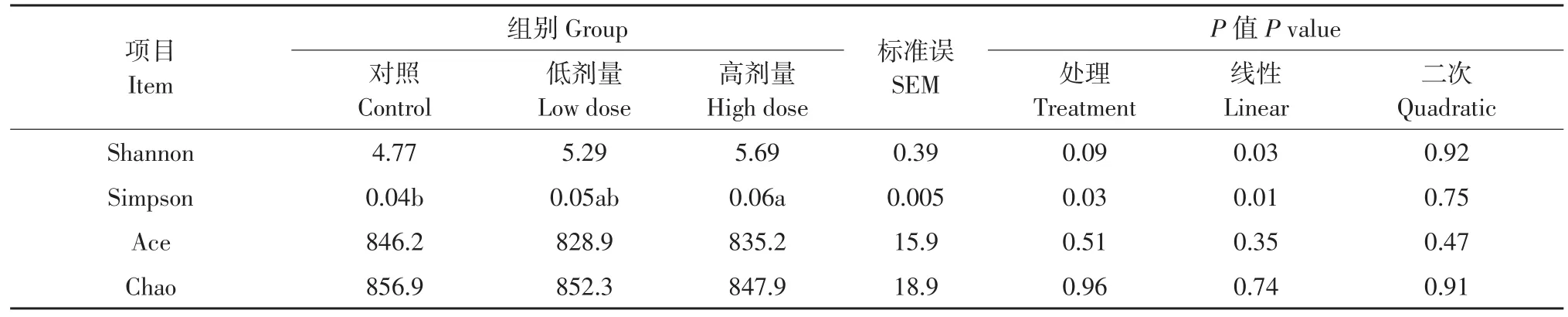
表7 Lp299v对奶牛粪便细菌Alpha多样性指数影响Table 7 Effect of Lp299v on fecal bacterial alpha diversity indices in cows
3 讨论
3.1 Lp299v对奶牛采食和营养物质消化影响
促进营养物质采食和消化对奶牛生产性能提高具有重要作用。艾日登才次克等研究发现饲喂复合乳酸菌奶牛采食量较对照组显著升高[12]。Jaquette等研究表明添加嗜酸乳杆菌BT1386可显著提高奶牛采食量[13]。但Raeth-Knight等研究指出奶牛饲喂嗜酸乳杆菌LA747后采食量无明显变化[14]。结果可能与不同乳酸菌特性不同有关。本试验发现添加Lp299v可显著提高奶牛DM、CP、NDF和ADF采食量,且随Lp299v添加量增加呈线性升高。添加乳酸菌可提高奶牛采食量[12-13],营养物质全消化道消化率情况未见报道。此外,Raeth-Knight等报道称添加嗜酸乳杆菌对奶牛营养物质消化率无显著影响[14]。相比而言,本研究饲喂Lp299v后奶牛CP和NDF全消化道表观消化率显著提高,且随Lp299v添加量增加呈线性升高,推测与添加Lp299v后奶牛肠道细菌群落组成改变有关。Durso等研究指出拟杆菌门可提高日粮中蛋白质、淀粉和纤维降解以及肠内肽和氨基酸吸收,有助于提高营养物质消化水平[15]。因此,饲喂Lp299v后奶牛粪便细菌拟杆菌门相对丰度提高可能导致CP和NDF消化率增加。本试验发现Lp299v可作为益生菌促进奶牛采食和消化,有助于提高奶牛泌乳性能。
3.2 Lp299v对奶牛泌乳性能影响
添加乳酸菌可提高奶牛乳脂率[2],本研究发现Lp299v添加对奶牛乳脂率和乳脂产量无显著影响,可能与乳酸菌功能特性不同有关。碳水化合物在奶牛瘤胃内降解为乙酸、丙酸和丁酸。乙酸和丁酸含量增加可促进血液中NEFA和BHBA升高,进而促进乳脂合成。丙酸可通过糖异生作用在血液中生成葡萄糖,促进乳糖合成。本研究发现,奶牛饲喂Lp299v后血浆葡萄糖浓度显著升高,NEFA和BHBA浓度无显著变化,推测因日粮中添加Lp299v奶牛乳糖产量和乳糖率提高,乳脂率和乳脂产量无变化。Jaquette等报道也发现乳酸菌饲喂可促进奶牛乳糖合成,但对乳脂合成无显著影响[13]。奶牛饲喂Lp299v后ECM、乳蛋白产量和乳蛋白率显著提高,且随Lp299v添加量增加呈线性升高,与蒋小艺等报道结果一致[2]。刘彩娟等研究发现饲喂乳酸菌可促进奶牛泌乳和乳蛋白合成[16]。Stein等研究指出血液葡萄糖升高可促进乳糖合成,提高产奶量[17]。此外,饲喂Lp299v后奶牛日粮中DM和CP全消化道表观消化率显著提高,说明奶牛消化吸收较多营养物质,尤其是蛋白质,可能是提高奶产量和乳蛋白合成原因。Zhou等研究发现,营养物质表观消化率提高有助于提高奶牛泌乳性能[18]。此外,试验还发现,添加Lp299v可显著降低乳中体细胞数,且随Lp299v添加量增加呈线性降低,可能为饲喂Lp299v后奶牛免疫能力提高所致。
3.3 Lp299v对奶牛血液代谢影响
血液葡萄糖对动物维持正常体温和生理活动具有重要作用[19]。对泌乳奶牛而言,葡萄糖可为奶牛泌乳提供能量,促进乳糖合成量和泌乳量[17]。本研究中,奶牛饲喂Lp299v后血浆葡萄糖浓度显著升高,且随Lp299v添加量增加呈线性升高。推测与添加Lp299v后奶牛采食量和营养物质消化率提高相关。Vol等报道称,动物消化吸收更多营养物有利于向血液葡萄糖转化[20]。关于乳酸菌引起奶牛血液葡萄糖浓度变化原因报道较少,Lp299v添加后奶牛血浆葡萄糖浓升高机理有待研究。
GSH-Px是一种过氧化物酶,在动物体内广泛存在,可将有毒过氧化物还原成无毒羟基化合物,提高机体抗氧化能力。MDA是脂质过氧化重要产物之一,其产生加重机体氧化损伤。本文饲喂Lp299v后奶牛血浆GSH-Px浓度显著升高,MDA浓度显著下降,且分别随Lp299v添加量增加呈线性升高和降低,说明Lp299v可提高奶牛抗氧化能力。推测因Lp299v作为氢质子或电子的供体,可终止自由基链锁反应并与金属离子结合,发挥抗氧化作用。张志军研究发现,饲喂含复合乳酸菌可降低血浆中丙二醛含量,提高绵羊抗氧化能力,与本研究结果一致[21]。
乳酸菌在免疫系统调节方面具有重要作用。乳酸菌进入动物体内后与肠道菌群及上皮细胞、免疫细胞相互作用,同时触发和刺激免疫反应,产生抗体,提高机体免疫力[22]。目前研究仍未发现某特定乳酸菌可应用于奶牛生产,发挥免疫功能。一方面不同乳酸菌种发挥免疫功能效果不同;另一方面奶牛瘤胃微生物影响乳酸菌在肠道发挥作用。本试验发现,Lp299v低剂量组奶牛血浆免疫指标较对照组无显著差异,但高剂量组奶牛血浆IgA、IgG和sCD4浓度升高。可能因Lp299v添加量升高可抑制肠道有害菌生长,发挥免疫作用。
3.4 Lp299v对奶牛粪便细菌群落影响
肠道微生物群落组成结构在改善动物生理、健康和生产力方面具有重要作用。研究表明,乳酸菌可通过在动物肠道内定植调整肠道细菌群落组成结构[23]。本研究发现,粪便样品中相对丰度最高为厚壁菌门,其次为拟杆菌门。与Daniela等报道一致,厚壁菌门和拟杆菌门为奶牛肠道中优势菌门[24]。关于不同处理组间结果,饲喂Lp229v奶牛粪便细菌拟杆菌门相对丰度较对照组显著提高,且随Lp229v添加量增加呈线性升高。普雷沃氏菌科UCG-003属于拟杆菌门,随Lp229v添加量增加呈线性升高。研究表明,拟杆菌门细菌成员主要功能为日粮中营养物质消化吸收,拟杆菌门相对丰度升高说明Lp229v添加有助于奶牛消化吸收营养物,提高泌乳性能。Rice等研究指出肠道细菌拟杆菌门与厚壁菌门相对丰度呈负相关[25]。与上述结果一致,奶牛粪便细菌厚壁菌门相对丰度随Lp229v添加量增加呈线性降低。此外,粪便细菌Shannon和Simpson指数随Lp229v添加量增加呈线性升高,说明添加Lp229v可丰富奶牛肠道微生物多样性,有助于促进奶牛健康。奶牛肠道微生物群落组成复杂,Lp229v影响肠道细菌机理仍需进一步研究。
4 结论
本研究表明,添加Lp299v可提高奶牛营养物质消化率、泌乳性能、抗氧化和免疫功能、调整肠道细菌群落组成。Lp299v饲喂奶牛推荐添加剂量为1×1011cfu·头-1·d-1。
