2型糖尿病合并慢性肾脏疾病患者肾小球滤过率与胰岛素抵抗指数的相关性研究
2020-09-08于艳梅胡嘉庆子高志辉王毅祯
高 岩,于艳梅,胡嘉庆子,高志辉,王毅祯
(1.佳木斯大学,黑龙江 佳木斯 154000;2.牡丹江心血管病医院糖尿病分院,黑龙江 牡丹江 157000)
据统计,在我国20 岁以上的人群中,糖尿病总体患病率为11.6%,患病人数高达1.14 亿。其中,未诊断的糖尿病患者占总数的63%[1]。高发病率、低诊断率易导致糖尿病并发症的发生。糖尿病肾病是糖尿病特有的微血管并发症之一,也是目前引起终末期肾病(ESRD)的首要原因。糖尿病肾病起病隐匿,一旦进入大量蛋白尿期后进展至ESRD 的速度是其他肾脏疾病的14 倍[2]。当糖尿病合并慢性肾脏疾病的患者其肾小球滤过率(eGFR)下降时,无论胰岛自身分泌的胰岛素还是外源注射的胰岛素,体内代谢清除速率均有所减慢,造成胰岛素蓄积、血糖水平下降。然而在临床工作中发现,当患者的eGFR 处于45~60 mL·(min·1.73m2)-1时,即使注射大量的外源性胰岛素血糖仍不易调控。而当eGFR 降至15 mL·(min·1.73m2)-1以下,尤其处于尿毒症期的患者,给予小剂量的胰岛素治疗仍容易出现低血糖症状。因此,本研究通过探讨eGFR 与Homa-IR(CP)之间的相关性来反映胰岛素抵抗与肾脏功能损伤之间的关系,从而为精准化的临床治疗提供理论依据。
1 材料与方法
1.1 研究对象本研究筛选2015 年1 月至2019 年6 月于牡丹江心血管病医院糖尿病分院住院并确诊为2 型糖尿病(T2DM)合并慢性肾脏疾病(CKD)的患者1 013 例。其中,男性529 例,女性484 例,平均年龄(62.93±10.35)岁。参考CKD 分组标准,将研究对象分为5 组:0~15 mL·(min·1.73m2)-1为A 组126 例;15~30 mL·(min·1.73m2)-1为B 组110 例;30~45 mL·(min·1.73m2)-1为C 组158 例;45~60 mL·(min·1.73 m2)-1为D 组213 例;60~90 mL·(min·1.73m2)-1为E组406例。
1.1.1 诊断标准根据1999 年WHO 标准诊断糖尿病。慢性肾脏疾病的诊断及分组标准则参照2007 年美国糖尿病并慢性肾脏病临床指南(K/DOQI)。
1.1.2 排除标准①患有胰腺炎或其他胰腺疾病;②患有糖尿病酮症酸中毒、高渗性昏迷等急性代谢紊乱性疾病;③患有高血压病;④存在急性肾功能损伤、肾脏恶性肿瘤等肾脏相关疾病;⑤存在急性活动性感染、手术等应激状态;⑥存在传染性疾病,如乙肝、结核等。
1.2 研究方法
1.2.1 病史采集通过患者的住院病历收集性别、年龄、身高、体重及治疗方案,并计算其BMI(BMI=体重kg/身高m2)。
1.2.2 生化指标检测嘱患者于次日清晨采集空腹血标本,送至本院检验科测定空腹血糖、空腹C肽、糖化血红蛋白、血肌酐及血脂谱。空腹血糖采用已糖激酶法、血肌酐及血脂谱采用酶法,均置于日本Beckman Coulter 公司的AU680 全自动生化分析仪中检测;血清C 肽测定采用磁微粒化学发光法置于Autobio-Auto Lumo A2000 全自动化学发光测定仪中检测。
1.2.3 计算Homa-IR(CP)及eGFRHoma-IR(CP)的计算公式为Homa-IR(CP)=1.5+FPG(mmol·L-1)×FCP(pmol·L-1)/2 800。eGFR 的计算公式为eGFR=175×Cr(mg·dL-1)-1.234×年龄-0.179(女性×0.79)。
1.3 统计方法使用SPSS 20.0 软件进行统计分析。计数资料用频数与百分比表示,并采用χ2检验。计量资料用均数±标准差表示,多组间比较采用方差分析。两变量相关性分析采用Pearson 相关系数。对eGFR的影响因素筛查采用Logistic回归分析法。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料的比较5 组研究对象BMI、空腹C肽、糖化血红蛋白、血肌酐、Homa-IR(CP)及胰岛素用量于组间差异均具有统计学意义(P<0.05)。见表1。
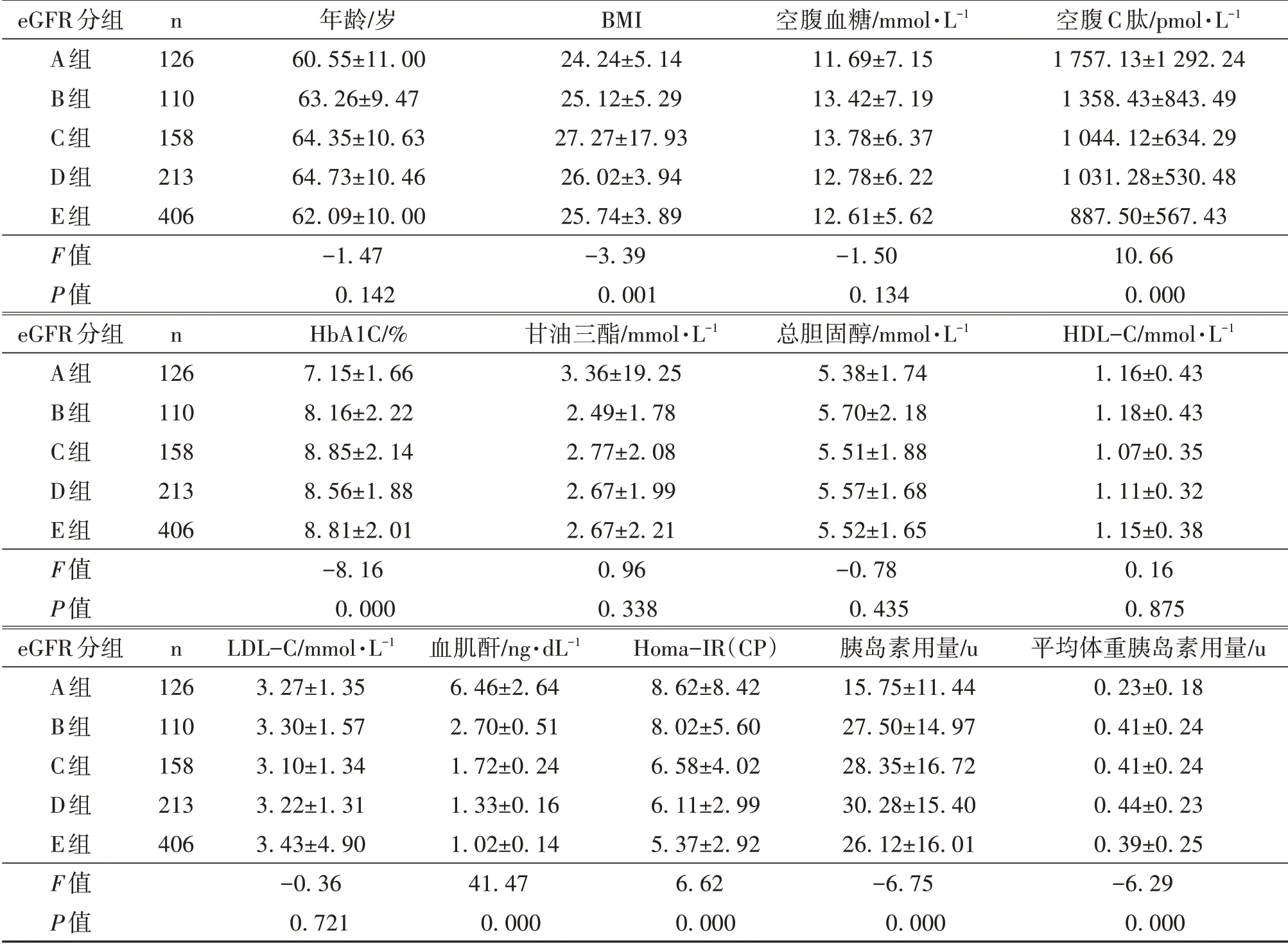
表1 5组研究对象基线资料与临床特征统计
2.2 eGFR 与各项指标的相关性分析Pearson 相关性分析表明,空腹C肽、血肌酐及Homa-IR(CP)与eGFR 呈负相关;HbA1C、胰岛素用量与eGFR 呈正相关(P<0.05)。结果可见,随着eGFR 的下降,Homa-IR(CP)呈上升趋势。见表2。
2.3 5 组患者空腹血糖、Homa-IR(CP)及胰岛素用量于组间两两对比结果Homa-IR(CP)A组、B组与其他组别差异有统计学意义,C 组、D 组与其他组别差异有统计学意义;空腹血糖A 组与B 组、C 组差异有统计学意义;胰岛素用量A 组与其他组别差异有统计学意义,D 组与E 组差异有统计学意义。即当患者eGFR 处于45~60 mL·(min·1.73m2)-1及15~30 mL·(min·1.73m2)-1两个阶段时,胰岛素抵抗程度较前一阶段明显加重。空腹血糖则于eGFR<15 mL·(min·1.73m2)-1时明显下降。患者胰岛素用量于eGFR 处于45~60 mL·(min·1.73m2)-1阶段明显增加,而小于15 mL·(min·1.73m2)-1后显著减少。见表3。
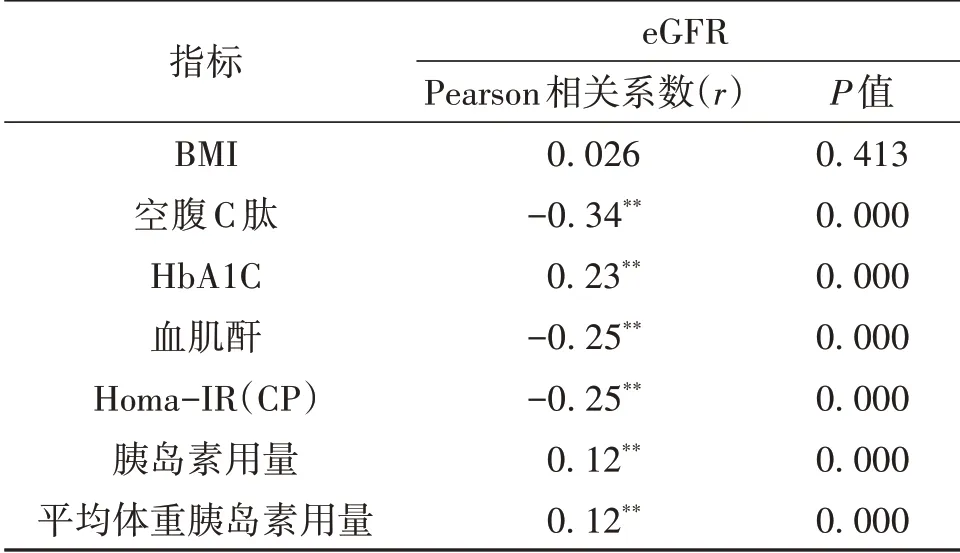
表2 各项指标与eGFR的相关性分析
2.4 eGFR 的影响因素分析将eGFR 分组作为因变量,组间具有统计学差异指标作为自变量,进行多分类Logistic 回归分析。结果显示,年龄、血肌酐是eGFR 处于0~90 mL·(min·1.73m2)-1阶段患者的主要影响因素,而Homa-IR(CP)则仅为A 组和B 组患者eGFR的影响因素。见表4。
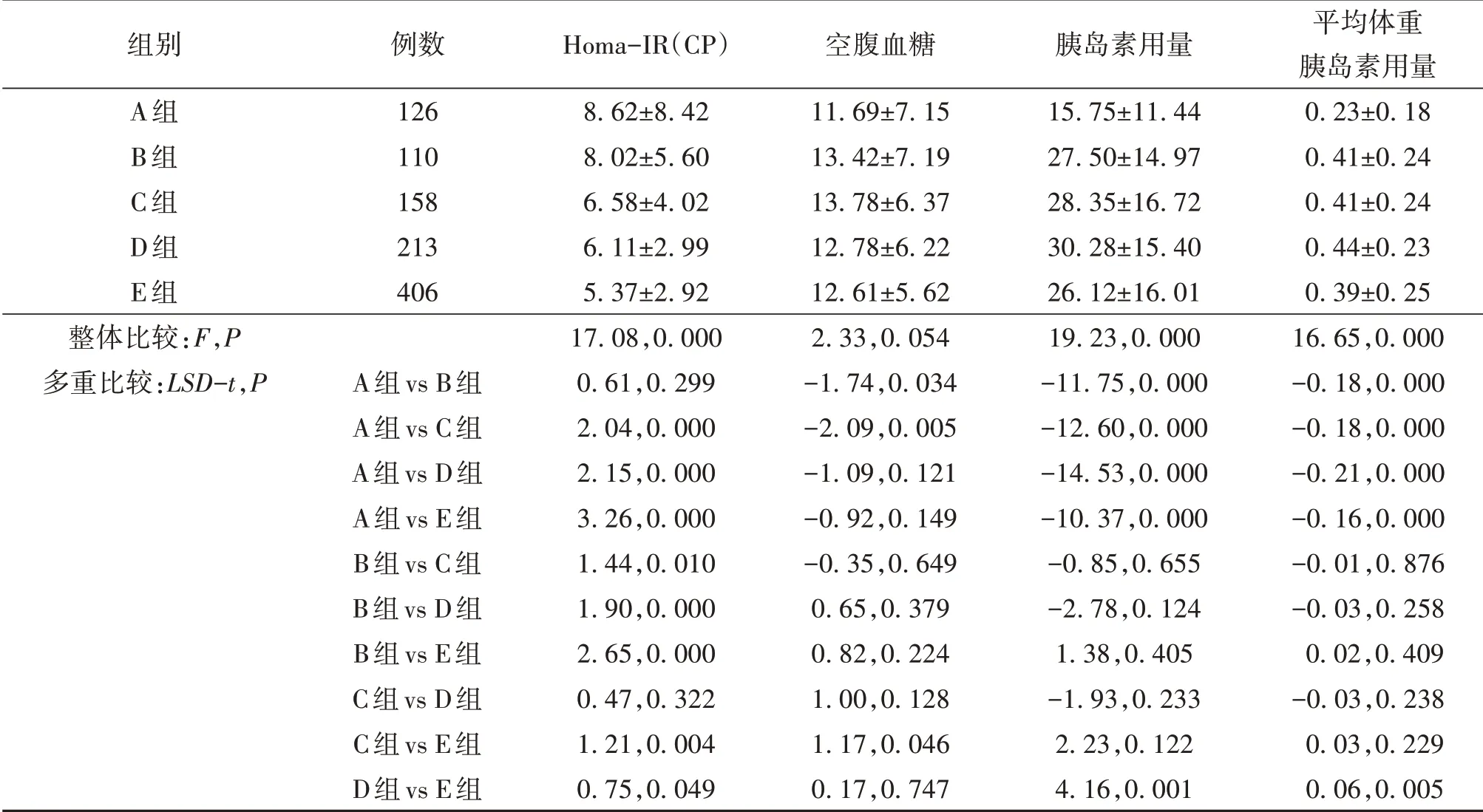
表3 5组患者空腹血糖、Homa-IR(CP)及胰岛素用量于组间两两对比结果
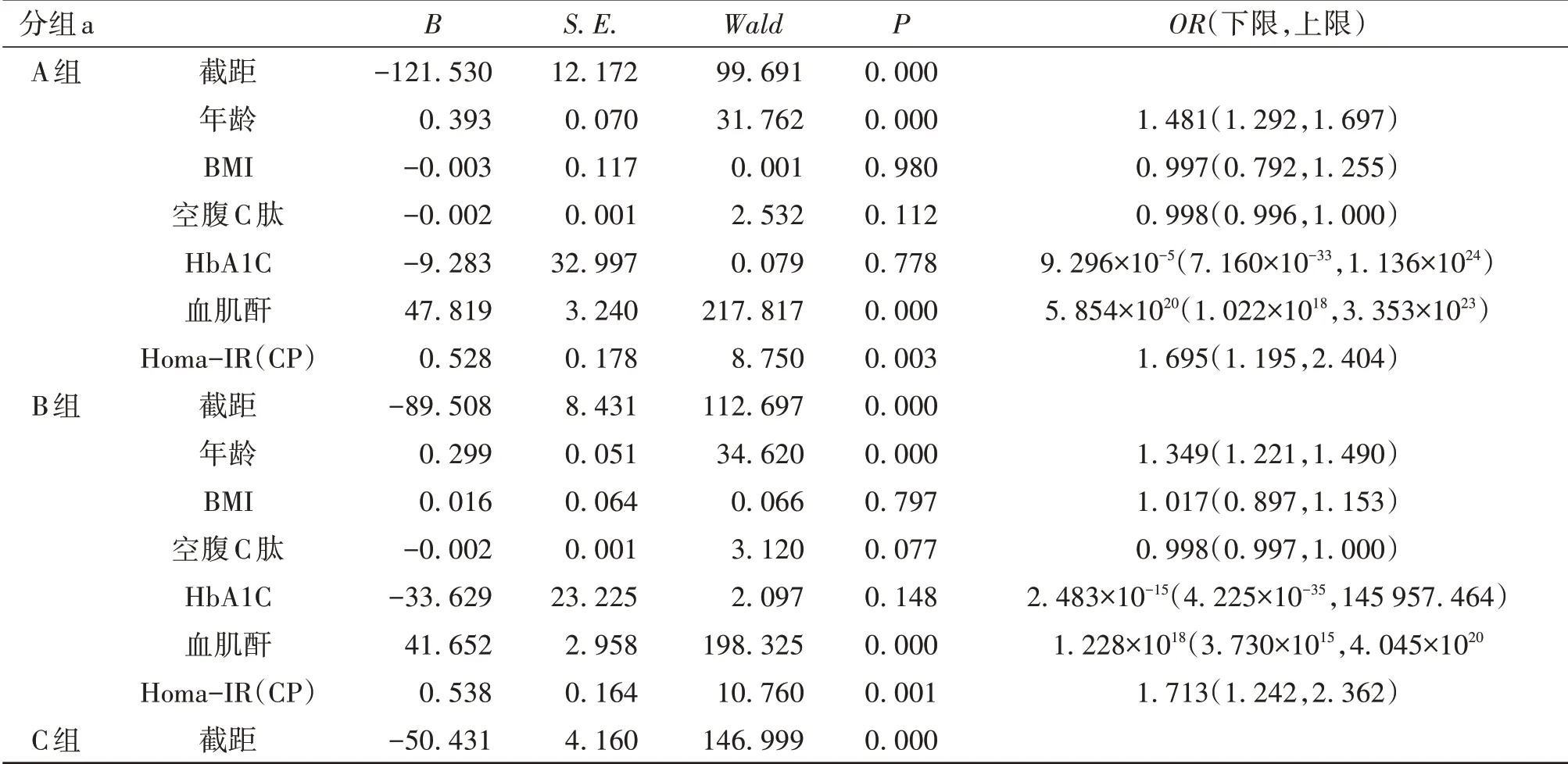
表4 eGFR影响因素的Logistic回归分析
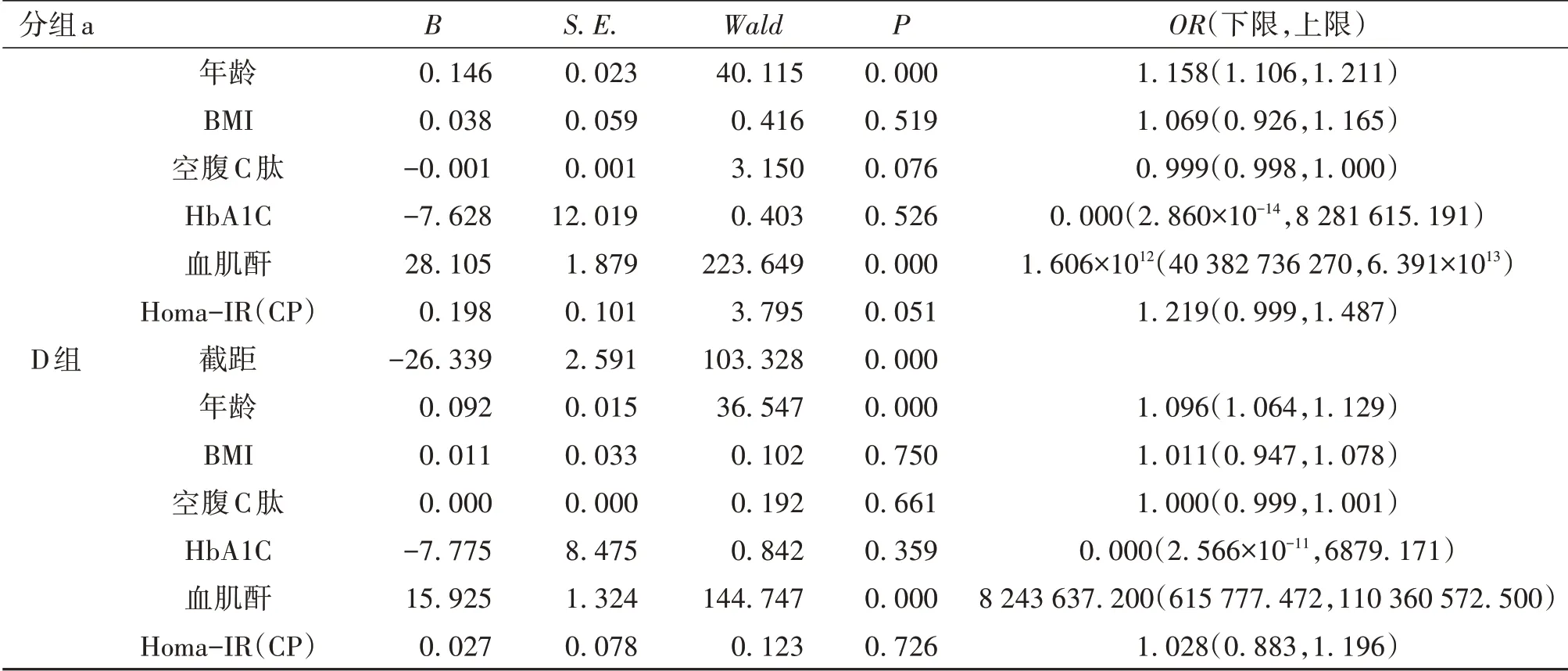
续表4 eGFR影响因素的Logistic回归分析
3 讨 论
胰岛素抵抗是糖尿病及慢性肾脏疾病发生的始动因素,也是贯穿于疾病始终的独立危险因子。研究表明[3-5],胰岛素抵抗与肾脏功能损伤之间存在负相关性,并且可以作为终末期肾病的独立预测因子。本研究发现,Homa-IR(CP)随着患者eGFR 的下降逐渐升高,并且是eGFR 水平的主要影响因素之一。DE COSMO 等实验表明,足细胞是肾小球滤过膜的主要组成成分,也是胰岛素敏感细胞。足细胞中NOD2表达的增加呈现葡萄糖依赖性,同时伴有促炎症因子的上升和MAPKs及NF-kB信号通路的激活。NOD2激活后的胰岛素信号通路水平、GLUT4转位及糖摄取量下降,均导致足细胞胰岛素抵抗的产生[6-7]。而在胰岛素抵抗的作用下,胰岛素介导的扩血管作用减弱,血管舒缩功能失调,导致肾小球毛细血管内高灌注、高压力、高滤过[8]。长期的“三高”现象使得内皮细胞受损、肾小球广泛硬化、足细胞进一步损伤,从而引起肾脏损害加重。因此,减轻患者的胰岛素抵抗程度,对延缓病程进展具有重要的意义。
研究显示,eGFR处于45~60 mL·(min·1.73m2)-1阶段的患者,其胰岛素抵抗程度与eGFR>60 mL·(min·1.73m2)-1组相比明显加重,且空腹血糖呈现升高趋势,给予胰岛素治疗量亦随之增加。这与真实世界中所观察到的现象相符。此时,随着肾脏功能的减退,患者的胰岛素抵抗加重、胰岛素敏感性降低,导致外源性胰岛素无法得到充分利用,血糖水平难以调控。而研究发现[9],波动性高血糖可引起动脉壁的急性损害,或氧化应激的直接毒性作用破坏内皮细胞,从而影响多种细胞因子的水平,导致肾脏进一步损伤。因此,处于本阶段的患者,在给予适量胰岛素的同时,联合合适的口服药来增加胰岛素敏感性、减轻胰岛素抵抗程度,可以有效的避免血糖波动带来的不利影响。
在本研究中eGFR<15 mL·(min·1.73m2)-1的患者,尽管胰岛素抵抗程度持续加重,但其血糖水平反而下降,胰岛素用量随之减少,在真实世界中可见低血糖症状的发生。有学者对糖尿病肾病患者并发低血糖的原因进行探析[10]:除去老年因素、应激状态、饮食不规律及药物因素外,肾性因素所致的低血糖更为多见。处于肾脏衰竭期的患者,胰岛素在肾脏的清除减少、半衰期延长,使血中游离胰岛素水平上升。同时尿毒症毒性物质使肝糖原合成酶活性降低、肝糖原合成减少,从而导致患者低血糖的发生。由此可见,本阶段的患者则应在多次给予血糖监测的同时及时减少注射外源性胰岛素的剂量,防止低血糖带来的危害。
综上所述,T2DM患者合并CKD其eGFR与Homa-IR(CP)呈显著负相关。处于eGFR 的不同阶段,患者的胰岛素抵抗程度、血糖水平均有所不同,给予的治疗方案理应有所改变。关注eGFR 水平的变化,胰岛素抵抗程度也在改变,这对避免血糖波动带来的不利影响有一定的临床意义。
