GPIIIa PLA2、PEAR1、PTGS1、GP1BA 基因多态性与阿司匹林抵抗的相关性研究
2020-09-08陈莉严浩毛士龙通讯作者
陈莉 严浩 毛士龙(通讯作者)
(1 上海市徐汇区中心医院药剂科 上海 200031)
(2 上海健康医学院药学院 上海 201318)
阿司匹林是用于防治心脑血管疾病的药物,然而,部分患者即便长期服用常规剂量的阿司匹林依然再次发生心脑血管事件,这一现象被称为阿司匹林抵抗(aspirin resistance, AR)[1]。Bhatt 和Topol 将AR 分为临床性及生化性,临床性抵抗是指服用正常剂量阿司匹林仍发生心血管事件;生化性抵抗是指服用阿司匹林后血小板聚集率未明显下降。AR 的确切机制还不明确,有研究认为患者的依从性差、药物的相互作用、C 反应蛋白血症、吸烟、糖尿病、高血脂症、高龄等因素会导致阿司匹林抵抗。最近的研究表明,基因多态性也是导致阿司匹林抵抗也的因素[2]。单核苷酸多态性导致不同个体的蛋白的结构或构象不完全相同,从而导致对阿司匹林的敏感性不同。
有文献报道COX-1、COX-2、血红素氧合酶1、ABCB1、PEAR1、PTGS1、PEAR1、GP1BA 等基因多态性与阿司匹林抵抗的发生相关[3]。但是,很多研究的样本量较小,在研究及探索的过程中存在很多未知、考虑不够全面、不够系统等,因此仍需继续开展大规模和不同种族人群的研究来证实基因多态性与AR的相关性[4]。我们收集2016 年12 月—2019 年7 月上海市徐汇区中心医院诊断为缺血性疾病并进行阿司匹林基因检测及血小板聚集率试验的患者,根据相关的指标进行筛选,最终选出1175 例患者。以花生四烯酸诱导的血小板聚集率的数值将患者分为两组,平均血小板聚集率≥20% 为阿司匹林抵抗(aspirin resistance,AR)组,小于20% 为阿司匹林敏感(aspirin sensitive,AS)组。分析GPIIIa PLA2、PEAR1、PTGS1、GP1BA这四个基因在该研究人群中的突变率,研究基因多态性与AR 的关系以及年龄、性别及合并症对AR 的影响。
患者的基因型的差异是导致阿司匹林抗血小板活性不同的重要原因,我们统计了GPIIIa PLA2、PEAR1、PTGS1、GP1BA 这四个基因的突变概率,研究了基因多态性与阿司匹林抵抗的关系以及年龄、性别及合并症对AR 的影响。帮助临床预测患者的阿司匹林抵抗风险,指导个体化抗血小板治疗,提高疗效。
1. 资料与方法
1.1 研究人群
回顾性收集2016 年12 月—2019 年7 月入院并完成GPIIIa PLA2、PEAR1、PTGS1、GP1BA 的基因检测的1297 例患者信息资料。入选标准:服用阿司匹林100mg/d,服药3 天后检测血小板聚集率。排除标准:阿司匹林哮喘;肝肾功能严重异常,血尿素氮≥20mmolfL,血肌酐≥445Ixmol / L;消化道溃疡;血小板计数>450×109·L-1或<100×109·L-1。最终筛选出1175 例患者,男性694 例,女性481 例,平均年龄(61.27±8.35)岁。
1.2 血小板聚集率检测
枸橼酸抗凝管采血3 ~5ml,比浊法进行血小板功能检测[2]。
1.3 基因位点测定
通过抽取抗凝血2ml(紫帽真空抽血管,EDTA 抗凝剂,采样时间与送检时间间隔不超过3 小时),用IVD 测序反应通用试剂盒(华夏时代基因科技有限公司)提取DNA,应用多重数字荧光染色分子杂交及杂交测序技术进行目标序列的检测。
1.4 统计学分析
2. 结果
2.1 基本情况
有99 例患者由花生四烯酸诱导的平均血小板聚集率≥20%,符合AR 诊断标准,发生率为8.43%;1076 例患者由花生四烯酸诱导的平均血小板聚集率<20%,符合AS 诊断标准,发生率为91.6%。
2.2 四个相关基因位点多态性
根据纳入标准,统计纳入的患者共1175 例,GPIIIa PLA2和PTGS1 基因的突变频率很低,分别为0.85% 和0.09%,GP1BA和PEAR1 的突变率分别为9.28% 和59.4%,见表1。
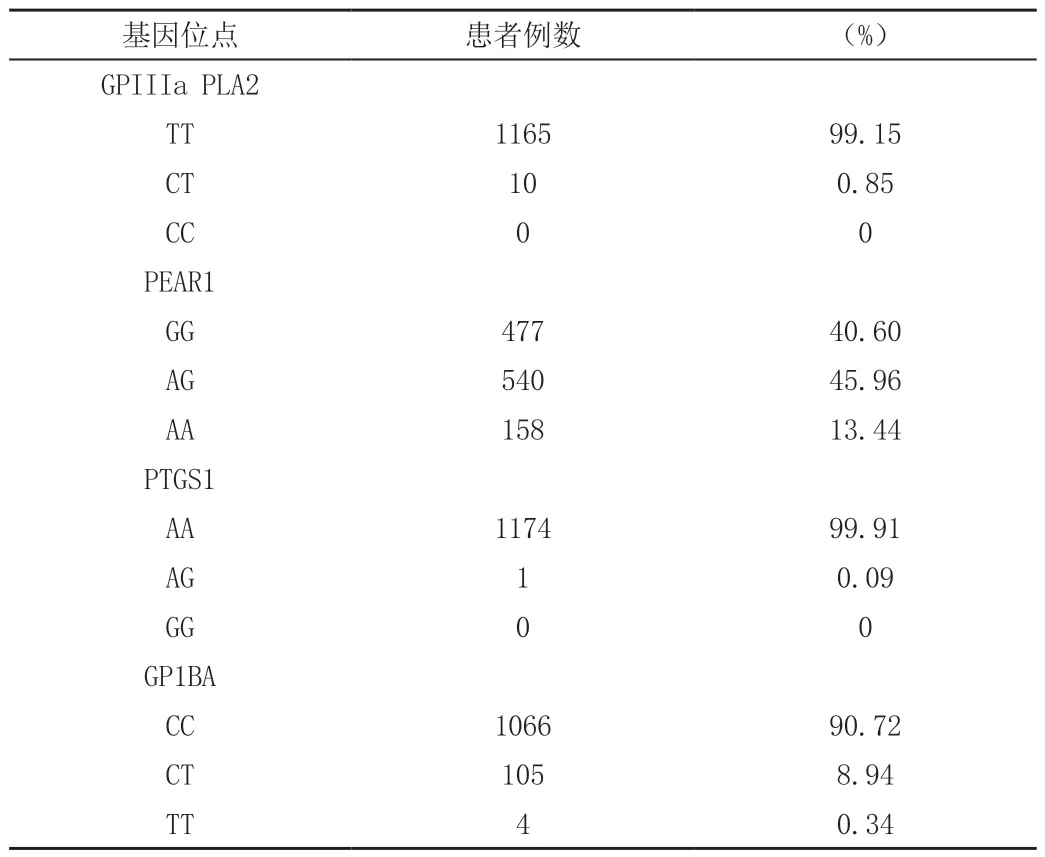
表1 三个基因位点的突变情况
2.3 AR 组与AS 组患者危险因素
为了进一步探讨导致阿司匹林抵抗的风险因素,我们对患者年龄、性别、2 型糖尿病、高血压等可能的危险因素分析。AR 组99 例,AS 组1076 例,两组患者的年龄、吸烟率、高血压发生率、总胆固醇、甘油三酯水平相比,无显著性差异(P>0.05),这些均不是导致阿司匹林抵抗的危险因素,见表2。AS 组患者糖尿病发生率明显低于AR 组,分别为14.96% 和43.43%(P<0.001);AR 组男性患者的比例显著高于AS 组,分别是64.65% 和41.82%(P<0.05);此外,AR 组患者的低密度脂蛋白水平显著高于AS 组(P<0.05)。表明患者的性别、低密度脂蛋白水平和2 型糖尿病是发生阿司匹林抵抗的独立危险因素,见表3。
表2 两组患者临床指标比较(±s)

表2 两组患者临床指标比较(±s)
组别 例数 年龄(岁)总胆固醇(mmol/L)甘油三酯(mmol/L)低密度脂蛋白(mmol/L)AR 组 99 58±11.33 5.11±3.27 1.76±0.85 3.37±0.53 AS 组 1076 61.37±8.55 4.95±1.73 1.82±0.74 2.97±0.75 t - 0.366 0.278 0.025 5.94 P - 0.773 0.54 0.69 0.03

表3 两组患者危险因素比较[n(%)]
2.4 PEAR1 基因多态性与阿司匹林抵抗的相关性
PEAR1 不同基因型的患者的血小板聚集率见表4。PEAR1 突变纯合型或突变杂合型患者的血小板聚集率均显著高于野生型患者(P=0.001,P=0.03)。

表4 PEAR1 基因多态性与血小板聚集率的相关性
2.5 GP1BA 基因多态性与阿司匹林抵抗的相关性
GP1BA 不同基因型的患者的血小板聚集率见表5。GP1BA 突变纯合型患者的血小板聚集率显著低于野生型患者(P=0.04),而突变杂合型与野生型相比无显著性差异(P=0.13)。GP1BA 野生型的患者发生阿司匹林抵抗的风险比突变型的患者高。

表5 GP1BA 基因多态性与血小板聚集率的相关性
3. 讨论
阿司匹林抵抗是由多种原因构成的,患者的依从性差、高龄、高脂血症、糖尿病、高血压、炎性疾病以及服用质子泵抑制剂或钙拮抗剂是其中的原因[5]。此外,相关基因的多态性也会导致AR,有文献报道COX-1、COX-2、血红素氧合酶1、ABCB1、PEAR1、PTGS1、PEAR1、GP1BA 等基因多态性与阿司匹林抵抗具有相关性[3]。但是,已有的文献报道还存在很多矛盾,比如范利等通过研究老年汉族心脑血管患者持续服用阿司匹林后发现,COX-1基因rs1330334与老年汉族人群阿司匹林抵抗有着显著相关性[6],然而,Habizal 的研究显示COX-1 基因CT50 单核酸与阿司匹林抵抗无关[7]。Wurtz 等研究发现,PEAR1 突变基因型AA 或AG 的患者阿司匹林抵抗的风险明显高于野生基因型GG 的患者[8],而石秀锦等对中国患者的研究表明PEAR1 突变杂合型较野生型患者的血小板聚集率增加程度不具有显著性差异(P=0.135)[2]。出现这些差异的原因可能是由于研究样本量较小,在研究及探索的过程中存在很多未知、考虑不够全面、不够系统以及人种差异等。因此,仍需开展进一步的研究来证实基因多态性与AR 的相关性。
我们在较大样本量的基础上研究了GPIIIa PLA2、PEAR1、PTGS1、GP1BA 这四个基因与AR 的关系,并探讨了年龄、性别、合并症(糖尿病、高血压、高血脂)对AR 的影响。
结果显示在中国人群中GPIIIa PLA2 和PTGS1 基因突变率较低,分别为0.85% 和0.09%,GP1BA 和PEAR1 突变率较高,分别为9.28% 和59.4%。
Verchuren 等研究了1327 例心梗患者,发现PTGS1 基因突变的患者AR 发生率显著升高(P=0.001)[9];Goodman 等报道了GPIIIa PLA2 基因多态性与AR 密切相关[10]。本次GPIIIa PLA2和PTGS1 基因突变的频率很低,无法进行关联性分析,GPIIIa PLA2 和PTGS1 基因与阿AR 的相关性还有待于大样本的进一步研究加以分析比较。
Lewis 等的研究发现,在高加索人与美国黑人中,PEAR1 的单核苷酸多态性与阿司匹林抗血小板疗效相关(P <0.05),携带AA 或AG 型的患者比野生基因型的患者发生心肌梗死的概率更高[11],我们在中国人群中也得出了相同的结论。
Fujiwara T 等研究发现,携带GP1BA 野生型CC 基因的个体较携带482T 突变基因的个体发生阿司匹林抵抗的风险更高[12],但本文未得到相同的结论,原因可能是人种差异,但仍需开展更大样本量的研究加以验证。
另外,有研究表明高龄、高血压史、LDL 水平高的患者发生AR 的风险更高,而本文对于高龄和高血压史等未得出相同结论,发现低密度脂蛋白水平高、男性、合并2 型糖尿病的患者发生AR 的风险更高。
