不同供镁水平对杉木幼苗叶片抗氧化酶活性和叶绿素含量的影响
2020-09-07费裕翀叶义全曹光球
刘 丽 ,费裕翀,路 锦,陈 钢,黄 樱,叶义全,2,曹光球,2*
(1.福建农林大学 林学院,福建 福州 350002;2.国家林业和草原局杉木工程技术研究中心,福建 福州 350002)
【研究意义】镁元素是植物体内的中量元素,主要存在于植物幼嫩器官和组织中,是叶绿素的重要组成成分和多种酶的催化剂[1-3]。镁原子处于叶绿素分子的中心位置,对细胞叶绿体结构的维持具有重要作用,也是叶绿素中唯一的金属元素[4]。叶绿体是植物细胞产生活性氧的主要场所,缺镁可改变PSⅠ系统中电子的传递方向,促使活性氧生成[5-6]。植物细胞中的活性氧处于动态代谢平衡状态,一旦活性氧的形成失控,代谢平衡被打破,过量活性氧会攻击碱基、蛋白质、脂质的结构和细胞膜系统,改变细胞膜透性,引发细胞内外代谢紊乱[7-10],或次生代谢物造成间接伤害,使细胞受到损伤,MDA 在细胞内累积[11-12]。此外缺镁会造成植物体内的淀粉、蔗糖、碳水化合物代谢受阻,含量积累[13-15]。【前人研究进展】陈伟立[16]在缺镁胁迫对‘砂糖橘’(Citrus reticulateBlanco cv.Shatangju)的研究中发现90 d 的缺镁胁迫导致植株叶片中活性氧积累,叶绿素含量显著降低,POD 和CAT 活性提高。李延等[17]对龙眼(Dimocarpus longanaLour.)的研究中发现,随缺镁胁迫加重,龙眼光合速率、蛋白质含量、核酸含量下降,细胞膜系统过氧化加剧,叶片衰老明显。缺镁影响植物正常生长和发育,但过量施镁同样也不利于植物生长[18]。施镁过量,影响植物对其它元素的正常吸收,植物营养失衡及生长量下降。凌丽俐等[18]研究表明,过量镁胁迫使纽荷尔脐橙(Citrus sinensisOsbeck‘Newhall’)嫩叶和老叶的叶绿素含量均降低,阻碍叶片光合作用。确定合理的施镁量,对于构建植物种的高效培育技术体系意义重大。【本研究切入点】杉木(Cunninghamia lanceolata)是我国独有树种,是我国南方主要造林速生树种之一[19]。杉木具有生长快、材质优良等特点,被广泛用于房屋建造、造船、家具等领域[20-21]。杉木生长、发育所需的镁主要来源是土壤。土壤中镁的丰缺与其理化结构、分子组成和土壤阳离子交换量等因素有关[22]。能被植物直接吸收利用的镁是有效镁,有效镁溶解于土壤溶液中,易移动易被吸收。长期以来,杉木连栽导致土壤地力不断下降,加之南方多雨天气对土壤的冲刷,使林地土壤镁含量风化淋失、养分下降、肥力匮乏。此外不合理的耕作和施肥措施等问题的频繁出现,土壤中的镁元素大量流失,植物的缺镁症状越加严重[23-24]。近年来,关于南方地区土壤缺镁现象已有较多报道。汪凤林等[25]研究表明,杉木幼苗缺镁抑制根系活力,影响根系对养分元素的吸收。严绍裕[26]在对杉木幼苗各器官的研究表明,随镁浓度的提升,各器官镁含量提高,促进光合作用。随镁浓度的提高,杉木幼苗发育和生长更具优势。在以往杉木幼苗室内水培试验中,大多数学者采用Hoagland 完全营养液。Hoagland 完全营养液中的Mg 含量是否是杉木幼苗培养的最适浓度,目前尚未有相关报道。鉴于此,本文以Hoagland 完全营养液为基础,通过分析Hoagland 完全营养液中不同供镁水平对1 年生杉木无性系叶片丙二醛含量、抗氧化酶活性及叶绿素含量的影响,确定适合于杉木幼苗的最佳浓度,从而为今后杉木研究及壮苗培育提供理论参考和依据。【拟解决的关键问题】在杉木幼苗培养中,关于营养液具体供镁浓度的研究鲜见报道,为使杉木品质和产量提升,本试验在不同镁浓度对杉木幼苗处理的基础上,尝试从营养学的角度解决杉木对镁元素生长需求问题,为杉木的培育和种植提供依据和参考。
1 材料与方法
1.1 试验材料与处理
试验在福建农林大学田间实验室试验大棚中进行。选用福建省洋口国有林场培育的长势较一致的杉木1 年生061 无性系苗为试材,苗木平均株高为19.3 cm,地径为0.54 cm,冠幅27.4 cm。培养容器为直径20 cm 四周涂成黑色的塑料桶(V=4 L)。用纯净水将根部清净后,置于装有纯净水的培养桶中培养2 d,再将幼苗移入Hoagland 完全营养液(KH2PO4为0.136 g/L,KNO3为0.510 g/L,Ca(NO3)2·4H2O 为0.820 g/L,MgSO4·7H2O 为0.490 g/L,*EDTA-Fe 为0.014 g/L,H3BO4为2.860 mg/L,H2MoO4为0.062 mg/L,MnCl2·4H2O为1.810 mg/L,ZnSO4·7H2O 为0.220 mg/L,CuSO4·5H2O 为0.080 mg/L。)中驯化7 d。驯化结束后置于装有相同质量沙的培养桶中进行试验,添加液高于沙表面约5 cm。根据前期预试验的观测结果,本试验在完全营养液的基础上添加不同浓度的Mg 溶液,Mg 添的浓度设置4 个处理,分别为:0.2 mmol/L(M1)、0.4 mmol/L(M2)及0.8 mmol/L(M3),以不添加镁为对照(M0),镁以MgSO4·7H2O 的形式加入。缺镁营养液通过添加Na2SO4使处理间的SO42-浓度保持一致。每个处理3个重复,每个重复培养15株幼苗。
试验期间每天06:00 和18:00 各通气一次,每次时间为30 min。培养第一天开始测定试验指标,每隔15 d测量一次,共测量4次。
1.2 测定方法
叶片收集:用洗干净消毒后的剪刀取下同一位置杉木健康新生叶片,置于写有标签铺有湿滤纸的自封袋中暂时存放。
1.2.1 丙二醛(MDA)含量和抗氧化酶活性的测定 杉木叶片MDA 含量的测定采用硫代巴比妥酸TBA比色法进行[27-29]。
杉木叶片CAT 活性测定采用紫外吸收法[27-29]。反应体系(pH 值7.8 的3 mL 0.005 mol/L 的磷酸钠缓冲液(PBS),0.9 mL 0.08%的H2O2,0.1 mL 粗酶提取液),对照试验用PBS 缓冲液代替酶液。在240 nm 下每隔1 min测量一次吸光值,连续测量4次。
杉木叶片SOD 活性测定采用氮蓝四唑(NBT)光化还原法来进行[27-29]。试验以pH7.8 磷酸钠缓冲液0.1 mL 代替酶液,置于暗处,其余处理置于4 000 lx 的光照培养箱中反应15 min,结束后将各处理立即放在暗处终止反应,在560 nm下测各管的吸光度。酶活力测定以NBS被抑制50%作为1个SOD酶活单位。
杉木叶片POD 活性测定采用愈创木酚法来进行[27-29]。对照酶液煮沸5 min 处理。反应于34 ℃恒温水浴反应3 min,在470 nm波长下测定吸光度,每隔1 min记录1次吸光值,连续测量4次。将单位时间内A470吸收值转化为0.01作为1个酶活性单位。
1.2.2 叶绿素含量及叶绿素荧光测定方法 测定叶绿素含量用丙酮-无水乙醇的提取法[30]。称取杉木叶片0.05 g,擦净剪碎,将样品和反应体系(99%2.5 mL 的乙醇、2.5 mL 的丙醛)用保险膜封口,置于25 ℃室温静置到材料变白,在663 nm、645 nm波长下测测定吸光度。
1.3 数据处理
方差分析及最小差异显著性检验用SPSS处理,采用Excel软件制图。
2 结果与分析
2.1 不同供镁水平对杉木叶片MDA含量、抗氧化酶酶活性的影响
MDA是植物膜脂过氧化的主要产物[31]。如图1所示,随试验处理时间延长,杉木幼苗叶片MDA含量均呈现先上升后下降的趋势。在相同处理下,不同处理时间MDA 含量由大到小依次为30,15,1,45 d。其中M0处理下,在30 d时MDA含量比1,15,45 d分别提高121.63%、47.86%和125.62%,不同时间间均存在显著差异。
处理1 d 时,M0、M1、M2、M3的MDA 含量无明显规律。随处理时间延长,15 d 时,M1的MDA 含量显著上升,分别比M0、M2、M3提高24.92%、22.37%和18.93%,但差异并未达到显著水平。4 个处理中M2的MDA 含量始终处于较低水平,在30~45 d 时,由大到小依次为M0、M1、M3和M2,其中45 d 时,M0、M1、M3的MDA含量比M2显著提高54.92%、51.32%和49.25%。
抗氧化酶系统在植物衰老机制中占有重要作用,尤其是SOD、CAT、POD 等被认为是清除活性氧最主要的抗氧化酶类[32]。从图1 可知,随着处理时间的延长,SOD、POD 活性总体呈现上升趋势,CAT 活性总体呈现下降趋势。1~15 d,相同处理的SOD、POD 活性均显著提高,15 d 时,M0、M1、M2、M3的SOD 活性比1 d 提升29.89%、20.27%、27.03% 和27.73%,POD 活性分别提升155.96%、195.20%、223.82% 和233.40%。45 d 时,M2、M3的SOD 活性与30 d 相比,显著提高12.30%、11.89%。45 d 时M0、M1.M2、M3的POD活性比30 d分别提高118.0%、173.63%、151.12%和49.55%,均存在显著差异。
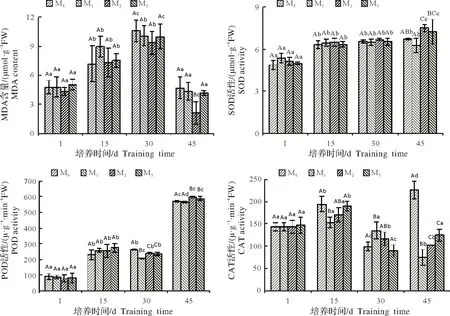
图1 不同供镁水平对杉木幼苗叶片丙二醛含量和保护酶活性的影响Fig.1 Effects of different levels of magnesium supply on MDA content and protective enzymes activities in Cunninghamia lanceolata seedling leaves
M1、M2、M3在不同处理时间CAT 活性总体由大到小依次为15,1,30,45 d,在15 d 时,M1、M2、M3的CAT活性比1 d提高7.16%、18.20%和28.97%,比45 d提高104.76%、66.18%和52.85%,均存在显著差异。M0的CAT 活性总体呈上升趋势,即由大到小依次为45,15,1,30,45 d 的CAT 活性比1 d 显著提高54.72%。
在相同时间下,4 个处理中M2的SOD 活性始终处于较高水平。1~15 d 时,M0、M1、M2、M3的SOD 活性无明显规律。30~45 d 时,各处理间由大到小依次为M2、M3、M0和M1的趋势,其中45 d 时,M2的SOD 活性比M0、M1、M3提高11.46%、19.59%和3.28%。POD 在同一时间不同处理之间无明显变化规律,45 d时,M2的POD 活性比M0、M1、M3提高4.58%、5.49%和1.39%。相同处理时间,CAT活性在各处理间无明显规律,处理45 d时,M0的CAT活性比M1、M2、M3显著提高202.79%、128.81%和81.97%。
2.2 不同供镁水平对杉木叶片叶绿素含量的影响
叶绿素含量越高,光合能力越强,增产潜力越大。适量施镁能维持细胞膜的完整性、稳定性,降低质膜的透性,减少细胞内的外渗物,为细胞抵御不良外界环境提供了良好条件[33]。由图2可知,随着处理时间的延长,Cha、Chb、Chl的含量总体由大到小依次为45,30,15,1,45 d时Cha的含量比1 d时高110.43%、110.19%、144.20%和128.16%,Chb 的含量比1 d 时高63.22%、101.31%、137.60%和101.53%,Chl 的含量比1 d时高110.43%、110.19%、144.20%和128.16%,均呈显著差异。
在相同时间,不同处理间,Cha、Chb、Chl 含量总体无明显的规律,其中M1和M3变化较一致,各叶绿素含量无显著差异,M0、M2的叶绿素含量总体高于M1、M3,且M2>M0。在45 d时,Cha、Chl含量由大到小均为M2、M3、M0和M1,M2的Cha 含量比M0、M1、M3提升3.82%、11.43%和5.22%,M2的Chb 含量比M0、M1、M3提升53.38%、26.20%和18.74%,M2的Chl含量比M0、M1、M3提升13.91%、15.12%和8.62%,均存在显著差异。
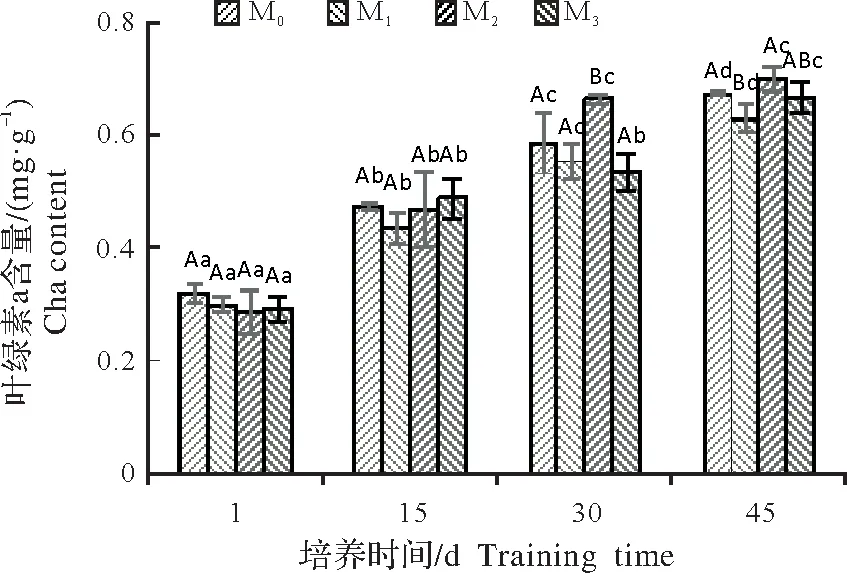
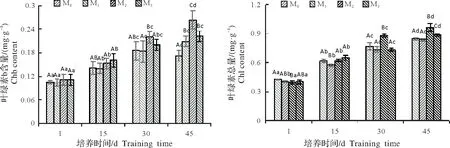
图2 不同供镁水平对杉木幼苗叶绿素含量的影响Fig.2 Effects of different levels of magnesium supply on chlorophyll content in Cunninghamia lanceolata seedling leaves
2.3 不同供镁水平对杉木叶片生理生化指标的相关性分析
将不同浓度处理下的杉木幼苗叶片各生理生化指标进行相关性分析,结果如表1 所示。MDA 含量与POD 活性呈显著负相关(P<0.05),SOD 活性与POD 活性呈极显著正相关(P<0.01);Cha 含量、Chb 含量、Chl含量与SOD、POD活性呈极显著正相关(P<0.01);Chb含量与CAT活性呈极显著负相关(P<0.01);Cha含量、Chb含量、Chl含量之间也呈极显著正相关关系(P<0.01)。
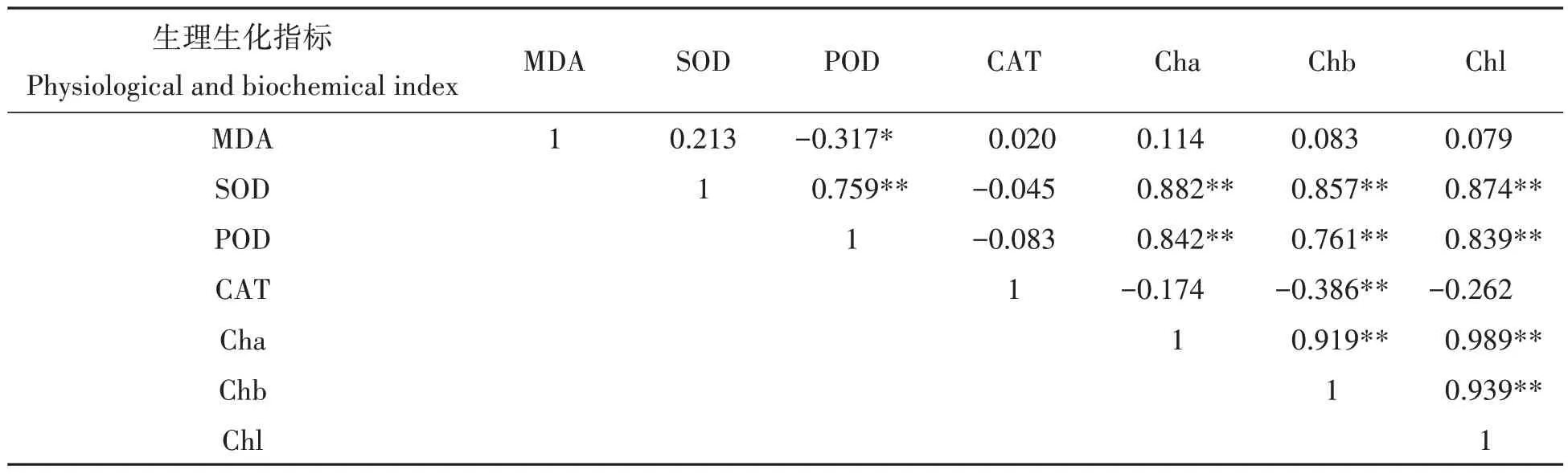
表1 不同供镁水平下杉木幼苗叶片MDA含量和保护酶的关系Tab.1 The relationship between MDA content and protective enzyme in seedling leaves of Cunninghamia lanceolata under different magnesium levels
3 讨论与结论
MDA 是植物膜脂过氧化的产物,其含量反应细胞膜系统受损程度[34-35]。在逆境条件下,植物细胞活性氧积累,破坏膜系统,扰乱细胞的正常代谢,导致叶片的MDA 含量增加,含量越高,表明细胞受损害程度越大[36-37]。本试验研究结果表明,培养前期MDA 含量随时间延长不断增加,处理30 d 时达到最高,M0含量最高,MDA 含量在30~45 d不断下降,M2含量最低。处理前期,因处理液浓度增大,杉木幼苗对外界环境的应激性,MDA 含量不断升高。随处理时间的延长,杉木幼苗因自身的适应性、抗逆性和防御酶系统的激活,MDA 含量不断下降,其中M2的MDA 含量显著低于其他处理,由此推测,M2的浓度更有利于杉木幼苗的生长。作为正常供镁的M0处理,MDA 含量高于其他处理,可能是因为试验材料的个体差异或种系差异,需镁量在一定范围内波动,并不是一个确定的浓度值。此结果与汪凤林等[25]的研究结果有所不同,原因可能是本试验研究是在一定供镁基础上筛选最优含镁营养液对杉木幼苗培育的影响,汪凤林等则研究供镁与缺镁处理对杉木幼苗发育的影响。
SOD、CAT、POD等酶是植物细胞中重要的防御保护酶,清理细胞中破坏代谢的过氧化物和氧自由基等,维持正常新陈代谢[38-39]。在本试验中,处理15 d 时,SOD、CAT、POD 含量均出现一个增长小峰,可能是杉木幼苗适应营养液浓度,活性氧增加、保护酶被防御系统激活所致。处理后期SOD、POD 活性均稳步提升,M2的SOD、POD 活性提高尤为显著,可见M2处理的杉木幼苗更快适应环境的变化,并迅速激活自身保护酶体系,消除外界环境变化对自身结构和代谢造成的破坏。这与在玉米[40]、桑树[41]等植物上的研究结果一致。
镁是叶绿素的组成成分,对维持叶绿素的结构和功能具有重要的作用。叶绿素含量是反应叶片光合作用的一个重要指示,对光能的吸收、传递、转化至关重要[42]。本试验结果显示,在处理前15 d 时,各处理间Cha、Chb、Chl 的含量无显著差异,可能是因为处理前期杉木幼苗自身的应激系统和酶系统使代谢维持在较稳定的水平,处理前期的差异并未达到显著水平。随处理时间延长,处理30 d后,M0与M2出现显著差异,M1、M3与M0之间存在差异但未达到显著水平。由此可见,M2的镁浓度更有利于杉木幼苗生长发育。在王芳[36]的镁对大豆叶绿素含量的研究中表明,适量施镁使叶绿素的含量增加,有利于叶片光能吸收,光合能力增强,有机物累积。杉木幼苗Cha、Chb、Chl 的含量在整个处理时期均呈现增长趋势,可能是由于本试验中不同程度供镁条件和其他营养元素的供给,各元素之间存在协同和代偿作用,使叶绿素含量呈现稳步缓慢上升的趋势。
MDA 作为衡量植物受胁迫程度的一个重要指标,常和CAT、POD、SOD 等抗氧化酶活性共同测量分析,以此确定植物受胁迫程度以及对逆境胁迫的适应性和抗逆性[31]。本试验在供镁基础上研究较佳镁配比营养液,结果表明MDA 含量与SOD、CAT 活性均无显著相关性,与POD 在0.05 水平显著负相关,这与汪凤林[25]的试验研究结果不相符。可能有两方面的原因,一是MDA 含量增加的机制和SOD、CAT 活性调节机制无关;二是杉木幼苗在一定供镁水平之上,MDA 含量和SOD、CAT 活性存在其他的代谢机制,有待进一步研究。SOD、POD 活性与Cha、Chb、Chl 均呈极显著正相关,且SOD 活性与POD 活性呈极显著正相关,这说明POD、SOD 活性对叶绿素的合成有至关重要的作用,可能是为叶绿素合成提供一个稳定的内部环境和保护作用,促进细胞内物质的有序运输,其中的运作机制还需进一步研究。
在不同配比的镁营养液中,杉木幼苗处理前30 d,各生理指标无明显规律,且差异未达到显著水平。在处理30~45 d时,处理间差异逐渐明显。研究结果表明,0.4 mmol/L的镁溶液对杉木幼苗的生长和发育具有较显著的促进作用,MDA 含量最低,POD、SOD 活性显著高于其他处理,Cha、Chb、Chl含量最高。由此可见,此浓度的营养液对杉木幼苗叶片的损伤最小,最利于幼苗的生长发育。
