青藤碱通过ANRIL/miR-626轴减轻MPP+诱导的SK-N-SH细胞损伤*
2020-09-07霍颖浩殷立新
霍颖浩,王 进,殷立新
(河北医科大学第二医院 1神经内科,2药学部,河北石家庄050000)
帕金森病(Parkinson disease,PD)是中枢神经系统退行性疾病,主要表现为运动缓慢、震颤、感觉障碍等。PD 多发生于老年人群,随着社会老龄化的加剧,PD 发病率呈增长趋势[1]。目前,PD 的发病机制尚未阐明,已证实氧化应激、线粒体功能障碍、炎症等引起的细胞凋亡与PD 关系密切[2-3]。临床主要采用左旋多巴治疗PD,但长期疗效不佳,因此探究PD发病机制并寻找有效的治疗靶点十分重要。
青藤碱(sinomenine,SN)是中药青风藤的主要活性成分,具有抗炎、抗肿瘤、免疫抑制等多种药理学功效[4-5]。研究显示,SN可改善缺氧诱导的神经元形态,促进神经元存活,抑制神经元凋亡[6]。SN 可抑制氧糖剥夺诱导的大鼠海马神经元凋亡及乳酸脱氢酶的释放,减轻神经元的损伤[7]。长链非编码RNA(long noncoding RNA,lncRNA)是一类长度超过200个核苷酸的小分子单链非编码RNA,可在转录、转录后、表观遗传等多个方面调控基因的表达,参与细胞生长、分化和凋亡等生命过程,与神经系统疾病的发生发展密切相关[8]。ANRIL 是近年来新发现的一种lncRNA。研究显示,ANRIL 在PD 患者体内差异性表达[9]。生物信息学软件预测显示,微小RNA-626(microRNA-626,miR-626)的靶基因可能是ANRIL。研究显示,miR-626 在PD 患者脑脊液中表达降低,可能是PD诊断和监测的新的生物标志物[10]。
本研究以人神经母细胞瘤SK-N-SH 细胞为研究对象,主要探讨SN对1-甲基-4-苯基吡啶(1-methyl-4-phenylpyridine,MPP+)诱导 SK-N-SH 细胞氧化应激及凋亡的影响,并以ANRIL/miR-626 为切入点,探讨SN 减轻MPP+所致SK-N-SH 细胞损伤的作用机制,以期为PD的治疗提供新思路。
材料和方法
1 细胞和实验试剂
人神经母细胞瘤SK-N-SH 细胞(中国科学院上海细胞库)。胎牛血清(fetal bovine serum,FBS)和RPMI-1640 培养基(Gibco);胰蛋白酶(Sigma);Trizol试剂和 LipofectamineTM2000 试剂盒(Invitrogen);逆转录试剂盒和PCR 试剂盒(深圳晶美生物工程有限公司);PCR 引物(上海生工生物工程有限公司);膜联蛋白V(annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘 化 丙 啶(propidium iodide,PI)细胞凋亡试剂盒(江苏凯基生物技术股份有限公司);二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒(上海碧云天生物技术有限公司);兔抗人Bcl-2 和Bax 多克隆抗体(Abcam);双萤光素酶活性检测试剂盒(北京威格拉斯生物技术有限公司);靶向ANRIL的小干扰RNA[ANRILsmall interfering RNA(siRNA),si-ANRIL]及乱序无意义阴性序列(negative control siRNA,si-NC),ANRIL过表达载体(pcDNA-ANRIL)及空载体(pcDNA),miR-626 模拟物(mimics)及阴性对照(上海吉凯基因公司);丙二醛(malondialdehyde,MDA)和谷胱甘肽(glutathione,GSH)检测试剂盒(南京建成生物工程研究所)。
2 实验方法
2.1 细胞培养 SK-N-SH 细胞用含10% FBS 的DMEM 培养基置于培养箱(37℃、5%CO2、97%湿度)中培养。每2~3 d 更换1 次新鲜的培养基。待细胞汇合至80%~90%时,吸弃培养基,加入适量预冷的PBS清洗细胞。吸弃PBS,加入0.25%胰蛋白酶溶液消化,进行传代培养。
2.2 细胞转染 将对数生长期的SK-N-SH 细胞以每孔1×105个接种于6 孔板中。待细胞汇合至60%时,分别将si-ANRIL、si-NC、pcDNA-ANRIL 及pcDNA转染至SK-N-SH 细胞,具体转染过程参照Lipo‑fectamineTM2000试剂盒说明书。转染后12 h,更换新鲜培养基,继续培养至48 h后,采用RT-qPCR检测细胞中ANRIL 水平以验证转染效果,并收集细胞用于后续实验。
2.3 细胞分组和处理 未转染的SK-N-SH 细胞分为对照(control,Con)组(细胞正常培养)、MPP+组(100 µmol/L[11]的 MPP+作用细胞 24 h)、MPP++SN-L组、MPP++SN-M 组和MPP++SN-H 组(浓度分别为5、10、20 µmol/L[6]的SN 与100 µmol/L 的MPP+共同作用细胞 24 h)。转染 si-ANRIL 和 si-NC 的 SK-N-SH 细胞均用 100 µmol/L 的 MPP+作用 24 h,分别记为 MPP++si-ANRIL 组和MPP++si-NC 组。转染pcDNA-ANRIL和 pcDNA 的 SK-N-SH 细胞均用 20 µmol/L 的 SN 与100 µmol/L 的 MPP+共同作用 24 h,分别记为 MPP++SN+pcDNA-ANRIL组和MPP++SN+pcDNA组。
2.4 流式细胞术检测细胞凋亡 未转染的SK-NSH 细胞及转染后的 SK-N-SH 细胞,以每孔 1×104个接种于24孔板中。细胞贴壁后,按照2.3分组处理,每组设置3 个复孔。培养后,收集细胞培养上清液,-20℃保存备用。胰蛋白酶消化细胞,PBS 清洗细胞2 次。取含1.0×106个细胞的细胞悬液,1 500 r/min离心5 min,加入400µL结合缓冲液重悬细胞。加入10 µL annexin V-FITC,室温避光孵育10 min。加入5µL PI,室温避光孵育5 min。再加入100µL结合缓冲液,混匀后,流式细胞仪检测细胞凋亡。
2.5 细胞培养上清液中MDA 和GSH 水平的检测将2.4 收集的细胞培养上清液3 500 r/min 离心10 min,分别参照MDA 和GSH 试剂盒说明书检测上清中MDA和GSH水平。
2.6 Western blot 法检测细胞中 Bax 和 Bcl-2 蛋白 的表达水平 RIPA 蛋白裂解液各组细胞,4℃、12 000 r/min 离心10 min,上清液即为总蛋白。BCA 法测定蛋白浓度。取适量蛋白溶液,100℃煮沸5 min。蛋白变性后,以每孔30 µg 蛋白行SDS-PAGE(5%浓缩胶,10%分离胶)。电泳后,将分离的蛋白条带湿转至聚偏二氟乙烯膜,并于5%脱脂牛奶中封闭2 h。分别加入抗Bax 和Bcl-2 抗体(1∶400 稀释),4℃孵育过夜。加入辣根过氧化酶标记的IgG(1∶200 稀释),37℃孵育1 h。加入ECL 化学发光试剂,避光显影后凝胶成像系统曝光拍照。以GAPDH 为内参照,ImageJ 软件分析目的蛋白条带灰度值。目的蛋白水平以其与GAPDH条带灰度值的比值表示。
2.7 RT-qPCR 检 测 细 胞 中 ANRIL 和 miR-626 的 表达水平 Trizol 试剂提取细胞中总RNA,微量核酸仪检测RNA 的纯度和浓度后,参照逆转录试剂盒说明书将RNA 逆转录为cDNA。然后以cDNA 为模板,进行扩增,反应总体系为20 µL,其中上、下游引物各0.5 µL。扩增程序为:95℃ 10 min;95℃ 5 s,60℃60 s,72℃ 30 s,35个循环。ANRIL 的上游引物序列为5'-TGAACGTGCCCGATGCTGG-3',下游引物序列为 5'-CCGTGCCTTGAGCTAGCTC-3';miR-626 的 上游引物序列为5'-GTGCGATCGTAAACCGTC-3',下游引物序列为5'-CCGTGAAATGCTAGCTGA-3';GAPDH 的上游引物序列为5'-TGAACGGGAAGCT‑CACTGG-3',下游引物序列为5'-TCCACCACCCT‑GTTGCTGTA-3';U6 的上游引物序列为5'-CTC‑GCTTCGGCAGCACA-3',下游引物序列为5'-AAC‑GCTTCACGAATTTGCGT-3'。ANRIL 以 GAPDH 为内参照,miR-626 以 U6 为内参照,采用 2-ΔΔCt法计算ANRIL和miR-626的相对表达水平。
2.8 双萤光素酶报告基因实验验证ANRIL 和miR-626 的靶向关系 生物信息学软件预测ANRIL 与miR-626 的结合片段。PCR 扩增含miR-626 结合位点的ANRIL 序列,并将其插入至pMIR-REPORT 中,构建ANRIL 野生型质粒(WT-ANRIL);再利用基因突变技术将结合位点突变,构建ANRIL 突变型质粒(MUT-ANRIL)。分别将ANRIL-WT、ANRIL-MUT 与miR-626 mimic、阴性对照共转染至SK-N-SH 细胞。转染24 h 后,收集细胞。参照双萤光素酶活性检测试剂盒说明书,检测萤光素酶相对活性。
3 统计学处理
利用SPSS 22.0 软件分析实验数据。符合正态分布的计量资料以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 SN对MPP+诱导SK-N-SH细胞氧化应激的影响
与control 组比较,MPP+组的MDA 水平升高(P<0.05),GSH 水平降低(P<0.05);与 MPP+组比较,MPP++SN-L 组 、MPP++SN-M 组 和 MPP++SN-H 组 的MDA 水平降低(P<0.05),GSH 水平升高(P<0.05),且 MPP++SN-L 组、MPP++SN-M 组和 MPP++SN-H 组 3组间MDA 和GSH 水平的差异有统计学显著性(P<0.05),见图1。
2 SN对MPP+诱导SK-N-SH细胞凋亡的影响
与control 组比较,MPP+组细胞的凋亡率和Bax蛋白水平升高(P<0.05),Bcl-2 蛋白水平降低(P<0.05);与 MPP+组比较,MPP++SN-L 组、MPP++SN-M组和MPP++SN-H 组的细胞凋亡率和Bax 蛋白水平降低(P<0.05),Bcl-2 蛋白水平升高(P<0.05),且MPP++SN-L 组、MPP++SN-M 组和 MPP++SN-H 组 3 组间细胞凋亡率及Bax和Bcl-2蛋白水平的差异有统计学显著性(P<0.05),见图2。
3 SN 对 MPP+诱 导 SK-N-SH 细 胞 中 ANRIL 和miR-626表达的影响
与control 组比较,MPP+组细胞中ANRIL 水平升高(P<0.05),miR-626 水平降低(P<0.05);与MPP+组比较,MPP++SN-L 组、MPP++SN-M 组和 MPP++SNH 组的ANRIL 水平降低(P<0.05),miR-626 水平升高(P<0.05),且 MPP++SN-L 组、MPP++SN-M 组和MPP++SN-H 组 3 组间 ANRIL 和 miR-626 水平的差异有统计学显著性(P<0.05),见图3。
4 ANRIL靶向调控miR-626的表达
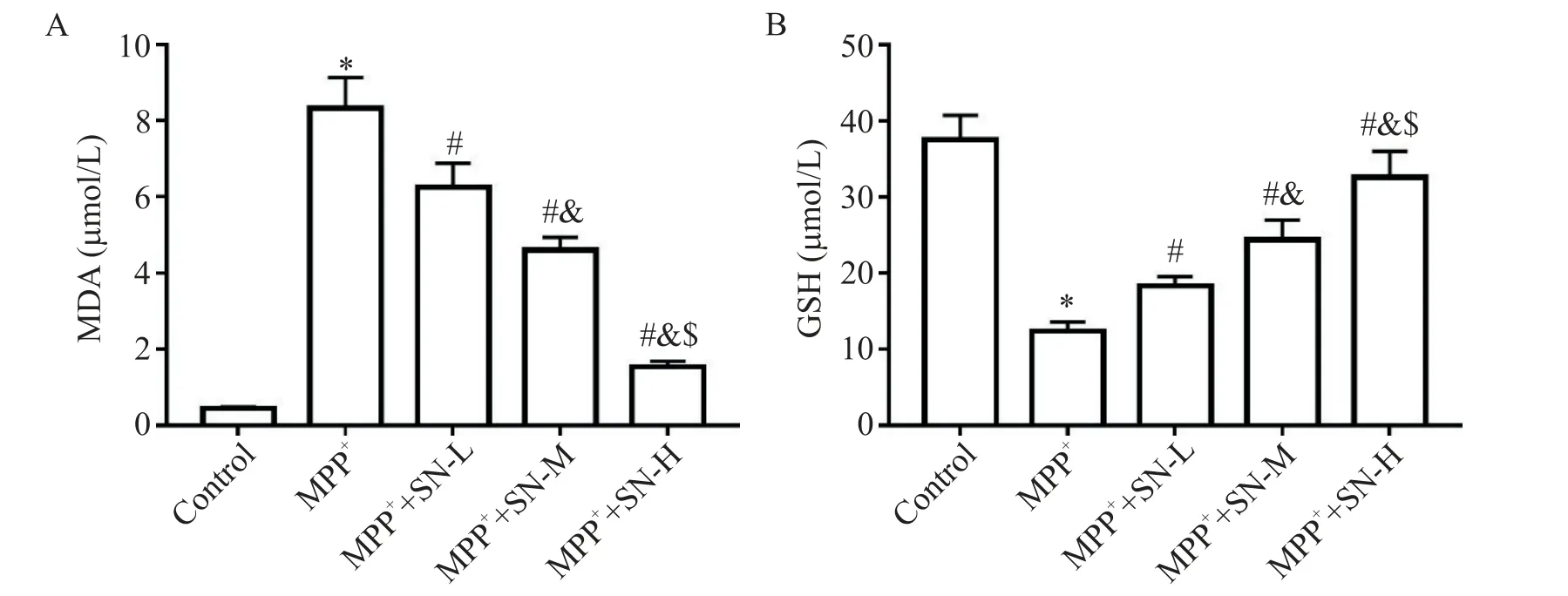
Figure 1.The effect of SN on MPP+-induced oxidative stress in the SK-N-SH cells.The levels of MDA(A)and GSH(B)in the SKN-SH cell culture supernatants were detected.Mean±SD. n=9.*P<0.05 vs control group;#P<0.05 vs MPP+group;&P<0.05 vs MPP++SN-L group;$P<0.05 vs MPP++SN-M group.图1 SN对MPP+诱导的SK-N-SH细胞氧化应激的影响

Figure 2.The effect of SN on the apoptosis of the SK-N-SH cells induced by MPP+.A:the apoptotic rate of the SK-N-SH cells was de‑termined by flow cytometry;B:the protein expression of Bax and Bcl-2 in the SK-N-SH cells was detected by Western blot.Mean±SD. n=9.*P<0.05 vs control group;#P<0.05 vs MPP+ group;&P<0.05 vs MPP++SN-L group;$P<0.05 vs MPP++SN-M group.图2 SN对MPP+诱导的SK-N-SH细胞凋亡的影响

Figure 3.The effect of SN on the expression of ANRIL(A)and miR-626(B)in the SK-N-SH cells induced by MPP+.Mean±SD. n=9.*P<0.05 vs control group;P<0.05 vs MPP+group;&P<0.05 vs MPP++SN-L group;$P<0.05 vs MPP++SN-M group.图3 SN对MPP+诱导SK-N-SH细胞中ANRIL和miR-626表达的影响
由图4A 可见,生物信息学软件预测显示ANRIL序列中含有与miR-626 互补的核苷酸序列。双萤光素酶活性检测结果显示,miR-626 可降低WT-ANRIL的萤光素酶活性(P<0.05),而对MUT-ANRIL 的萤光素酶活性无显著影响(P<0.05),见图4B。与pcDNA组比较,pcDNA-ANRIL 组的 miR-626 水平降低(P<0.05);与 si-NC 组比较,si-ANRIL 组的 miR-626 水平升高(P<0.05),见图4C。这些结果说明ANRIL 靶向负调控miR-626的表达。

Figure 4.ANRIL targeted miR-626 and regulated its expression.A:ANRIL contains the nucleotide sequences complementary to miR-626;B:the dual-luciferase reporter experiment results;C:ANRIL regulated miR-626 expression.Mean±SD. n=9.*P<0.05 vs miR-NC group;#P<0.05 vs pcDNAgroup;&P<0.05 vs si-NC group.图4 ANRIL靶向调控miR-626表达
5 敲减ANRIL 的表达对MPP+诱导SK-N-SH 细胞损伤的影响
MPP++si-ANRIL 组的 ANRIL 水平低于 MPP++si-NC组,miR-626水平高于MPP++si-NC组,见图5A、B。这表明si-ANRIL 在MPP+诱导的SK-N-SH 细胞中转染成功,细胞中ANRIL 表达受到抑制,而受ANRIL抑制的miR-626 表达水平升高。与MPP++si-NC 组比较,MPP++si-ANRIL 组的细胞凋亡率、Bax 蛋白水平和 MDA 水平降低(P<0.05),Bcl-2 蛋白和GSH 水平升高(P<0.05),见图5C~F。
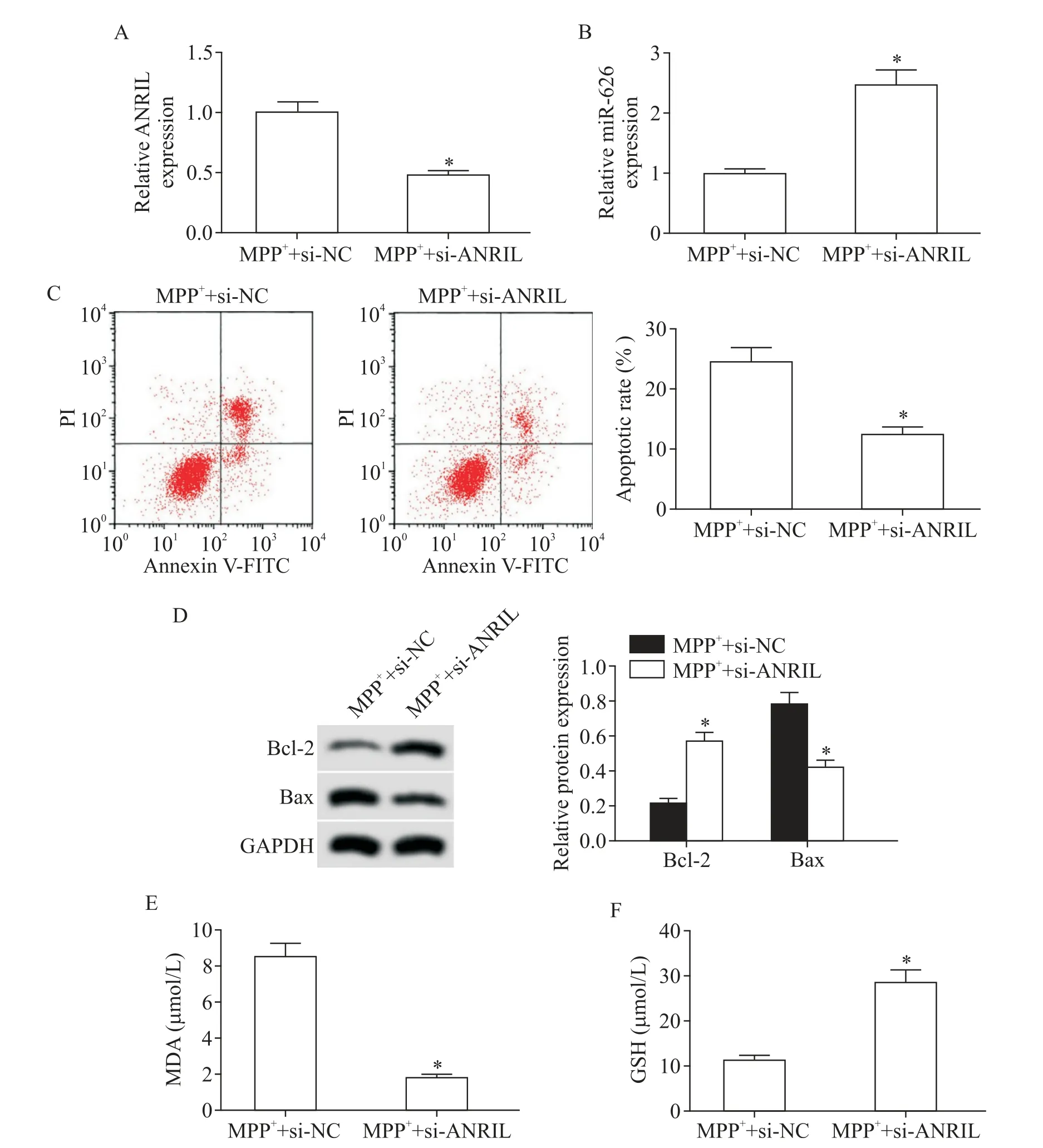
Figure 5.The effect of ANRIL expression knock-down on MPP+-induced SK-N-SH cell injury.A:verification of the effect of ANRIL small interfering RNA(si-ANRIL)after transfection;B:miR-626 expression level in the SK-N-SH cells after transfection of si-ANRIL;C:the effect of ANRIL expression knock-down on the apoptotic rate of SK-N-SH cells induced by MPP+;D:the effect of ANRIL expression knock-down on the protein expression of Bax and Bcl-2 in the SK-N-SH cells induced by MPP+;E:the effect of ANRIL expression knock-down on MDA content in the culture supernatants of SK-N-SH cells in‑duced by MPP+;F:the effect of ANRIL expression knock-down on GSH content in the culture supernatants of SK-N-SH cells induced by MPP+.Mean±SD. n=9.*P<0.05 vs MPP++si-NC group.图5 敲减ANRIL表达对MPP+诱导SK-N-SH细胞损伤的影响
6 ANRIL 过表达逆转了SN 对MPP+诱导SK-N-SH细胞损伤的作用
MPP++SN+pcDNA-ANRIL 组 的 ANRIL 水 平 高 于MPP++SN+pcDNA 组,表明ANRIL过表达载体转染成功,细胞中ANRIL 过表达,见图6A。与MPP++SN+pcDNA 组比较,MPP++SN+pcDNA-ANRIL 组的细胞凋亡率、Bax蛋白表达和MDA 水平均升高(P<0.05),miR-626 表达、Bcl-2 蛋白和 GSH 水平均降低(P<0.05),见图6B~F。
讨 论

Figure 6.Over-expression of ANRIL reversed the effects of SN on MPP+-induced SK-N-SH cell injury.A:verification of the effect ofANRIL over-expression vector transfection;B:miR-626 expression level in the SK-N-SH cells after transfected with ANRIL over-expression vector;C:over-expression of ANRIL reversed the effect of SN on MPP+-induced SK-N-SH cell apoptosis;D:over-expression of ANRIL reversed the effect of SN on the protein expression of Bax and Bcl-2 in the SK-N-SH cells in‑duced by MPP+;E:over-expression of ANRIL reversed the effect of SN on MDA content in the culture supernatants of SK-NSH cells induced by MPP+;F:over-expression of ANRIL reversed the effect of SN on GSH content in the culture superna‑tants of SK-N-SH cells induced by MPP+.Mean±SD. n=9.*P<0.05 vs MPP+group;#P<0.05 vs MPP++SN+pcDNA group.图6 ANRIL过表达逆转了SN对MPP+诱导SK-N-SH细胞损伤的作用
PD 是多发生于老年人的神经系统退行性疾病,严重影响患者生活质量,给家庭和社会带来沉重的经济负担。氧化应激等引起的神经细胞凋亡与PD的发病机制密切相关[12-13]。MDA 是脂质过氧化产物之一,其水平高低可反映细胞氧化损伤程度[14]。GSH 是抗氧化剂,可增强机体抗氧化能力[15]。本研究显示MPP+诱导SK-N-SH 细胞后,细胞培养上清液中MDA 水平升高,GSH 水平降低,细胞凋亡率增加,与相关研究报道结果一致[16],说明SK-N-SH 细胞在MPP+诱导后发生氧化应激和凋亡,细胞受损。与PD的病理过程有相似之处。
SN 是从中药青风藤中分离提纯获得的活性碱,在临床上主要用于治疗系膜增生性肾小球肾炎、类风湿性关节炎等疾病[17]。研究还显示SN 对脑出血、脑缺血、神经退行性疾病等多种中枢神经系统疾病模型具有神经保护作用[18]。但SN 在PD 中的作用及机制还未知。本研究显示,SN 可降低MPP+诱导的SK-N-SH 细胞上清液的MDA 水平,提高GSH 水平,说明SN 通过抑制MPP+诱导的SK-N-SH 细胞氧化应激减轻细胞损伤。细胞凋亡是细胞基本的生理过程,有助于维持细胞内稳态。Bcl-2 和Bax 在细胞凋亡过程中发挥重要作用,Bcl-2表达升高可抑制细胞凋亡,而Bax 表达升高则促进细胞凋亡。本研究显示,SN 可降低MPP+诱导的SK-N-SH 细胞凋亡率和Bax 蛋白表达,促进Bcl-2 蛋白表达,提示SN 通过调控Bcl-2 和Bax 蛋白表达抑制MPP+诱导的SK-N-SH细胞凋亡。
lncRNA 在神经系统疾病中发挥重要作用,可作为该类疾病的治疗靶点[19]。研究显示,抑制ANRIL基因表达可通过阻断核因子κB 信号传导途径减轻糖尿病大鼠视网膜病变[20]。本研究显示,MPP+诱导后,SK-N-SH 细胞中的ANRIL 表达水平升高,而SN可降低MPP+诱导的SK-N-SH 细胞中ANRIL 水平,提示ANRIL 可能参与神经细胞氧化应激的发生发展,是潜在的PD 治疗的作用靶点。通过转染si-ANRIL至SK-N-SH细胞敲减ANRIL表达后,MPP+诱导的SKN-SH细胞凋亡及细胞培养上清液中MDA水平降低,GSH 水平升高,说明敲减ANRIL表达可降低MPP+诱导的SK-N-SH 细胞氧化应激和凋亡。本研究还显示,ANRIL 过表达逆转了SN 对MPP+诱导SK-N-SH细胞凋亡及MDA 和GSH 表达的影响,提示SN 通过下调细胞中ANRIL 表达减轻MPP+诱导SK-N-SH 细胞损伤。
为了进一步探讨SN 通过下调ANRIL 表达减轻MPP+诱导的SK-N-SH细胞氧化应激和凋亡的作用机制,本研究应用生物信息学软件进行测试,结果显示miR-626 的靶基因可能是ANRIL。研究表明miR-626过表达可保护视网膜色素上皮细胞免受过氧化氢诱导的氧化损伤,抑制细胞凋亡[21]。目前,miR-626 对MPP+诱导的SK-N-SH细胞损伤的影响还不清楚。本研究通过双萤光素酶报告基因实验及RT-qPCR检测证实了ANRIL 在SK-N-SH 细胞中靶向负调控miR-626 表达,这也与 SN 降低 MPP+诱导的 SK-N-SH 细胞ANRIL 表达并促进miR-626 表达的结果一致,提示SN 可能通过下调细胞中ANRIL 表达进而上调miR-626 表达,从而抑制MPP+诱导的SK-N-SH 细胞氧化应激和凋亡。
综上所述,本研究从细胞层面进行的初步探讨结果提示SN 可抑制MPP+诱导的SK-N-SH 细胞氧化应激和凋亡,其机制可能是通过调控ANRIL/miR-626 通路发挥作用。了解上述病理变化可为探讨PD的发病机制提供参考。
