心脏移植术后肺部多重感染1例尸检结果分析及文献复习
2020-09-07赵芮崧王秀红苏运超
赵芮崧,易 丽,王秀红★,苏运超
(1.中日友好医院 病理科,北京 100029;2.中日友好医院 呼吸与危重症医学科,北京 100029)
1 病例资料
患者男性,25 岁,2012年诊断为扩张型心肌病,2017年2月25日于外院行异体心脏移植手术,术中曾输血,未出现过输血反应。患者术后规律服用他克莫司联合糖皮质激素抗排异治疗。发现血糖升高4 个月,外院给予胰岛素+二甲双胍控制血糖。否认肝炎史、结核史、疟疾史。否认外伤史,无食物或药物过敏史。于2017年8月初无明显诱因出现发热,伴咳嗽、无痰。自行口服感冒冲剂+阿奇霉素治疗1 周后,患者发热缓解,但咳嗽症状无减轻并逐渐出现呼吸困难及喘憋,就诊于当地医院,查胸部CT 示“双肺多发斑片状实变渗出影,左肺显著”,诊断为“肺部感染”,给予头孢类抗生素治疗1d 后于2017年8月13日转至北京某院心脏移植科治疗。入院后查Anti-CMV IgM(36.1U/ml)阳性,鼻咽拭子培养金黄色葡萄球菌阳性,给予抗感染治疗。咳嗽、喘憋症状较前略好转,但乏力较前加重,患者自发病以来,食欲差,伴腹胀,近4d 尿量少、色黄。近几日无大便。为进一步诊治,于9月11日收住我院呼吸科。患者入院后即出现明显呼吸困难、发热,伴明显胸闷、气喘,咳嗽,转入MICU。BALF(支气管肺泡灌洗液)核酸检测PCP(+)(主要检测卡式肺孢子菌)、EB (+)(主要检测EB 病毒);病原学涂片及培养可见真菌孢子、白色念珠菌、G-杆菌、鲍曼不动杆菌、铜绿假单胞菌、阴沟肠杆菌。超声心动图提示右心扩大、右室功能减低。经抗感染、抗休克、脏器支持等一系列治疗无效,于9月16日3 时3 分宣布临床死亡。
尸体检查:青年男性,身高172cm,体重约65kg,体表无畸形。可见尸斑,无尸僵。鼻梁两侧及下颌处可见瘢痕,大小0.5cm×0.4cm;颈部正中见一瘢痕,3cm×0.5cm;胸部正中见陈旧手术瘢痕,长22.5cm、宽3.4cm;左侧腋下可见散在圆形出血点,直径2.2~2.3cm;右侧腹股沟见一手术切口,长0.3cm,上附缝线;双侧腹股沟可见散在灰褐色瘀斑;双上肢肘部、腕部及双下肢脚踝处可见穿刺点,伴出血;双手肿胀,指尖发绀。双侧瞳孔等大等圆,直径0.5cm。鼻腔、外耳道可见棉球填塞,未见明确分泌物。气管居中。甲状腺无肿大。颈静脉无怒张。浅表淋巴结未触及。胸壁呈漏斗胸。腹壁凹陷,皮下脂肪厚1.8cm。外生殖器未见异常及畸形,阴囊皮肤略呈紫红色。大体:心外膜与心包粘连。右心房、心室腔扩张。双肺膨隆,体积增大,重量增加,触之实性,切面呈暗红色,质地实,含气很少。右肺下叶胸膜下见一灰白结节,直径0.6cm,实性,质略硬。双肾中极局灶凹陷,形状不规则,切面均呈楔形,灰黄灰褐色。余各系统脏器未见明显异常。镜下:心外膜增厚,与心包粘连。心肌肌束排列规则,间质水肿,部分心肌细胞肥大,局部心肌细胞空泡变性,未见坏死。心肌细胞间散在少数淋巴细胞浸润。上下腔静脉、肺动脉、肺静脉及主动脉吻合口纤维组织增生伴玻璃样变性、钙化及异物巨细胞反应。双肺主要病变:(1)肺透明膜形成;(2)双肺孢子菌感染;(3)肺曲霉菌感染;(4)多发性细菌性肺脓肿(经细菌培养证实为鲍曼不动杆菌、阴沟肠杆菌、铜绿假单胞菌)。肝脏见广泛性以小叶中央静脉为中心的坏死,双肾肾小管弥漫性变性、坏死,局部肾组织楔形梗死。病理诊断:弥漫性急性肺泡损伤;肺多重重度感染;肝、肾坏死;心脏移植术后,伴右心扩张。
2 尸检肺脏主要组织学特点
支气管部分被覆上皮脱落,黏膜下少数淋巴细胞及浆细胞浸润。(1)肺泡腔弥漫扩张,大部分肺泡上皮脱失,腔内充满蛋白、纤维素性渗出物,部分肺泡水肿、出血,透明膜形成(图1,见封三),肺泡间隔轻度增宽或不明显,间质内可见急慢性炎细胞浸润。(2)大量肺泡腔内渗出物呈“泡沫状”,高倍镜似有结构,经特殊染色PAS、银染显示泡沫状渗出物内可见大量圆形、卵圆形菌体,银染色呈黑色,部分菌体有明显的沟或皱褶,符合肺孢子菌感染(图2、3,见封三)。(3)肺组织内可见灶状坏死伴急性炎症,病灶内见大量真菌菌丝,并形成肉眼可见的真菌球,菌丝呈分支状、锐角,经特殊染色PAS、银染进一步证实,符合肺曲霉菌感染(图4,见封三)。(4)多发局灶肺泡腔破坏,渗出坏死物中见大量核碎、吞噬细胞聚集,中性粒细胞浸润,多灶肺脓肿形成。双肺肺膜光滑,未见明显增厚。
3 讨论
急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS)的概念于1967年由Ashaugh 等提出,中华医学会重症医学分会在 《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》中说明,ALI/ARDS 是指在严重感染、休克、创伤及烧伤等非心源性疾病过程中,肺毛细血管内皮细胞和肺泡上皮细胞损伤造成弥漫性肺间质及肺泡水肿,导致的急性低氧性呼吸功能不全或衰竭。以肺容积减少、肺顺应性降低、严重的通气/血流比例失调为病理生理特征,临床上表现为进行性低氧血症和呼吸窘迫,肺部影像学上表现为非均一性的渗出性病变[1,2]。
ARDS 早期病理改变为弥漫性肺泡损伤,主要表现为肺广泛性充血水肿,在肺呼吸性细支气管、肺泡管及肺泡的内表面可见薄层红染的膜状物被覆,即透明膜形成,其成分为血浆蛋白及坏死的肺泡上皮碎屑;病理过程主要分为3 个阶段:渗出期、增生期和纤维化期,可见水肿、出血,切面有液体渗出,故有“湿肺”之称。显微镜下可见肺间质内可有点状出血和灶状坏死,微血管内常见白细胞血栓和透明栓塞,肺泡上皮弥漫性损伤[3]。仅少数ALI/ARDS 患者病情在发病第1 周内可缓解,大多数患者在发病的5~7d后病情进展迅速,进入亚急性期。在ALI/ARDS 的亚急性期,通过病理观察可见肺间质和肺泡纤维化。部分患者呼吸衰竭持续>14d,病理上常表现为严重的肺纤维化,肺泡结构破坏和重建。本例镜下特点以急性期为主,肺泡结构保存,肺孢子菌、曲霉菌及多种细菌感染,是造成肺泡上皮损伤、肺毛细血管通透性增加的主要原因,进而导致肺泡水肿、出血、透明膜形成[4];随着疾病进展,可见部分肺泡间隔轻度增宽,纤维组织增生伴急慢性细胞浸润,病变进入亚急性期。肺孢子菌肺炎(PCP)是一个机会感染性疾病,多见于免疫功能缺陷或长期接受免疫抑制剂治疗者,若缺乏针对性治疗,病情迅速恶化,预后极差[5]。
4 小结
本例患者肺部组织学改变可见肺泡腔内充满蛋白、纤维素性渗出物及出血,伴透明膜形成,局灶见机化改变,符合弥漫性肺泡损伤(急性期),与肺部孢子菌病、曲霉菌性肺炎等多重真菌、细菌感染伴多灶肺脓肿形成有关,从而引起急性呼吸窘迫综合征(ARDS),是该患者直接死亡原因。患者有心脏移植病史,术后使用免疫抑制剂抗排异治疗,机体免疫机能低下,是肺部多重感染的易感因素。此外,心包粘连严重,使心脏代偿功能下降,为患者死亡的加速因素。
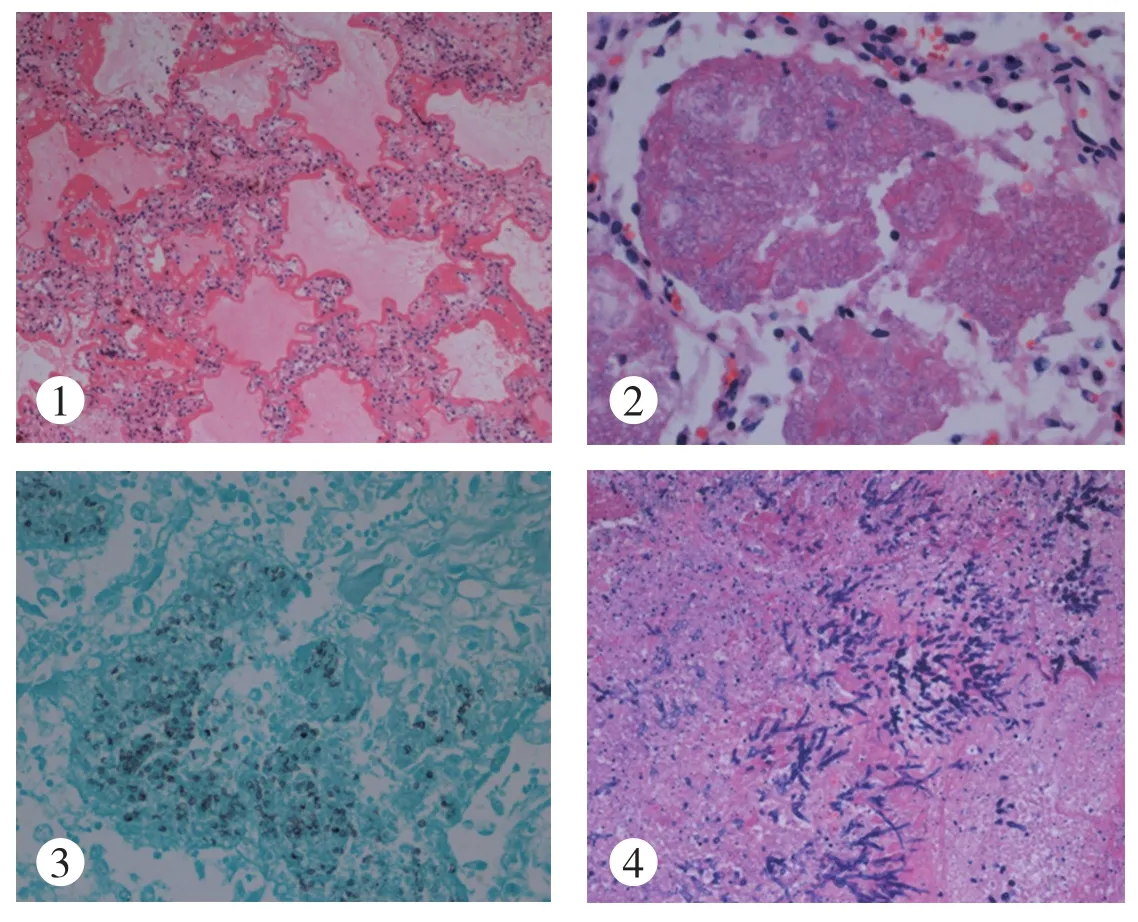
图1 急性肺损伤(HE×100):肺泡腔内可见大量水肿液,沿肺泡壁均匀粉染的透明膜形成,肺泡间隔较多慢性炎细胞浸润。图2 肺孢子菌性肺炎(HE×400):肺泡腔内可见大量“泡沫状”渗出物。图3 肺孢子菌性肺炎:银染(六胺银染色×400)显示肺泡腔内“泡沫状”渗出物内可见大量圆形、卵圆形菌体,菌体呈黑色,部分菌体有明显的沟或皱褶。图4 肺曲霉菌性肺炎(HE×200):坏死组织内见大量真菌菌丝,菌丝呈分支状、锐角。
