FTO基因rs9939609单核苷酸多态性与妊娠期糖尿病发病风险的相关性研究
2020-09-06肖玲舒俊俊龚丹
肖玲 舒俊俊 龚丹

[摘要] 目的 探讨FTO基因rs9939609单核苷酸多态性与妊娠期糖尿病发病风险的相关性。 方法 选取2018年3~9月期间我院收治的30例妊娠期糖尿病(Gestational diabetes mellitus,GDM)患者(GDM组,n=30)及30例健康孕妇(对照组,n=30)为研究对象,采用聚合酶链反应(polymerase chain reaction,PCR)法测定两组孕妇FTO基因多态性rs9939609位点基因型,计算等位基因频率并进行比较。 结果 GDM组孕妇TT基因型频率低于对照组,TA、AA基因型频率高于对照组(P<0.05)。GDM组孕妇T等位基因频率低于对照组,A等位基因频率高于对照组(P<0.05)。 结论 FTO基因rs9939609单核苷酸多态性位点A等位基因与妊娠期糖尿病发病风险增加相关。
[关键词] FTO基因;单核苷酸多态性;妊娠期糖尿病;疾病易感性
[Abstract] Objective To explore the correlation between single nucleotide polymorphism (SNP) of FTO gene rs9939609 and the risk of gestational diabetes mellitus(GDM). Methods 30 patients with gestational diabetes mellitus(GDM)(GDM group, n=30) and 30 healthy pregnant women(control group, n=30) admitted to our hospital from March to September 2018 were selected as research subjects. Polymerase chain reaction(PCR) method was used to determine the FTO gene polymorphism rs9939609 genotype in the two groups of pregnant women, and allele frequencies were calculated and compared. Results TT genotype frequency of pregnant women in the GDM group was lower than that of the control group, and TA genotype frequency and AA genotype frequency were higher than those of the control group(P<0.05). The frequency of T allele of pregnant women in the GDM group was lower than that in the control group, and the frequency of A allele was higher than that in the control group(P<0.05). Conclusion The allele A of FTO gene rs9939609 single nucleotide polymorphism is related to the increased risk of gestational diabetes mellitus.
[Key words] FTO gene; Single nucleotide polymorphism(SNP); Gestational diabetes mellitus(GDM); Susceptibility to diseases
妊娠糖尿病(Gestational diabetes mellitus,GDM)定义为“妊娠中期或中期诊断的糖尿病,并不明显是显性糖尿病”。GDM大约影响所有妊娠的7%(2%~18%),可能导致母亲和胎儿/婴儿的短期和长期并发症,并且GDM被认为是糖尿病和心血管疾病潜在风险因素[1]。尽管该病的病因尚未完全阐明,但妊娠前超重状况、妊娠期体重增加、糖尿病的种族和家族史在GDM的发生和进展中起着重要作用。分子技术的最新进展强调了遗传因素在糖尿病妊娠的发展、治疗和并发症中的重要作用。近年来,已有研究证明胰岛素代谢途径中几个基因的多态性与GDM风险的增加之间存在显著相关性[2,3]。为了建立一个预防、早期诊断和治疗GDM的策略,能够解释GDM易感性差异的额外遗传标记的识别将是一个关键点。脂肪量和肥胖相关基因(Fat-mass and obesity-associated gene,FTO)位于16q12.2,大量研究证实,FTO基因 rs9939609单核苷酸多态性位点变异与肥胖和2型糖尿病风险增加显著相关[4,5],但其与GDM的相关性在国内尚未见报道。为此,本研究的目的是通过研究GDM患者FTO基因 rs9939609单核苷酸多态性位点基因型,以便评估其与GDM的易感性之间的相关性,为GDM的早期诊断与防治积累数据,现报道如下。
1 资料与方法
1.1 一般资料
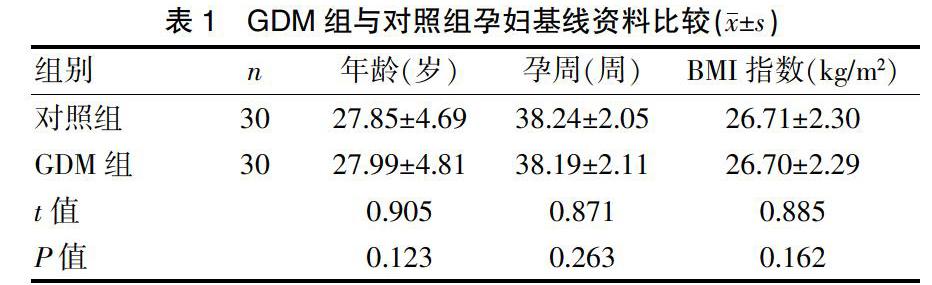
选取2018年3~9月期间我院收治的30例GDM患者(GDM组,n=30)及30例健康孕妇(对照组,n=30)为研究对象。GDM患者按照2 h血糖分为轻度GDM组[(8.1~9.0) mmol/L,n=10]、中度GDM组[(9.1~10.0) mmol/L,n=10]和重度GDM组[(10.1~11.0) mmol/L,n=10]。入组标准:①GDM组孕妇符合GDM诊断标准者;②年龄≥22岁,孕周37~40周者;③对照组孕妇无糖尿病家族史者;④临床资料完整者。排除标准:①妊娠合并症或并发症者;②合并心脑血管疾病者;③孕前糖尿病史者;④合并恶性肿瘤者。本研究经我院伦理委员会批准,患者自愿参加试验并签署知情同意书。GDM的诊断标准:空腹血糖≥5.1 mmol/L,1 h≥10.0 mmol/L,2 h≥8.5 mmol/L;任意一点血糖值异常即可诊断为妊娠期糖尿病。GDM組与对照组孕妇年龄、孕周、BMI指数等基线资料比较差异均无统计学意义(P>0.05),见表1。
1.2 方法
1.2.1 血样的采集及DNA提取 于清晨空腹状态下,取受试者外周静脉血各3 mL,加入EDTA抗凝管内,充分摇匀后保存于-20℃条件待测;采用QIAamp全血基因组DNA快速提取试剂盒(Qiagen公司,美国)进行基因组DNA,操作过程严格按照试剂盒说明书执行,将提取的基因组DNA保存于-80℃条件,统一测序。①取200 mg组织,放到1.5 mL EP管中,加入1 mL Trizol剪碎,震荡30 s;②加0.2 mL氯仿,剧烈摇动30 s,室温3 min;③12 000×g,4℃离心,15 min;④吸上层无色水相,移入另一EP管中(约0.5 mL),加等体积异丙醇,-20℃,30 min;⑤12 000×g,4℃ 离心,10 min。在管底部可见微量RNA沉淀;⑥弃上清,加75%乙醇1 mL,振荡;⑦7500×g,4℃离心,10 min;⑧弃上清,用滤纸小心吸取残留液体,室温干燥5~10 min;⑨沉淀溶于20 μL DEPC水,取1 μL加入79 μL DEPC水测OD260/OD280;⑩计算浓度与纯度,-70℃保存。
1.2.2 聚合酶链反应(Polymerase chain reaction,PCR)法测定FTO基因多态性位点基因型 采用PCR技术,对提取的FTO基因组DNA进行扩增,10 mL PCR反应体系:DNA模板(20 ng/μL)1 μL,2×Taqman Universal Master Mix 3 μL,20×Taqman-MGB探针0.5 μL,去离子水3.5 μL,引物序列F:5-CTAACATCAGTTATGCATTTAGAATGTCTG-3,R:5-CCCACTCCA-TTTCTG ACTGTTACC-3。反应条件:95℃ 10 min,40个循环(92℃ 15 s,60℃ 1 min),60℃ 1 min。反应结束后,采用荧光定量PCR仪(ABI7500型)读取样品孔中的终点荧光,基因分型结果采用分析软件进行分析。
反应程序:将RAPD反应试剂加入EP管中,轻混后用100 μL石蜡油覆盖于反应混合液之上,防止样品在反复加热-冷却的过程中蒸发,盖好盖子,打开PCR反应仪输入以下反应数据:94℃预变性5 min→94℃变性40 s→40℃退火40 s→72℃延伸1 min,将EP管放入仪器开始扩增,循环35次;72℃延伸10 min,仪器为Model MyGene 25 Plus。见表2。
1.3 观察指标
比较GDM组与对照组受试者FTO基因rs9939609单核苷酸多态性位点基因型、等位基因频率。(1)基因组DNA抽提的血液标本采用TIANGEN血液基因组DNA抽提系统(非离心柱型)抽提。(2)多态位点的选择:本研究采用综合性的多态位点选择策略,即先选择Tag SNP,再综合现有的GwAs研究的文献报道补充纳入其他重要多态位点。(3)基因多态检测分型:在Ⅰ阶段,对FTO基因的24个SNPs的分型采用SNPScall技术,由上海天昊生物技术有限公司完成。Ⅱ阶段对rs9939609多态位点的分型实验是由上海辉瑞生物科技有限公司完成。
1.4 统计学处理
采用SPSS20.0统计学软件处理;计量资料以均数±标准差(x±s)表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 GDM组与对照组孕妇FTO基因rs9939609位点基因型频率比较
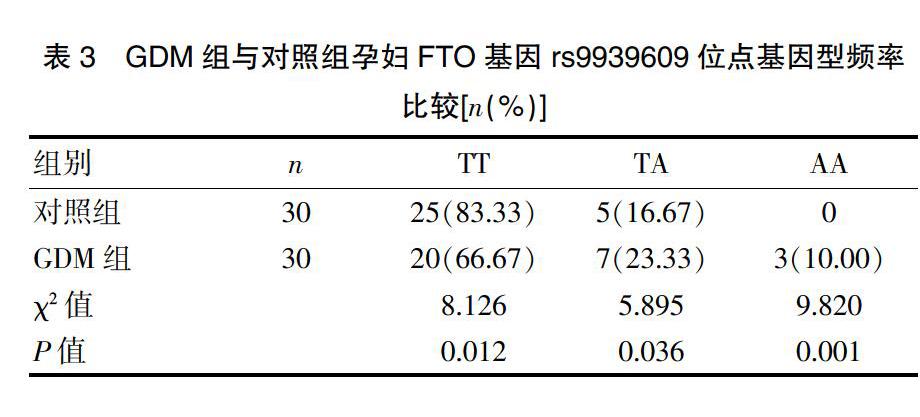
对照组中FTO基因rs9939609位点为TT、TA、AA基因型的孕妇分别为25例、5例、0例,GDM组中分别为20例、7例、3例,GDM组孕妇TT基因型频率低于对照组,TA、AA基因型频率高于对照组,差异有统计学意义(P<0.05),见表3。
2.2 GDM组与对照组孕妇FTO基因rs9939609位点等位基因频率比较
GDM组孕妇T等位基因频率低于对照组,A等位基因频率高于对照组,差异有统计学意义(P<0.05),见表4。
3讨论
GDM是妊娠期最常见的疾病之一,根据国际糖尿病联合会的数据,妊娠期高血糖的全球患病率为16.9%,包括妊娠期总糖尿病(已知和以前未确诊的糖尿病)和妊娠期糖尿病,GDM与母亲和后代的重大短期和长期不良后果有关[6]。越来越多的证据表明,宫内环境影响关键的发育过程和长期疾病发展。50多年前,国外学者Pedersen Y提出了一个著名的理论,即母体高血糖会诱发胎儿高胰岛素血症,从而导致不良妊娠结局;1980年, Freinkel N通过描述“燃料介导的致畸”扩展了Pedersen的假说,认为过量摄入营养素会导致胎儿高胰岛素血症,并使胎儿一生易患高胰岛素血症,导致肥胖和糖尿病的发展[7-9]。由于在妊娠期暴露于母亲糖尿病中的许多女性后代在生育年龄时会患上肥胖症和糖尿病,因此子宫内营养过剩的后果可能被视为一个世代延续的恶性循环。为了母亲和后代的健康,应及早发现GDM并采取相应预防措施,故而确定GDM发展的危险因素变得越来越重要。研究证实,遗传变异与糖尿病前期和2型糖尿病患者的GDM和进展相关[10]。正如一系列研究所证实,2型糖尿病是由于遗传倾向与生活方式之间的相互作用而发展起来的,GDM和2型糖尿病的发病机制有许多相似之处,故而推断基因-环境相互作用可以解释GDM的发生与发展[11,12]。
人类FTO基因位于染色体16q12.2,几乎在所有组织中均广泛表达。FTO基因编码的蛋白质属于2-氧戊二酸依赖性核酸脱甲基酶,涉及能量代谢[13]。遗传背景对于理解调节肥胖的代谢途径很重要。端粒长度磨损可能受肥胖相关炎症和氧化应激的影响。有新的证据表明端粒长度和肥胖是双向相关的。FTO基因可能是一个调节“主开关”基因的例子,该基因影响对肥胖调节中许多关键调节途径的表观遗传控制。有人认为,肥胖相关的FTO单核苷酸多态性可能通过增加食物摄入量、增加饥饿/降低饱腹感以及调节肥胖因素来影响肥胖;另有研究指出,FTO 基因与生长激素释放肽循环和瘦素水平显著相关,是摄食行为的关键介质,并与血清脂联素、抗高血糖、抗动脉粥样硬化和抗炎脂肪因子显著相关;此外,由于代谢平衡和肥胖体内平衡的基因联系对于慢性疾病和端粒长度的调节很重要,且端粒较短与体重指数增加、肥胖增加、腰臀比增加和内脏脂肪堆积之间存在联系,故而认为FTO基因与代谢综合征风险相关[14,15]。FTO基因单核苷酸多态性位点rs9939609是研究中最常见的人群肥胖基因,风险等位基因(A等位基因)与儿童和成人的总能量(食物摄入量)增加、蛋白质和脂肪摄入量增加有关。FTO单核苷酸多态性主要位于内含子1中,据报道与食欲分级的个体差异、饮食失控以及在没有饥饿的情况下进食有关。据观察,FTO基因单核苷酸多态性位点携带rs9939609 A等位基因(AA或AT基因型)的儿童和青少年可自行选择试验餐中能量密度更高的成分;在成人中,A等位基因携带者更有可能表现出对饮食的失控、餐后饱腹感水平的改变、饥饿感的增加和飽腹感自我评定的降低。FTO基因单核苷酸多态性rs9939609 位点AA基因型与神经底物活性相关,与食物线索反应性相关[16,17]。
国外研究人员提出,FTO基因可能通过影响全身炎症反应,参与胰岛素抵抗和糖尿病的发生发展。一项全基因组关联研究(GWAS)证实,位于FTO基因第一个内含子内的单核苷酸多态性位点rs9939609变异体通过对体重指数的影响使欧洲人群易患糖尿病,而来自南亚人群的其他报告显示FTO基因变异体独立于体重指数增加了2型糖尿病的风险。从那时起,几项研究代表了不同种族的人群,证实了FTO基因单核苷酸多态性位点rs9939609与2型糖尿病之间的密切联系:2016年的一项研究表明,FTO变异体对肥胖易感性的性别特异性影响,表明FTO变异体对日本男性(而非女性)2型糖尿病易感性的影响是通过FTO对体重指数的影响来介导的;2018年,对伊朗肥胖妇女进行的一项病例对照研究表明,包括rs9939 609在内的几个FTO变异体也与2型糖尿病和肥胖有关;最近的空间分析和荟萃分析表明FTO基因单核苷酸多态性位点rs9939609和2型糖尿病之间存在区域相关性,但报告的结果在不同种族人群中不一致[18-20]。
既然GDM与2型糖尿病之间具有相似之处,而FTO基因单核苷酸多态性位点rs9939609参与2型糖尿病的发生发展,故而提出假设其同样与GDM的发生发展相关。本研究以GDM患者及健康孕妇为研究对象,通过测定FTO基因单核苷酸多态性位点rs9939609基因型发现,GDM组孕妇TT基因型频率低于对照组,TA、AA基因型频率高于对照组,且GDM组孕妇T等位基因频率低于对照组,A等位基因频率高于对照组,提示携带A等位基因的孕妇具有更高的GDM发生风险。
综上所述,FTO基因rs9939609单核苷酸多态性位点A等位基因与妊娠期糖尿病发病风险增加相关。早筛查、早诊断和严格按标准控制饮食对GDM 病例十分重要。目前临床医生认为,若血糖控制满意可等待足月自然临产。如果早诊断、早治疗,孕妇血糖控制满意,对没有合并症或并发症的孕妇加强母儿监护,则完全可待其自然临产,可以极大改善GDM产妇的生育结局。
[参考文献]
[1] 李玖蓉,张庆英,程琰,等. 妊娠期糖尿病相关基因研究进展[J]. 中国优生与遗传杂志,2019,27(2):129-132.
[2] Lin Z,Wang Y,Zhang B,et al. Association of type 2 diabetes susceptible genes GCKR, SLC30A8, and FTO polymorphisms with gestational diabetes mellitus risk:A meta-analysis[J]. Endocrine,2018,62(1):34-45.
[3] Franzago M,Fraticelli F,Nicolucci A,et al. Molecular analysis of a genetic variants panel related to nutrients and metabolism:Association with susceptibility to gestational diabetes and cardiometabolic risk in affected women[J]. J Diabetes Res,2017,2017:4612623.
[4] 刘杨,孟海霞. 妊娠期糖尿病易感基因多态性的种族差异[J]. 世界最新医学信息文摘,2018,18(45):55-58.
[5] Saucedo R,Valencia J,Gutierrez C,et al. Gene variants in the FTO gene are associated with adiponectin and TNF-alpha levels in gestational diabetes mellitus[J]. Diabetol Metab Syndr, 2017,9(3):32.
[6] 王朝霞. 试析肥胖相关基因FTO表达水平与2型糖尿病的关系[J]. 临床医药文献电子杂志,2016,58(3):11518-11528.
[7] Joehanes R,Zhang X,Huan T,et al. Integrated genome-wide analysis of expression quantitative trait loci aids interpretation of genomic association studies[J]. Genome Biol, 2017,18(1):16.
[8] He H,Cao WT,Zeng YH,et al. Lack of associations between the FTO polymorphisms and gestational diabetes:A meta-analysis and trial sequential analysis[J]. Gene,2018,677(11):169-175.
[9] Chen Z,Yuan W,Liu T,et al. Bioinformatics analysis of hepatic gene expression profiles in type 2 diabetes mellitus[J]. Exp Ther Med,2019,18(6):4303-4312.
[10] 連一霏,连续. FTO rs8050136多态性与黑龙江地区汉族人群2型糖尿病的相关性[J]. 标记免疫分析与临床,2015,22(11):1128-1132.
[11] Franzago M,Fraticelli F,Marchetti D,et al. Nutrigenetic variants and cardio-metabolic risk in women with or without gestational diabetes[J]. Diabetes Res Clin Pract,2018,137(3):64-71.
[12] Popova PV,Klyushina AA,Vasilyeva LB,et al. Effect of gene-lifestyle interaction on gestational diabetes risk[J]. Oncotarget,2017,8(67):112024-112035.
[13] 王炳蔚,鄭瑞茂. 人类FTO基因变异抑制脂肪细胞线粒体产热导致肥胖[J]. 生理科学进展,2015,46(6):472.
[14] Leung GKW,Huggins CE,Ware RS,et al. Time of day difference in postprandial glucose and insulin responses:Systematic review and meta-analysis of acute postprandial studies[J]. Chronobiol Int,2019,29(11):1-16.
[15] de Melo SF,Frigeri HR,dos Santos-Weiss IC,et al. Polymorphisms in FTO and TCF7L2 genes of Euro-Brazilian women with gestational diabetes[J]. Clin Biochem,2015, 48(16-17):1064-1067.
[16] Guo F,Long W,Zhou W,et al. FTO,GCKR,CDKAL1 and CDKN2A/B gene polymorphisms and the risk of gestational diabetes mellitus:A meta-analysis[J]. Arch Gynecol Obstet,2018,298(4):705-715.
[17] Beysel S,Eyerci N,Ulubay M,et al. Maternal genetic contribution to pre-pregnancy obesity, gestational weight gain,and gestational diabetes mellitus[J]. Diabetol Metab Syndr,2019,11(3):37.
[18] 肖珊,阿勒滕齐齐格,姚华,等. CDKAL1、CDKN2A/2B、FTO基因多态性与维吾尔族2型糖尿病的关联以及基因间交互作用研究[J]. 中国医药导报,2017,14(9):16-21,30.
[19] 邓莉,宋丹,张燕,等. 肥胖症相关基因rs9939609单核苷酸多态性和肥胖在多囊卵巢综合征中交互作用的研究[J].诊断学理论与实践,2016,15(3):308-311.
[20] Gesteiro E,Sánchez-Muniz FJ,Ortega-Azorín C,et al. Maternal and neonatal FTO rs9939609 polymorphism affect insulin sensitivity markers and lipoprotein profile at birth in appropriate-for-gestational-age term neonates[J]. J Physiol Biochem,2016,72(2):169-181.
(收稿日期:2019-11-27)
