间充质干细胞对脓毒症性急性肺损伤大鼠肺内皮细胞再生能力的作用研究
2020-09-06杨婧屈晓一党丹
杨婧 屈晓一 党丹
脓毒症是因机体对感染反应失调而导致的危及生命的器官功能障碍,且可在感染后持续进展,并最终导致促炎反应与抗炎反应的机制失衡、细胞凋亡和组织器官损伤等[1]。肺组织对于脓毒症性损伤十分敏感,文献报道大约有50%的脓毒症患者会出现脓毒症性急性肺损伤(sepsis induced acute lung injury, SI-ALI)[2]。脓毒症后炎症反应是引起肺损伤的主要因素,研究发现肺内皮细胞(endothelial cells, ECs)是炎症反应损伤的主要靶细胞[3]。一方面,过度的炎症反应会引起ECs损伤和肺功能障碍;另一方面,ECs的再生修复能力在炎症反应后可以被激活并具有修复肺损伤的作用[3]。基于以上文献报道,抑制脓毒症后过度炎症反应可能具有促进ECs发挥再生修复能力,并进而改善SI-ALI后肺功能的潜能。新近的研究发现,间充质干细胞(mesenchymal stem cell, MSCs)具有调控脓毒症后免疫炎症反应的功能[4-5]。然而,MSCs是否能够促进SI-ALI后ECs发挥再生修复能力尚不清楚。鉴于此,本研究通过动物实验初步探讨了MSCs对SI-ALI大鼠肺ECs再生能力的作用。
资料与方法
一、 实验动物
33只成年雄性SD大鼠(周龄:8~10周,体重:250~300g)由本单位实验动物中心提供。将这些大鼠饲养在本单位实验室,饲养环境:12小时一循环的昼夜节律,温度21.0±2°C,湿度50~55%,并给予提供足够的水和食物。其中3只大鼠用于获取骨髓MSCs;另外30只用于后续实验。采用随机数字表法将30只大鼠随机分为3组:对照组、SI-ALI组和SI-ALI+MSCs组,每组10只。本单位实验经伦理委员会批准开展此项研究,实验动物操作流程按照中国实验动物操作指南进行。
二、实验试剂
所用试剂包括:检测MSCs表面分子的流式抗体CD29、CD45和CD90 (Abcam, UK);构建SI-ALI模型的LPS (Sigma,USA);检测炎症因子IL-1、IL-6、TNF-α 相对应mRNA表达水平的逆转录-聚合酶链反应(reverse transcriotion-polymerase chain reaction, RT-PCR) TRIzol 试剂盒(Invitrogen,USA);BrdU (Sigma, USA);检测ECs再生能力的抗BrdU抗体(Abcam, UK)和抗VE钙黏素抗体(Abcam, UK);流式细胞术(flow cytometry, FCM)所用胎牛血清、多聚甲醛、流式洗液等。
三、MSCs的分离、培养和鉴定
利用水合氯醛将大鼠麻醉后颈椎脱臼处死,暴露出双侧股骨和胫骨,祛除肌肉、肌腱、筋膜等软组织。切断股骨、胫骨两端的干骺端,然后放置于含有10%胎牛血清、10%马血清和1%青霉素/链霉素(Life Technologies, USA)的L-DMEM培养基中,利用注射器多次抽吸培养基以冲洗骨髓腔至到发白。收集所有冲洗液,在室温、1200 r/min条件下离心8 min,祛掉上清液,保留离心后沉淀物。将分离的细胞均匀接种至含10%胎牛血清和1%青霉素/链霉素(Life Technologies, USA)的L-DMEM培养瓶中,培养条件为37℃、5% CO2。待细胞生长至80%~90%纯度时,离心后祛掉上清液,用PBS冲洗,胰酶消化后离心。将细胞沉淀再加入含有10%胎牛血清和1%青霉素/链霉素(Life Technologies, USA)的L-DMEM培养瓶中,按 1 ∶2 比例传代,每瓶细胞培养基体积为 5 mL。参照前述方法继续传代培养,取第 3 代细胞用于后续实验。获取第3代细胞后,利用FCM对其表面分子进行鉴定,具体方法参见下文“1.7 流式细胞术”。
四、构建SIC大鼠模型和不同组大鼠处理
将LPS在生理盐水中溶解稀释,以6mg/kg的剂量通过腹腔注射的方法构建SIC大鼠模型。对照组大鼠只接受同等体积的生理盐水腹腔注射。在SI-ALI+MSCs组,MSCs以106/mL的浓度在LPS注射后2小时之内经过尾静脉注射给大鼠,每只大鼠注射剂量为2mL。为了检测大鼠肺中ECs的再生能力,在处死大鼠前24小时,将BrdU以150mg/kg的浓度通过尾静脉注射入大鼠体内。
五、肺组织标本获取
在LPS腹腔注射后72小时,并完成BrdU、MSCs等尾静脉注射后将各组大鼠处死,分离出肺组织并在预冷生理盐水中清洗干净,分装后在-80℃条件下保存以备后续实验使用。
六、实时定量聚合酶链反应 (RT-PCR)
利用RT-PCR检测肺组织中炎症因子IL-1、IL-6、TNF-α 相对应mRNA的表达水平。具体步骤如下:首先利用TRIzol试剂并参照说明书提取出肺组织中的总RNA,RNA的量是利用260/280比值来确定的。每一个标本取1ugRNA用来逆转录为cDNA,每1ulcDNA被用来做RT-PCR检测,做RT-PCR的内参为β-actin。具体的操作步骤参照各种试剂的说明书进行。PCR的反应条件为:95℃预变性5min,95℃变性20s,60℃退火30 s,72℃延伸30 s,40个循环,72℃延伸7min。每份标本检测3次,最终取平均值作为最终结果。
七、流式细胞术
参照文献报道的方法,分离大鼠肺ECs,然后将ECs重悬于含有10%胎牛血清的流式洗液中,以制备ECs单细胞悬液。将检测ECs再生能力的抗BrdU抗体(Abcam, UK)和抗VE钙黏素抗体(Abcam, UK)参照试剂说明加入ECs单细胞悬液中。避光、室温孵育2小时,离心后祛掉上清;加入反应终止液,离心后再祛掉上清。而后再用PBS清洗3次,并重悬于含有10%胎牛血清的流式洗液中,在流式细胞仪(BD, USA)上进行检测。检测MSCs表面分子的方法参照前述方法进行,所用抗体为兔抗大鼠CD44、CD56和CD90(Abcam, UK)。
八、统计学分析
实验所得数据以平均值±标准差(M±SD)的形式表示, 利用SPSS 17.0 统计学软件进行统计分析。三组间数据的总体比较采用单因素方差分析(ANOVA),四组间的两两比较采用LSD-t方法。P<0.05 代表差异有统计学意义。
结 果
一、分离出了大鼠骨髓来源的MSCs
参照前述实验方法,分离出了大鼠骨髓来源的MSCs,利用FCM对MSCs表面分子CD29、CD45和CD90进行了分析,结果提示:CD29、CD90高表达,而CD45低表达,符合MSCs表面分子的表达特征(见表1)。

表1 MSCs表面分子表达率(%)
二、MSCs处理降低了SI-ALI大鼠肺组织中炎症因子的表达水平
与对照组相比,SI-ALI组大鼠肺组织中炎症因子IL-1、IL-6、TNF-α的表达水平升高。与SI-ALI组相比,SI-ALI+MSCs组大鼠肺组织中炎症因子IL-1、IL-6、TNF-α的表达水平降低(见表2)。

表2 MSCs处理降低了SI-ALI大鼠肺组织中炎症因子的表达水平(相对表达量)。
三、MSCs处理提升了SI-ALI大鼠肺组织中ECs的再生能力
与对照组相比,SI-ALI组大鼠肺组织中ECs的再生能力提高。与SI-ALI组相比,SI-ALI+MSCs组大鼠肺组织中ECs的再生能力进一步提高(见表3)。

表3 MSCs处理提升了SI-ALI大鼠肺组织中ECs的再生能力。
四、MSCs处理提升了SI-ALI大鼠的存活率
与对照组相比,SI-ALI组大鼠存活率明显降低。与SI-ALI组相比,SI-ALI+MSCs组大鼠存活率明显提升(见表4)。
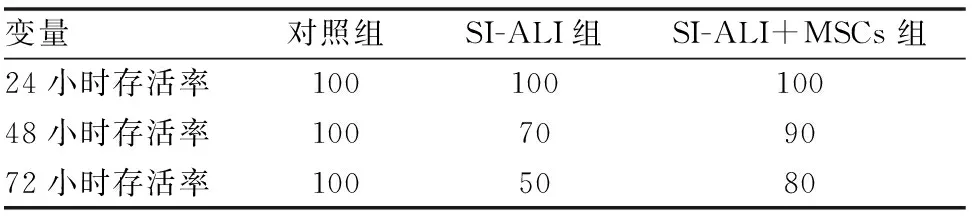
表4 MSCs处理提升了SI-ALI大鼠的存活率(%)
讨 论
本研究通过动物实验初步探讨了大鼠骨髓来源的MSCs对SI-ALI大鼠肺ECs再生能力的作用,结果发现:MSCs减轻了SI-ALI大鼠肺组织中炎症因子的表达水平、增强了ECs的再生能力,并提高了存活比率。鉴于MSCs具有调控脓毒症后免疫炎症反应的功能[4-5],MSCs可能是减轻脓毒症后肺损伤、促进肺ECs发挥再生修复能力并进而降低SI-ALI患者死亡率的一种新方法。
目前的研究认为,脓毒症的自然病程包含两个主要过程:早期的促炎过程和后期的抑炎过程,巨噬细胞在脓毒症后炎症反应的发生发展过程中发挥重要作用[3]。巨噬细胞通过释放抑炎因子或促炎因子调控脓毒症的病理生理过程。促炎因子是造成脓毒症后、器官损伤的主要因素。其中,肺组织对于脓毒症性损伤十分敏感,文献报道有50%左右的脓毒症患者会出现SI-ALI[2],且肺ECs是炎症反应损伤的主要靶细胞[3]。一方面,过度的炎症反应会引起ECs损伤和肺功能障碍;另一方面,ECs的再生修复能力在炎症反应后可以被激活并具有修复肺损伤的作用[3]。之前的研究已经发现,巨噬细胞释放的促炎因子减少后,ECs的再生能力得以增强,且肺泡细胞、肺新生血管的数量均增多[6,7]。鉴于以上文献报道,寻找可行措施抑制SI-ALI后炎症反应,可能是提升ECs再生修复能力并进而降低肺损伤程度的有效策略。
MSCs具有免疫调节、抑制炎症反应和缓解器官衰竭等诸多功能,这为探索利用MSCs治疗脓毒症提供了新思路。脓毒症发生后,感染损伤相关分子与相应识别受体相互结合,激活并促进炎症小体的组装,从而介导巨噬细胞释放炎症因子。炎症因子可以通过炎症小体与更多的免疫细胞结合,从而产生级联放大效应,并最终导致细胞死亡和气管损伤[8]。新近的研究发现,MSCs可以在动物模型上减轻脓毒症后炎症反应,并从而缓解器官损伤[9-10]。基于MSCs的功能和现有研究报道,本研究尝试了利用MSCs抑制SI-ALI后炎症反应并进而促进ECs发挥再生修复能力和降低肺损伤程度的可能性。结果发现,MSCs减轻了SI-ALI大鼠肺组织中炎症因子的表达水平、增强了ECs的再生能力,并提高了大鼠总体存活比率。虽然本研究初步观察了MSCs对于SI-ALI后炎症反应和ECs再生能力的调控作用,其内含的机制尚需要开展更多的研究进行探讨。
总之,本研究通过动物实验发现:MSCs减轻了SI-ALI大鼠肺组织中炎症因子的表达水平、增强了ECs的再生能力,并提高了存活比率。MSCs可能是减轻脓毒症后肺损伤、促进肺ECs发挥再生修复能力并进而降低SI-ALI患者死亡率的一种新策略。
