HPLC法检测晚期糖化产物前体物质的柱前衍生化条件优化*
2020-09-05朱美旗高文运
杨 阳 ,严 敏 ,朱美旗 ,高文运
(1.西安医学院药学院 药物研究所,陕西 西安710021;2.西北大学 国家微检测系统工程研究中心 生命科学学院,陕西 西安710069)
晚期糖基化终产物 (advanced glycation end products,AGEs)是一组在蛋白质、脂肪酸或核酸的氨基基团与还原糖的醛基之间发生非酶性糖基化反应(又称Maillard反应),所形成的一系列具有高度活性终产物的总称,其结构具有高度异质性。
现今研究已证明AGEs是糖尿病并发症如糖尿病肾病、糖尿病血管神经性病变的重要的机制之一[1-3]。同时,还有研究表明AGEs可以和人体的各种组织细胞相结合并且破坏这些组织细胞,加速人体的衰老,从而引起各种慢性退化性的疾病,比如阿尔茨海默病,动脉粥样硬化等疾病[4-6]。
α-二羰基化合物(ɑ-dicarbonyl compounds,ɑ-DC),是Maillard反应的重要中间产物,也是美拉德反应产生的有害物质即丙烯酰胺,4(5)-羟甲基糠醛,杂环胺等的重要前体物质。是在体内和体外都能产生的化学和生物活性物质。基于食品的质量控制以及保护人类健康,建立有效实用的检测手段来量化各种食品和生物样品中的α-DCs具有重要意义。
由于α-DCs是一类有着高度水溶而且缺乏发色团的化合物,通过对它们进行衍生化来引入一些具有紫外吸收的基团,从而来提高它们的可检测性是目前的主要检测方法之一。通常使用的衍生化试剂是邻苯二胺类化合物,原理是邻苯二胺类化合物可以通过其邻二氨基与α-DCs形成喹喔啉化合物[7],进而产生紫外吸收。文献调研发现使用4-硝基邻苯二胺(NPDA)作为衍生化试剂的文献报道少,且各文献报道用NPDA柱前衍生测定α-DCs含量的衍生条件不一致[8-10],并且不同衍生条件对测定结果的影响未见报道。故本研究对HPLC法检测AGEs前体物质(乙二醛、甲基乙二醛、2,3-丁二酮、2,3-戊二酮)的柱前衍生化条件进行优化,可为后续食品或生物样品中α-DCs的测定打下基础。
1 仪器与材料
1.1 仪器
SQP电子分析天平(赛多利斯科技仪器(北京)有限公司);DG-800旋涡混合器(北京鼎国昌盛生物技术有限责任公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司巩义市予华仪器有限责任公司);BDWI-HH-2A电热恒温水浴锅(北京中西远大科技有限公司);8453(紫外-可见分光光度计美国Agilent公司);Agilent LC1260高效液相色谱仪(美国Agilent公司)。
1.2 试剂
甲醇(色谱纯霍尼韦尔贸易上海有限公司);4-硝基-1,2-苯二胺(NPDA阿拉丁上海精纯试剂有限公司);乙二醛水溶液(8.8M阿拉丁上海精纯试剂有限公司);甲基乙二醛(32%溶液阿拉丁上海精纯试剂有限公司);2,3-丁二酮(99%阿法爱莎医药有限公司);2,3-戊二酮(97%西格玛奥德里奇贸易有限公司);浓盐酸(AR上海生物工程技术有限公司);氢氧化钠(AR四川西陇化工有限公司)。
2 方法与结果
2.1 α-二羰基类化合物的衍生化反应
将50mM的2,3-戊二酮、甲基乙二醛、2,3-丁二酮、乙二醛水溶液用超纯水分别逐级稀释至浓度为500μM,将10mM的NPDA醇溶液用甲醇逐级稀释至浓度为500μM,然后将α-DCs标准品溶液各取100μL与100μL NPDA分别涡旋混匀,再加入800μL的甲醇稀释至α-DCs标准品溶液终浓度为50μM,用pH值为1~14的B-广泛试纸调pH值至3,用电热恒温水浴锅在适宜的温度下加热一定的时间,取出放置至室温,4℃保存待检。
2.2 紫外最大吸收波长的确定
因α-DCs无紫外吸收,因此,需检测衍生化反应前后紫外吸收波长的变化,所以首先单独取500μM NPDA 200μL 装入石英比色皿中,在 200~800nm波长范围扫描,测得有两个最大的吸收波长,分别是λ1=272.0nm,λ2=401.0nm。然后分别取衍生化后的α-DCs标准品溶液200μL置于石英比色皿中,在200~800nm波长范围扫描,结果见表1。

表1 α二羰基类化合物衍生化产物紫外-可见吸收波长Tab.1 Ultraviolet-visible absorption wavelength of derivatives of dicarbonyl compounds
由表1可见,测得的结果基本接近于260.0nm,且260.0nm处的峰容易辨别,故采用260.0nm作为最大吸收波长。
2.3 色谱条件的选择和色谱峰的检测
色谱柱Shim Pack VP-ODS C18column(250×4.6mm,5μm);流动相甲醇∶水 =65∶35,等度洗脱;流速 0.7mL·min-1;柱温 35℃;进样量 10μL;检测波长260nm。4种α-DCs的色谱峰见图1。

图1 柱前衍生化后4种α二羰基类化合物的液相色谱图Fig.1 Pre-column derivatization HPLC chromatogram of 4 α-dicarbonyl compounds 1.NPDA 2.methylglyoxal 3.glyoxal 4.2,3-butanedione 5.2,3-pentanedione
2.4 单因素试验-衍生化反应条件的优化
2.4.1 pH值对衍生化反应进程的影响 取1mM的NPDA,200μM的 2,3- 戊二酮各 200μL,以物质的量比例为5∶1(终浓度为100μM)平行配制12份样品,分为4组,每组设3个平行。4组的pH值分别调至3、5、7、9,在同一温度下加热一定时间,过 0.22μm滤膜,按2.3方法测定峰面积。甲基乙二醛、丁二酮、乙二醛配制方法与戊二酮相同。结果见图2。
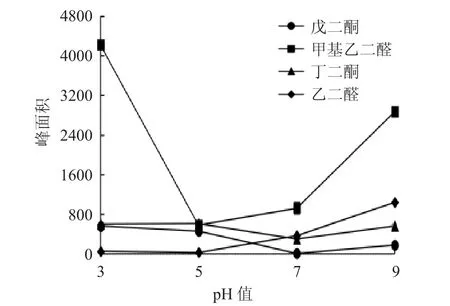
图2 pH值对α二羰基类化合物衍生化反应的影响Fig.2 Effect of pH on the derivatization of α-dicarbonyl compounds
由图2可见,甲基乙二醛和戊二酮在pH值为3时的峰面积最大,为反应最适pH值条件。丁二酮在pH值为5时的峰面积略大于其余3个pH值条件下的峰面积,衍生化反应受pH值为值影响较小。乙二醛的峰面积则在pH值为9时最大。本实验结果说明,除乙二醛外,其余3个α-DCs的最适反应条件为酸性,而乙二醛的衍生化反应则随着pH值的升高而增强,最适反应条件为碱性。
2.4.2 温度对衍生化反应进程的影响 取1mM的NPDA,200μM的 2,3- 戊二酮各 200μL,以物质的量比例为5∶1(终浓度为100μM)平行配制12份样品,分为4组,每组设3个平行。将样品的pH值均调至 3,4 组样品分别在温度为 25、40、60、80℃时加热一定时间,过0.22μm滤膜,按2.3方法测定峰面积。甲基乙二醛、丁二酮、乙二醛配制方法与戊二酮相同。结果见图3。
由图3可见,2,3-丁二酮和戊二酮的衍生化反应对温度不敏感,40℃为最适反应温度。乙二醛在40℃时反应产物的峰面积最大,之后随着温度升高,峰面积下降,初步判断是由于温度过高而产物发生了分解所致。因此,乙二醛衍生化的最适反应温度也为40℃。而甲基乙二醛的最适反应温度为60℃。
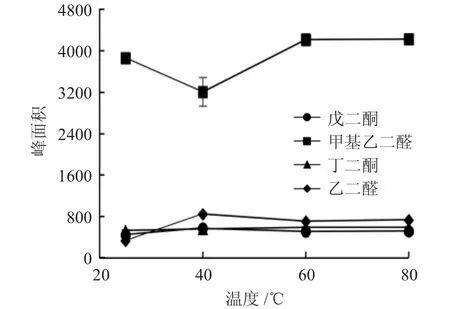
图3 温度对α二羰基类化合物衍生化反应的影响Fig.3 Effect of temperature on derivatization of α-dicarbonyl compounds
2.4.3 加热时间对衍生化反应进程的影响 取1mM的 NPDA,200μM的 2,3- 戊二酮各 200μL,以物质的量比例为5∶1(终浓度为100μM)平行配制15份样品,分为5组,每组设3个平行。将样品的pH值均调至 3,5 组样品分别于 40℃加热 10、20、30、60、120min,过0.22μm滤膜,按2.3方法测定峰面积。甲基乙二醛、丁二酮、乙二醛配制方法与戊二酮相同。结果见图4。

图4 加热时间对α二羰基类化合物衍生化反应的影响Fig.4 Effect of heating time on the derivatization of α-dicarbonylcompounds
由图4可见,丁二酮和乙二醛的峰面积随加热时间变化的趋势一致,最适反应温度均为30℃。戊二酮与甲基乙二醛的最适反应温度均为20℃。戊二酮的色谱图中,当加热时间达到或超过60min,在TR=10min附近出现杂峰,说明高温会导致反应产物分解或发生其他副反应。
2.4.4 物质的量的比例对衍生化反应进程的影响 分别按照体积比 1∶1、2∶1、4∶1、8∶1、10∶1 的比例取200μM的NPDA和200μM的2,3-戊二酮,混匀。每个比例平行配置3份,共15份。调pH值至3,在40℃下加热20min,过0.22μm滤膜。按2.3方法测定峰面积。甲基乙二醛、丁二酮、乙二醛配制方法与戊二酮相同。结果见图5。
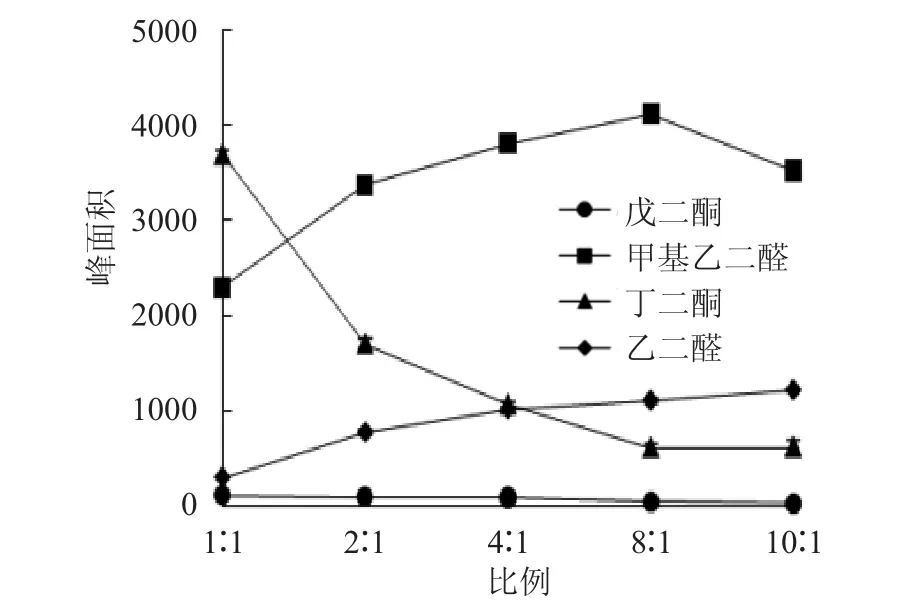
图5 物质的量的比例对α二羰基类化合物衍生化反应的影响Fig.5 Effect of the ratio of the amount of substance on the derivatization of α-dicarbonyl compounds
由图5可见,戊二酮和2,3-丁二酮在物质的量1∶1时,峰面积最大,此后随着NPDA量的增加,峰面积逐渐下降。说明二者最适的反应物质的量比例为1∶1。甲基乙二醛和乙二醛最适的反应物质的量比例分别为 8∶1 和 10∶1。
2.5 优化后标准曲线的制备
用甲醇和超纯水分别将NPDA和2,3-戊二酮储备液稀释为 2、1、0.5、0.25、0.125mM的溶液,各吸取相同浓度的二者200μL,混匀。制成2,3-戊二酮终浓度分别为 1000、500、250、125、62.5μM 的系列浓度溶液。调pH值至3,在40℃下加热20min,按2.3方法测定。以2,3-戊二酮衍生物的峰面积A对2,3-戊二酮摩尔浓度C进行线性回归,绘制标准曲线。甲基乙二醛、丁二酮、乙二醛配制方法与戊二酮类似。各化合物的标准曲线如下:2,3-戊二酮y=4.7749x+74.017,R2=0.9993,在 62.5~1000μM 范围内线性关系良好;甲基乙二醛y=82.987x-542.14,R2=0.9995,在 5.5~220μM范围内线性关系良好;2,3-丁二酮y=9.1958x+58.938,R2=0.9981,在 5~1000μM范围内线性关系良好;乙二醛y=10.967x-75.27,R2=0.9979,在5~120μM范围内线性关系良好。
2.6 衍生化反应产物的稳定性试验
精密吸取浓度为 500μM的 NPDA 400μL,500μM的 2,3- 戊二酮 400μL(物质的量的比例 1∶1)置于同一4.0mL的EP管中,用旋涡混合器混匀,调pH值至3,在40℃下加热20min,其余化合物均在最适反应条件下配置和反应。在2.3的色谱条件下,分别测产物 0,12,24,48h 内的峰面积,2,3- 戊二酮,甲基乙二醛,2,3-丁二酮,乙二醛衍生物峰面积的RSD值分别为4.82%,2.12%,4.88%,2.08%,结果表明衍生化后供试溶液在48h内稳定性良好。
3 讨论
邻苯二胺(o-Phenylenediamine,OPDA)及其类似物能够与α-DCs反应形成喹喔啉衍生物,从而使原本缺乏紫外吸收的α-DCs产生较强的紫外吸收,可用作柱前衍生-HPLC方法测定α-DCs的衍生化试剂。其中NPDA苯环上的硝基令它比一些简单的邻苯二胺类化合物,如OPDA在紫外及可见光波段的吸收都更强。且该试剂稳定性好、价格低廉,易于获得。而各文献报道用NPDA柱前衍生测定α-DCs含量的衍生条件不一致,并且不同衍生条件对测定结果的影响未见报道。因此,本实验单因素考察pH值,反应温度,反应时间,物质的量比例对α-DCs衍生化反应的影响,结果表明,本文中4个α-DCs的衍生化反应条件除乙二醛外均为酸性,在实验中发现,乙二醛在酸性条件下的反应需提高温度到70~80℃,与文献报道一致,但长时间加热会影响α-DCs前体物质的自氧化,且在衍生化试剂的存在下会改变葡萄糖的自氧化途径,这些都会导致α-DCs的含量测定并不准确。而在碱性条件下乙二醛的反应温度温和。另外,在四个α-DCs中,甲基乙二醛对于反应条件的变化最为敏感。
4 结论
综上,本实验结果说明,NPDA可在温和的反应条件下,短时间内与α-DCs发生衍生化反应。甲基乙二醛,2,3-丁二酮,2,3-戊二酮的反应最适pH值为酸性,乙二醛的最适pH值为碱性。加热温度不宜过高,加热时间不宜过长,否则衍生化产物可能会发生分解。可为后续食品或生物样品中α-DCs的测定打下基础。
