血清胃蛋白酶原对幽门螺杆菌感染的诊断价值
2020-09-04李树锦沈佐君
金 鑫, 李树锦, 陈 贞, 沈佐君
[1.合肥市第二人民医院 安徽医科大学附属合肥医院检验科,安徽 合肥 230011;2.中国科学技术大学附属第一医院(安徽省立医院)科研处,安徽 合肥 230001]
幽门螺杆菌(Helicobacter pylori,HP)感染可引起胃炎、消化性溃疡、胃癌及黏膜相关淋巴组织淋巴瘤等多种胃肠道疾病[1]。HP持续感染会导致胃黏膜炎症和胃腺体萎缩,而萎缩性胃炎是胃癌的重要危险因素之一[2]。HP感染者患胃癌的风险至少是非感染者的20倍[3]。因此,HP被认为是Ⅰ类致癌物质之一[4]。胃蛋白酶原是胃蛋白酶的前体,在pH值<5.0时可活化为胃蛋白酶,根据其生化和免疫学特性可分为胃蛋白酶原Ⅰ(pepsinogen Ⅰ,PGⅠ)和胃蛋白酶原Ⅱ(pepsinogen Ⅱ,PGⅡ)。PGⅠ主要由胃底的主细胞和黏液细胞分泌,而PGⅡ除由上述2种细胞分泌外,还可由胃贲门腺、幽门腺、十二指肠Brunner腺分泌,胃蛋白酶原分泌入胃腔后约有1%吸收入血,其水平间接反映了胃黏膜组织的状态和功能[5]。将胃蛋白酶原用于诊断胃黏膜萎缩严重程度并预测胃癌风险的标准已被建立。胃癌的患病风险在有无HP感染的个体之间差异很大,因此诊断患者是否感染HP比确定胃黏膜萎缩的严重程度更为重要。如果可以通过血清学试验评估胃癌的患病风险,无HP感染的低风险患者可以避免不必要的胃镜检查。KIKUCHI等[3]提出了一种通过胃蛋白酶原水平判断患者是否存在HP感染的方法,并建立了相关评估标准。然而,国内对这方面的研究甚少。为此,本研究拟探讨PGⅠ、PGⅡ以及胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ比值(pepsinogen Ⅰ/pepsinogen Ⅱ ratio,PGR)在判断HP感染中的价值。
1 材料和方法
1.1 研究对象
选取2017年2月—2019年8月在合肥市第二人民医院进行血清HP抗体和胃蛋白酶原检测并接受尿素呼气试验检查的住院患者。纳入血清HP抗体和尿素呼气试验结果一致的患者88例,其中男50例、女38例,年龄19~85岁。
1.2 方法
采集所有研究对象空腹静脉血5 mL,室温静置30 min,1 610×g离心5 min,分离血清。
采用胶乳免疫比浊法检测血清总HP抗体水平,包括IgG、IgM和IgA,试剂盒购自北京万泰德瑞公司,检测仪器为7600全自动生化分析仪(日本日立公司)。根据试剂盒提供的临界值判断阴阳性:HP抗体>15 AU/mL为阳性、≤15 AU/mL为阴性。根据厂商声明,该法诊断HP感染的敏感性、特异性及精确度均达到90%以上。
采用荧光免疫层析法检测血清PGⅠ、PGⅡ水平并计算PGR,试剂盒购自芬兰必欧瀚生物公司,检测仪器为HIT-91A荧光免疫分析仪(芬兰必欧瀚生物公司)。
1.3 HP感染的判定
所有患者均进行尿素呼气试验,根据第5次全国HP感染处理共识报告,尿素呼气试验是目前非侵入性诊断HP感染的“金标准”,同时参照合肥市第二人民医院消化内科诊疗标准,将尿素呼气试验和HP抗体同时阳性判定为HP感染(HP感染组56例),同时阴性判定为未感染HP(HP非感染组32例),仅1项阳性不纳入本研究。
1.4 统计学方法
采用SPSS 16.0软件进行统计分析。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用非参数Mann-WhitneyU检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估各项指标判断HP感染的价值。以P<0.05为差异有统计学意义。
2 结果
2.1 HP感染组与HP非感染组血清PGⅠ、PGⅡ水平及PGR的比较
88例患者中HP感染率为63.64%(56/88)。HP感染组血清PGⅠ、PGⅡ水平均高于HP非感染组(P值分别为0.021、0.000),PGR低于非感染组(P=0.000)。见表1。
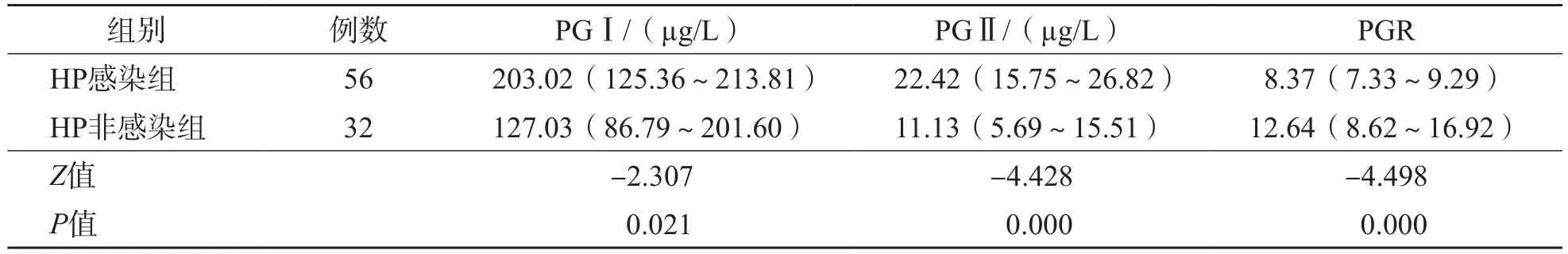
表1 HP感染组与HP非感染组血清PGⅠ、PGⅡ水平及PGR的比较 M(P25~P75)
2.2 不同性别之间血清PGⅠ、PGⅡ水平及PGR的比较
男性血清PGⅠ、PGⅡ水平均高于女性(P值分别为0.002、0.008),PGR男性、女性之间差异无统计学意义(P=0.601)。见表2。

表2 不同性别之间PGⅠ、PGⅡ含量以及PGR值比较 M(P25~P75)
2.3 PGⅠ、PGⅡ及PGR判断HP感染的效能
ROC曲线分析结果显示,PGⅠ、PGⅡ及PGR判断HP感染的曲线下面积(area under curve,AUC)分别为0.648、0.785和0.789,PGⅡ和PGR的最佳临界值分别为15.57 μg/L、9.27,敏感性分别为76.79%、75.00%,特异性分别为78.13%、68.75%。采用Logistic回归分析建立PGⅡ和PGR联合检测的模型:Log(P)=2.332+0.080×PGⅡ-0.313×PGR,联合检测模型判断HP感染的AUC为0.829,敏感性为92.86%,特异性为65.63%。见图1。
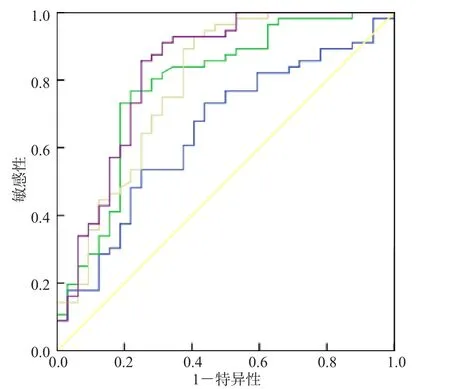
图1 PGⅠ、PGⅡ、PGR及PGⅡ+PGR联合检测判断HP感染的ROC曲线
3 讨论
流行病学调查显示,我国人群HP的自然感染率为50%~60%[6],本研究的HP感染率为63.64%,与文献报道[6]基本一致。本研究结果显示,HP感染组血清PGⅠ、PGⅡ水平均高于HP非感染组(P值分别为0.021、0.000),PGR低于HP非感染组(P=0.000),与国内外文献报道[7-8]一致。本研究结果还显示,男性血清PGⅠ、PGⅡ水平均高于女性(P值分别为0.002、0.008),PGR男性、女性之间差异无统计学意义(P=0.601),与蒋叶华等[9]的研究结果一致。
HP感染导致的胃黏膜变化是一个较长的演变过程。OKUDA等[7]的研究结果显示,HP感染可导致胃蛋白酶原分泌增加,在胃黏膜炎症或轻度萎缩患者中,PGⅠ、PGⅡ分泌增多,且PGⅡ增多的幅度通常较大,故PGR降低。随着胃黏膜萎缩的进展,胃底的主细胞数量逐渐减少,血清PGⅠ水平降低,但PGⅡ水平无明显变化,导致PGR降低更为显著[10]。因此,血清胃蛋白酶原和PGR的变化可被用于评估胃黏膜的状态和功能,在一定程度上也可以判断是否有HP感染。日本学者KIKUCHI等[3]提出可用胃蛋白酶原水平来区分有无HP感染,但国内相关的研究甚少。采用血清胃蛋白酶原水平来判断有无HP感染的目的在于使有HP感染的胃癌高风险患者能得到及时地诊断和治疗,同时尽量减少无HP感染的胃癌低风险患者不必要的上消化道内镜检查。KIYOHIRA等[11]采用放射免疫法检测胃蛋白酶原水平,并将PGⅡ≥15 μg/L或PGR≤6.5作为HP感染的阳性判断标准。KIKUCHI等[3]分别采用化学发光磁颗粒免疫分析法和胶乳凝集法检测胃蛋白酶原水平,并分别建立HP感染阳性判断标准,化学发光磁颗粒免疫分析法为PGⅡ≥10 μg/L或PGR≤5.0,胶乳凝集法为PGⅡ≥12 μg/L或PGR≤4.0。
尿素呼气试验是目前临床应用最广、检测准确性相对较高的HP检测方法,是非侵入性诊断HP感染的“金标准”[12]。本研究为了避免假阳性,同时用胶乳比浊法检测血清HP抗体水平加以验证。陈文举等[13]采用与本研究相同的试剂和方法检测血清HP抗体,结果显示,胶乳免疫比浊法检测血清HP抗体的敏感性为93.3%,特异性为96.7%,诊断符合率为95.0%,与病理组织嗜银染色法比较,差异无统计学意义(P>0.05)。因此,本研究采用尿素呼气试验和HP抗体联合检测来确定患者是否感染HP,排除二者结果不一致的患者,大大提高了临床诊断HP感染的准确性,且与临床诊疗标准相一致。ROC曲线分析结果显示,将PGⅡ≥15.57 μg/L作为判断HP感染的标准,敏感性为76.79%,特异性为78.13%;将PGR≤9.27作为判断HP感染的标准,敏感性为75.00%,特异性为68.75%;二者联合检测的诊断效能更佳,判断HP感染的AUC为0.829,敏感性为92.86%,特异性为65.63%。本研究结果与KIYOHIRA等[11]的研究结果基本一致,与其他文献报道有一定差异,原因可能与检测方法及试剂不同有关。本研究结果显示,将PGⅡ与PGR联合检测用于排除HP感染,65.63%的特异性提示可使约66% HP非感染者避免内镜检查。
本研究存在一定的局限性:首先,收集的样本量较小,可能会导致结果出现偏差;其次,本研究未结合患者胃镜及病理结果,建立胃蛋白酶原水平判断HP感染的标准需要结合胃镜检查结果;再次,未排除曾经感染过HP但已成功根除且血清抗体消除的患者,有研究结果显示,已成功根除HP的感染者发生胃癌的风险高于从未感染HP者[3]。因此,有必要对患者病史进行仔细询问。
综上所述,血清胃蛋白酶原是评价胃黏膜功能较为简单、客观的方法,也可作为HP感染的标志物,可以避免对无HP感染的胃癌低风险者进行不必要的胃镜检查。
