基于临床常用检验项目的原发性肝细胞肝癌术前微血管侵犯诊断模型研究
2020-09-04黄晨军高致远何羽童许敏凡朱飞飞高春芳
童 林, 黄晨军, 高致远, 周 军, 房 萌,肖 潇, 何羽童, 洪 松, 许敏凡,朱飞飞, 高春芳
(上海东方肝胆外科医院实验诊断科,上海 200438)
据我国最新恶性肿瘤发病和死亡统计分析,我国肝癌年新发病例为37万,发病率居第4位,年死亡病例为32.6万,死亡率居第2位[1]。肝切除与肝移植是目前肝癌主要的治疗方法,但术后复发的风险较高。微血管侵犯(microvascular invasion,MVI)是原发性肝细胞肝癌(hepatocellular carcinoma,HCC)患者的重要组织病理学特征及预后不良的独立危险因素,可增加术后复发风险,导致远期生存率降低[2-3],伴随MVI的HCC患者术后复发风险是无MVI患者的4.4倍[4]。因此,MVI被认为是HCC术后复发和死亡的重要原因[5]。现阶段MVI的诊断主要依靠肝切除术后的病理组织学检查,将全部组织切片内的MVI进行计数,并根据MVI的数量和分布情况进行风险分级。目前尚无可靠的术前诊断MVI的方法,而术前诊断MVI对临床治疗方案选择和改善患者预后具有重要意义[6]。为此,本研究拟基于临床常用检验项目数据建立HCC患者MVI的诊断模型。
1 材料和方法
1.1 研究对象
收集2015年1月—2018年12月上海东方肝胆外科医院接受手术治疗的7 507例HCC患者的临床资料,包括性别、年龄、肿瘤个数、肿瘤大小、Edmondson分级、MVI发生情况及术前48项指标的检测结果。按住院时间,将2015年1月—2017年12月住院的5 602例HCC患者作为训练组,其中男4 764 例(85.0%)、女838例(15.0%),年龄10~85岁;将2018年1—12月住院的1 905例HCC患者作为验证组,其中男1 631例(85.6%)、女274例(14.4%),年龄20~86岁。对所有患者进行Edmondson分级,即根据肿瘤细胞的异型程度对肝癌进行分级。Ⅰ级:癌细胞形态似正常肝细胞;Ⅱ级:癌细胞略异型;Ⅲ级:癌细胞异形明显;Ⅳ级:癌细胞形态变异大。根据2015版原发性肝癌规范化病理诊断指南[7],M0:未发现MVI;M1(低危组):≤5个MVI,且发生于近癌旁肝组织区域(≤1 cm);M2(高危组):>5个MVI,或MVI发生于远癌旁肝组织区域(>1 cm)。训练组中M0 2 956例、M1 1 378例、M2 1 268例;验证组中M0 931例、M1 555例、M2 419例。本研究经上海东方肝胆外科医院伦理委员会批准(批号:EHBHKY2018-1-009),所有对象均知情同意。
1.2 纳入和排除标准
纳入标准:(1)接受手术治疗且术后组织病理诊断为HCC;(2)所有病例基本信息及临床实验室数据均完整。排除标准:(1)合并有其他器官的恶性肿瘤;(2)患严重的感染性疾病、重要脏器疾病;(3)术前接受其他抗肿瘤治疗。
1.3 方法
采用XE2100全自动血液分析仪(日本Sysmex公司)及配套试剂(流式细胞计数法)检测血常规指标[白细胞(white blood cell,WBC)计数、中性粒细胞绝对数(the absolute value of neutrophil,NEUT#)、淋巴细胞绝对数(the absolute value of lymphocyte,LYMPH#)、单核细胞绝对数(the absolute value of monocyte,MONO#)、嗜酸性粒细胞绝对数(the absolute value of eosinophil,EO#)、嗜碱性粒细胞绝对数(the absolute value of basophil,BASO#)、平均红细胞血红蛋白量(mean corpuscular hemoglobin,MCH)、平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)、红细胞(red blood cell,RBC)计数、血红蛋白(hemoglobin,Hb)、血细胞比容(hematocrit,HCT)、血小板(platelet,PLT)计数、中性粒细胞百分比(the percentage of neutrophil,NEUT%)、淋巴细胞百分比(the percentage of lymphocyte,LYMPH%)、单核细胞百分比(the percentage of monocyte,M O N O%)、嗜酸性粒细胞百分比(t h e percentage of eosinophil,EO%)、嗜碱性粒细胞百分比(the percentage of basophil,BASO%)、红细胞分布宽度(red blood cell distribution width,RDW)、血小板分布宽度(platelet distribution width,PDW)、平均红细胞体积(mean corpuscular volume,MCV)、平均血小板体积(mean platelet volume,MPV)、血小板压积(plateletcrit,PCT)]。采用CA7000全自动血凝分析仪(日本Sysmex公司)及配套试剂(凝固法)检测凝血酶原时间(prothrombin time,PT)。总胆红素(total bilirubin,TB)和直接胆红素(direct bilirubin,DBil)采用钒酸氧化法检测,试剂购自日本和光纯药工业株式会社;唾液酸(sialic acid,SA)采用酶法检测,试剂购自浙江东瓯生物技术有限公司;ɑ-L-岩藻糖苷酶(alpha-L-fucosidase,AFU)采用速率法检测,试剂购自上海骏实生物科技有限公司;总蛋白(total protein,TP)采用双缩脲法检测,白蛋白(albumin,Alb)采用溴甲酚绿法检测,丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)采用速率法检测,γ-谷氨酰基转移酶(gammaglutamyltransferase,GGT)采用比色法检测,碱性磷酸酶(alkaline phosphatase,ALP)采用2-氨基-2-甲基-1-丙醇缓冲液法检测,载脂蛋白A(apolipoprotein A,apo A)和载脂蛋白B(apolipoprotein B,apo B)采用免疫比浊法检测,试剂均购自瑞士罗氏公司;以上项目的检测仪器为MODULAR P800全自动生化分析仪(瑞士罗氏公司)。采用Cobas e601全自动免疫分析仪(瑞士罗氏公司)及配套试剂(电化学发光法)检测甲胎蛋白(alpha-fetoprotein,AFP)、糖类抗原199(carbohydrate antigen 199,CA199)、癌胚抗原(carcinoembryonic antigen,CEA)及乙型肝炎病毒(hepatitis B virus,HBV)感染相关标志物[乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、乙型肝炎表面抗体(hepatitis B surface antibody,HBsAb)、乙型肝炎e抗原(hepatitis B e antigen,HBeAg)、乙型肝炎e抗体(hepatitis B e antibody,HBeAb)、乙型肝炎核心抗体(hepatitis B core antibody,HBcAb)]。甲胎蛋白异质体(alpha-fetoprotein heterogeneity,AFP-L3)采用亲和吸附离心法检测,试剂盒购自北京热景生物技术有限公司。采用LUMIPULSE G1200全自动免疫分析仪(日本富士公司)及配套试剂(酶化学发光法)检测异常凝血酶原(des-gamma-carboxy prothrombin,DCP)。HBV DNA采用聚合酶链反应(polymerase chain reaction,PCR)荧光探针法检测,试剂购自上海科华生物技术有限公司,检测仪器为ABI 7500荧光定量PCR仪(美国ABI公司)。
1.4 统计学方法
采用SPSS 25.0软件进行统计分析。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用非参数MannWhitneyU检验。计数资料以率表示,组间比较采用卡方检验或Fisher确切概率法。用单因素Logistic回归分析评估每个变量与MVI的关系,筛选出有意义的变量再进行多因素Logistic回归分析。通过逐步回归分析确定诊断MVI的独立危险因素,构建相应的Logistic回归模型。采用受试者工作特征(receiver operating characteristic,ROC) 曲线确定Logistic回归模型诊断有无MVI的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 训练组与验证组基本临床特征的比较
训练组与验证组之间年龄、Alb、ALT、AST、GGT、ALP、AFU、SA、PT、肿瘤个数、肿瘤大小、MVI比例差异均有统计学意义(P<0.05),其他项目2个组之间差异均无统计学意义(P>0.05)。见表1。

表1 训练组与验证组基本临床特征的比较
2.2 单因素 Logistic回归分析
单因素Logistic回归分析结果显示,年龄[比值比(odds ratio,OR)=0.977,95%可信区间(confidence interval,CI)为0.972~0.982]、PLT(OR=1.001,95%CI为1.001~1.002)、Alb(OR=0.965,95%CI为0.951~0.979)、SA(OR=1.023,95%CI为1.018~1.028)、lgAFP(OR=1.483,95%CI为1.425~1.543)、lgDCP(OR=1.595,95%CI为1.513~1.683)、AFP-L3(OR=1.027,95%CI为1.024~1.031)、AFP-L3(定性)(OR=2.445,95%CI为2.193~2.727)、HBsAg(定性)(OR=1.272,95%CI为1.095~1.477)、HBeAg(定性)(OR=1.265,95%CI为1.117~1.432)等35个指标是MVI发生的危险因素,其他项目与MVI均无关系。见表2。

表2 基于训练组有无MVI的单因素Logistic回归分析
2.3 多因素Logistic回归分析
多因素Logistic回归分析结果显示,年龄(OR=0.981,95%CI为0.976~0.986)、PLT计数(OR=0.998,95%CI为0.997~0.999)、Alb(OR=0.971,95%CI为0.957~0.986)、SA(OR=1.016,95%CI为1.009~1.022)、lgAFP(OR=1.226,95%CI为1.163~1.292)、lgDCP(OR=1.361,95%CI为1.282~1.445)、AFP-L3(OR=1.012,95%CI为1.008~1.016)是MVI发生的危险因素。见表3。
2.4 联合诊断模型的建立及诊断MVI的效能
根据Logistic回归分析结果建立的联合诊断模型PA-SALAD=0.220-0.002×PLT-0.019×年龄+0.0 1 6×S A-0.0 2 9×A l b+0.0 1 2×AFP-L3+0.204×lgAFP+0.308×lgDCP。将M1和M2合并为有MVI,M0为无MVI。
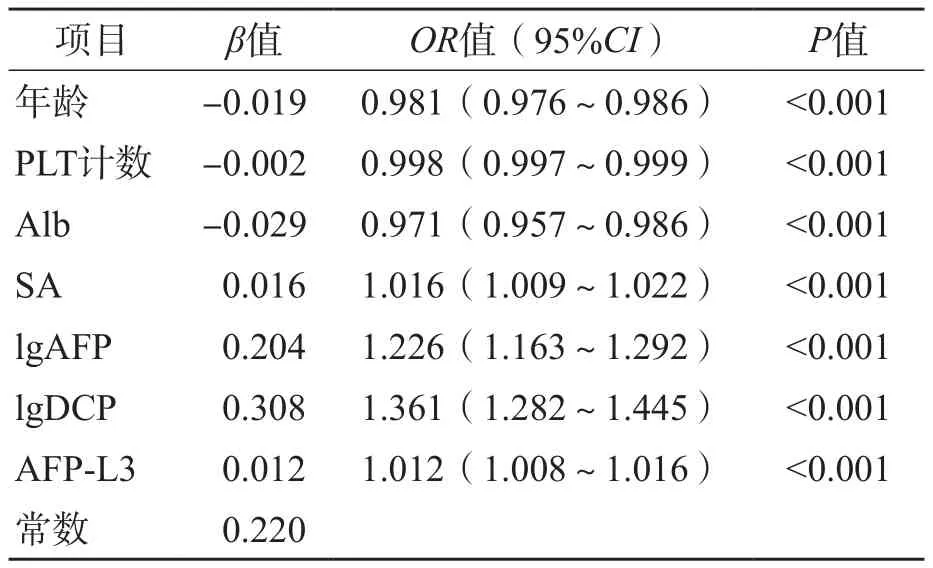
表3 基于训练组有无MVI多因素Logistic回归分析
ROC曲线分析结果显示,在训练组中,PA-SALAD模型诊断有MVI的曲线下面积(area under curve,AUC)为0.695,最佳临界值为-0.235 3,敏感性为69.3%,特异性为60.4%。在验证组中,以训练组的最佳临界值-0.235 3作为临界值,PA-SALAD模型诊断有MVI的AUC为0.704,敏感性为66.5%,特异性为62.0%;区分M0与M1的AUC为0.664,敏感性为60.0%,特异性为62.0%;区分M0与M2的AUC为0.758,敏感性为75.2%,特异性为62.0%;区分M1与M2的AUC为0.613,敏感性为75.2%,特异性为40.0%。见表4、图1。
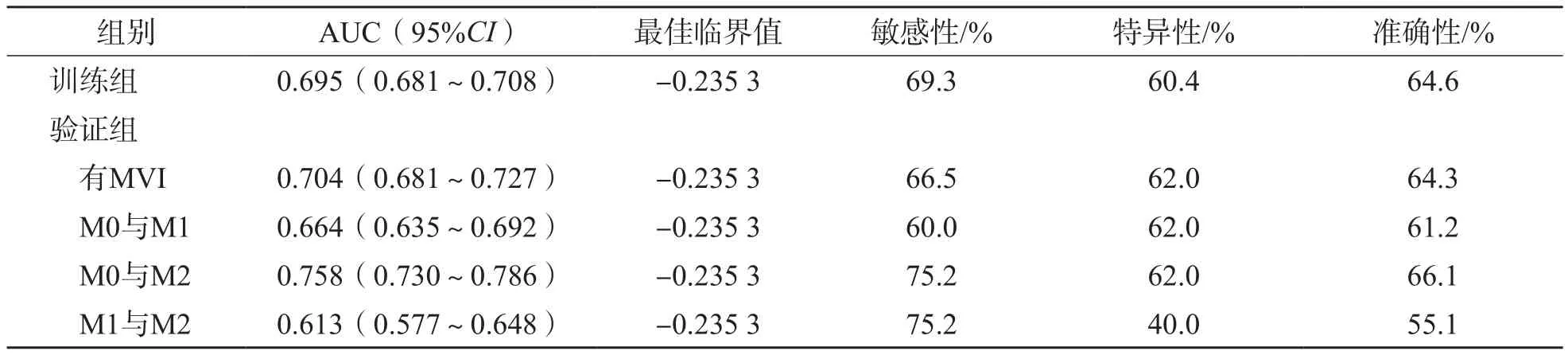
表4 PA-SALAD模型诊断HCC患者术前发生MVI的效能
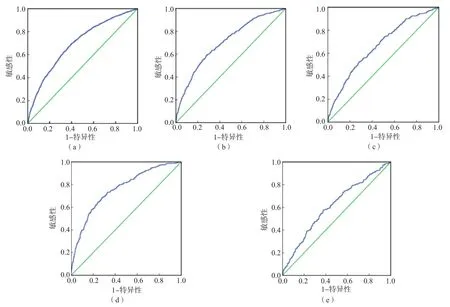
图1 PA-SALAD模型诊断训练组和验证组MVI的ROC曲线
3 讨论
肝切除和肝移植术后通过病理检查证实MVI的发生率为15.0%~57.1%[5]。尽管MVI的发生机制尚未明确,但有研究结果显示,进行肝移植的HCC患者如未发现MVI,其预后会更好[8]。影像学检查[电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)]是HCC患者术前诊断MVI的常用方法,但影像学检查存在许多局限性,如结果受医生经验影响较大、不适合大样本处理、诊断标准难以统一等[9]。
近年来,许多学者尝试使用影像学检查结合实验室指标对MVI进行术前诊断。ZHAO等[10]以AFP>400 μg/L、 GGT>130 U/L、肿瘤总直径>8 cm、肿瘤数目>3个为参数建立预测MVI的评分系统,其特异性接近90%,但该研究纳入的样本量较小。梁志银等[6]以肿瘤最大直径、AFP>200 μg/L、ALP>60 U/L、TB>15 μmol/L为参数建立列线图,对HCC患者发生MVI进行预测,该列线图具有一定的可靠性,但敏感性和特异性均较低。CUCCHETTI等[11]采用人工神经网络建立MVI预测模型,在训练组和验证组中,该模型诊断MVI的AUC均超过0.9,准确性较高,但是该模型的应用需要借助复杂的计算机软件,其推广受到一定的限制。
术前诊断MVI的方法目前临床尚无统一的标准。为此,本研究尝试用临床常用检验项目数据建立模型来判断HCC患者有无MVI。多因素Logistic回归分析结果显示,年龄(OR=0.981,95%CI为0.976~0.986)、PLT(OR=0.998,95%CI为0.997~0.999)、Alb(OR=0.971,95%CI为0.957~0.986)、SA(OR=1.016,95%CI为1.009~1.022)、lgAFP(OR=1.226,95%CI为1.163~1.292)、lgDCP(OR=1.361,95%CI为1.282~1.445)、AFP-L3(OR=1.012,95%CI为1.008~1.016)是MVI发生的危险因素,依此建立联合诊断模型PASALAD。在训练组和验证组中,PA-SALAD模型术前诊断有无MVI(M0与M1+2)的AUC分别为0.695、0.704,敏感性分别为69.3%、66.5%,提示建立的联合诊断模型对判断HCC患者术前是否发生MVI有较好的价值。
日本肝脏学会(Japan Society of Hepatology,JSH)指南推荐使用肿瘤标志物AFP、AFP-L3和DCP三联检的监测程序,对乙型肝炎病毒和丙型肝炎病毒相关慢性肝病患者进行早期HCC筛查[12],肿瘤标志物水平升高可提示HCC的侵袭性风险升高[13]。本研究结果显示,AFP、AFP-L3和DCP水平升高会增加MVI发生的风险。PA-SALAD模型显示高龄HCC患者发生MVI的风险低于低龄患者,与胡月雷等[14]的研究结果[HCC低龄(<60岁)患者MVI发生率明显高于高龄(≥60岁)患者]和SHEN等[15]的研究结果[≤55岁的HCC患者发生MVI的比例明显高于>55岁的患者]一致。本研究结果还显示,PLT计数和Alb水平降低可增加MVI发生的风险,与ZHENG等[16]的研究结果[术前低Alb与MVI发生密切相关]和LEI等[17]的研究结果[较低的PLT水平与早期肝癌MVI发生的可能性增加有关]相符。
SA是细胞膜上糖蛋白、糖脂的重要组成成分。在正常生理过程中,血清SA水平保持相对稳定,当肝细胞发生癌变后,癌基因的高表达使得细胞膜产生大量糖蛋白和糖脂,导致蛋白SA化修饰程度明显增强,SA随肝癌细胞的脱落和分泌进入机体血液循环系统,造成肝癌患者血清SA水平升高,因此SA与肝癌的发生、发展、侵袭密切相关[18]。还有研究结果显示,血清SA与肝硬化的恶性程度呈正相关,随着肝硬化病情的加重,血清SA水平也逐步升高,而肝硬化被认为是MVI发生的独立危险因素[19-20],这与本研究结果一致。
ROC曲线结果显示,以-0.235 3为临界值,PA-SALAD模型区分M0与M2的AUC为0.758,敏感性为75.2%,特异性为62.0%,准确性为66.1%,说明该模型对诊断HCC患者是否发生高危MVI具有较高的价值。PA-SALAD模型区分M0与M1及M1与M2的AUC分别为0.664和0.613,表明该模型对低危MVI的诊断以及区分MVI严重程度的能力有限。
综上所述,本研究基于临床常用指标建立了术前诊断HCC患者是否发生MVI的模型,该模型具有较好的临床应用价值。由于本研究为单中心回顾性分析,因此仍需进行大样本的多中心前瞻性验证,以便为临床诊断HCC患者术前MVI发生提供坚实的循证医学证据。
