循环肿瘤DNA对黑色素瘤诊断价值的Meta分析
2020-09-04万文婷弓孟春史文钊
万文婷, 于 波, 弓孟春, 史文钊, 郭 昊, 杨 杰
(1.神州数码医疗科技股份有限公司科学事务部,北京 100080;2.南华大学附属湘潭医院泌尿外科,湖南 湘潭 411101)
黑色素瘤是由黑色素细胞过度增殖引起的一种极具侵袭性的皮肤肿瘤,多发于皮肤黏膜及肢端,虽然其发病率仅占皮肤肿瘤的10%,但与80%的皮肤肿瘤死亡事件相关[1]。2018年的全球癌症报告表明,黑色素瘤新增病例为287 723例,死亡人数达60 712人[2]。在我国,黑色素瘤Ⅳ期的患者5年生存率<5%[3]。在黑色素瘤初期,首选手术切除,而对于中晚期患者,传统的放化疗等手段起效甚微。针对不能进行手术切除或已经转移并出现BRAFV600E突变的黑色素瘤患者,2011年美国食品与药品监督管理局(U. S. Food and Drug Administration,FDA)批准维莫非尼作为靶向药物对黑色素瘤患者进行治疗,黑色素瘤的治疗跨入靶向治疗时代。基因检测可以指导靶向治疗方案的制定监测疾病进展。
组织活检是临床基因检测的金标准,然而组织活检存在许多不足之处,如穿刺过程风险高、解剖位置不佳、价格高、操作复杂、肿瘤组织自身的异质性等。循环肿瘤DNA(circulating tumor DNA,ctDNA)检测是近年来被用于检测人体内基因突变的新兴方法。ctDNA是肿瘤细胞DNA脱落或凋亡后进入血液循环系统的DNA片段,是一种特殊的肿瘤标志物[4],其具有非侵入性、易获取、可连续取样、可克服肿瘤异质性等优点,可作为组织活检的补充用于临床的诊断和疾病监测。PINZANI等[5]指出,在黑色素瘤患者中,与肿瘤组织的检测结果相比,ctDNA检测的敏感性为72%,特异性为89%,与肿瘤病理检测结果一致性为80%。TANG等[6]的报道显示,在58名黑色素瘤患者中,ctDNA与肿瘤组织的检测结果一致性为70%。HASELMANN等[7]在一项对187名黑色素瘤患者的研究中发现,乳滴数字聚合酶链反应(bead,emulsion,amplification and magnetic,BEAMing)可以提高ctDNA的检测敏感性(86%)和特异性(93%),并且一致性高达90%,提示ctDNA具有较好的诊断价值。由于ctDNA检测的准确率受到检测仪器、样本来源、疾病分期等多种因素的影响,目前对于其临床应用价值仍存在争议。
本研究通过定量Meta分析,评估配对的黑色素瘤组织样本和外周血中ctDNA基因突变检测结果的一致性,为临床应用提供循证依据。
1 材料和方法
1.1 检索策略
通过Medline、Cochrane Library、Excerpta Medica Database(Embase)、中国知网及维普数据库进行文献检索,检索数据收集时间为从建库至2019年1月。语言限定为中文和英文。中文检索词为“黑色素瘤”、“ctDNA”、“循环游离DNA”;英文检索词为“Melanoma”、“circulating tumor DNA”、“circulating cellfree DNA”,并且通过人工检索进行补充。
1.2 文献纳入标准和排除标准
文献纳入标准:(1)入组患者均为确诊的黑色素瘤患者;(2)可获得血液中ctDNA的基因突变检测结果;(3)具有配对的病理组织的基因突变检测结果;(4)文献中有足够的数据可以直接或间接计算得到假阳性(false positivity,FP)、假阴性(false negativity,FN)、真阴性(true negativity,TN)和真阳性(true positivity,TP)的值。文献排除标准:(1)综述、案例报道、评论等文献;(2)没有检测组织或者没有检测血液中的基因突变,或者血液与组织没有一一配对;(3)数据不全;(4)非人体研究;(5)<10人的研究。
1.3 资料提取与质量评价
由2名科研人员分别从事筛选文献、质量评价及数据提取的工作,后期进行汇总和核对。如果遇到意见不一致,提交至第3位研究人员决定。数据提取信息如下:第一作者姓名、文献发表年份、国家、TNM分期、是否转移、样本量、组织样本的类型、血液样本类型、血液中基因突变的检测方法及突变基因位点,结果指标包括TP、FP、FN、TN的值和检测敏感性、特异性、结果的一致性。用诊断准确性研究质量评价标准-2(QUADAS-2)量表对入组文献进行质量评估。QUADAS-2量表主要由4个部分组成:病例的选择、待评价试验、金标准、病例流程和进展情况。测评所有组成部分的偏移风险,同时测评前3部分临床适用性。基于每部分纳入的相关标志性问题作出“是”、“否”或“不确定”的判断,可对应将偏移风险等级确定为“低”、“高”或“不确定”。在偏移风险判断上纳入与偏移潜在性有关的标志性问题,旨在帮助评价者判断偏移风险,但临床适用性的判断未纳入标志性问题[8]。
1.4 统计学方法
通过Spearman相关系数检查有无阈值效应引起的异质性。非阈值效应的异质性以I2和Q检验为指标,当I2>50%或P<0.05时,表明异质性显著,选用随机效应模型计算;当I2<50%或P>0.05时,表明异质性不显著,则选用固定效应模型计算。通过Stata 15.0软件,基于FP、FN、TN和TP的值,计算敏感性、特异性、综合受试者工作曲线的曲线下面积(area under curve,AUC)、合并阳性似然比(positive likelihood ratio,PLR)、合并阴性似然比(negative likelihood ratio,NLR)、合并诊断优势比(diagnostic odds ratio,DOR)以及相应的95%可信区间(confidence interval,CI)。使用Deeks'漏斗图分析是否存在发表偏移,当P<0.10时表明存在发表偏移。
2 结果
2.1 文献检索
基于5个数据库的检索结果,共收集到英文文献408篇,中文文献36篇,剔除重复文献40篇,经过阅读文献标题及摘要内容后初筛排除文献337篇。后续通过仔细阅读全文进行进一步筛查,共计排除文献57篇,其中包括没有组织检测结果的文献20篇,结局数据不全的文献21篇,研究对象<10人的文献5篇,非人体研究文献1篇,非黑色素瘤相关研究文献2篇,组织样本与血液样本无法配对的研究文献2篇,综述4篇,案例报道1篇和回复信1篇。最终有10篇文献符合入组标准(图1)。

图1 文献筛选流程图
2.2 纳入文献基本特征
符合入组标准的10篇文献中,有4篇来自欧洲,6篇来自北美洲,文献对象包括1 360例;文献多发表于近5年(6/10);研究对象主要以Ⅲ~Ⅳ期的患者为主(9/10);ctDNA的检测方法主要有等位特异聚合酶链反应(allele-specific polymerase chain reaction,allelespecific PCR)、扩增阻滞突变系统聚合酶链反应(amplification refractory mutation system polymerase chain reaction,ARMS-PCR)和BEAMing等。见表1。
2.3 文献质量评估与发表偏移
根据QUADAS-2的标准,我们从4个方面对每项研究的方法学质量进行评估(图2)。在待评价试验中,有6项研究未提到使用盲法进行测试,另外3项研究是在知道组织检测结果下进行的研究,因此均存在未知或较大的风险偏移。由于并非所有患者都被纳入,或待评价研究与金标准之间存在不恰当的时间间隔,因此有8项研究的病例流程和进展情况的偏移风险未知或较高。在所有的研究中,适用性都很高。Deeks'漏斗图显示,文献存在发表偏移(P=0.03),见图3。
2.4 异质性检验
在诊断试验中,引起异质性的原因之一就是阈值效应。本研究的Spearman相关系数为-0.267,P=0.455,提示各项研究间不存在由阈值效应引起的异质性。Q检验和I2检验结果表明,本研究不存在异质性(合并效应量I2值为0,Q值为1.480,P=0.239)(表2)。因此我们选用固定效应模型进行分析。
2.5 合并诊断效能
如图4所示,10项研究的合并敏感性为0.71(95%CI为0.63~0.79),合并特异性为0.94(95%CI为0.91~0.96),提示阴性结果的检出率高;合并AUC为0.94(95%CI为0.92~0.96),说明ctDNA诊断具有较高的准确率(图5)。DOR值为37(95%CI为19~71),提示ctDNA具有较好的诊断效能。此外,PLR为11.3(95%CI为7.2~17.5),NLR为0.31(95%CI为0.23~0.41)。
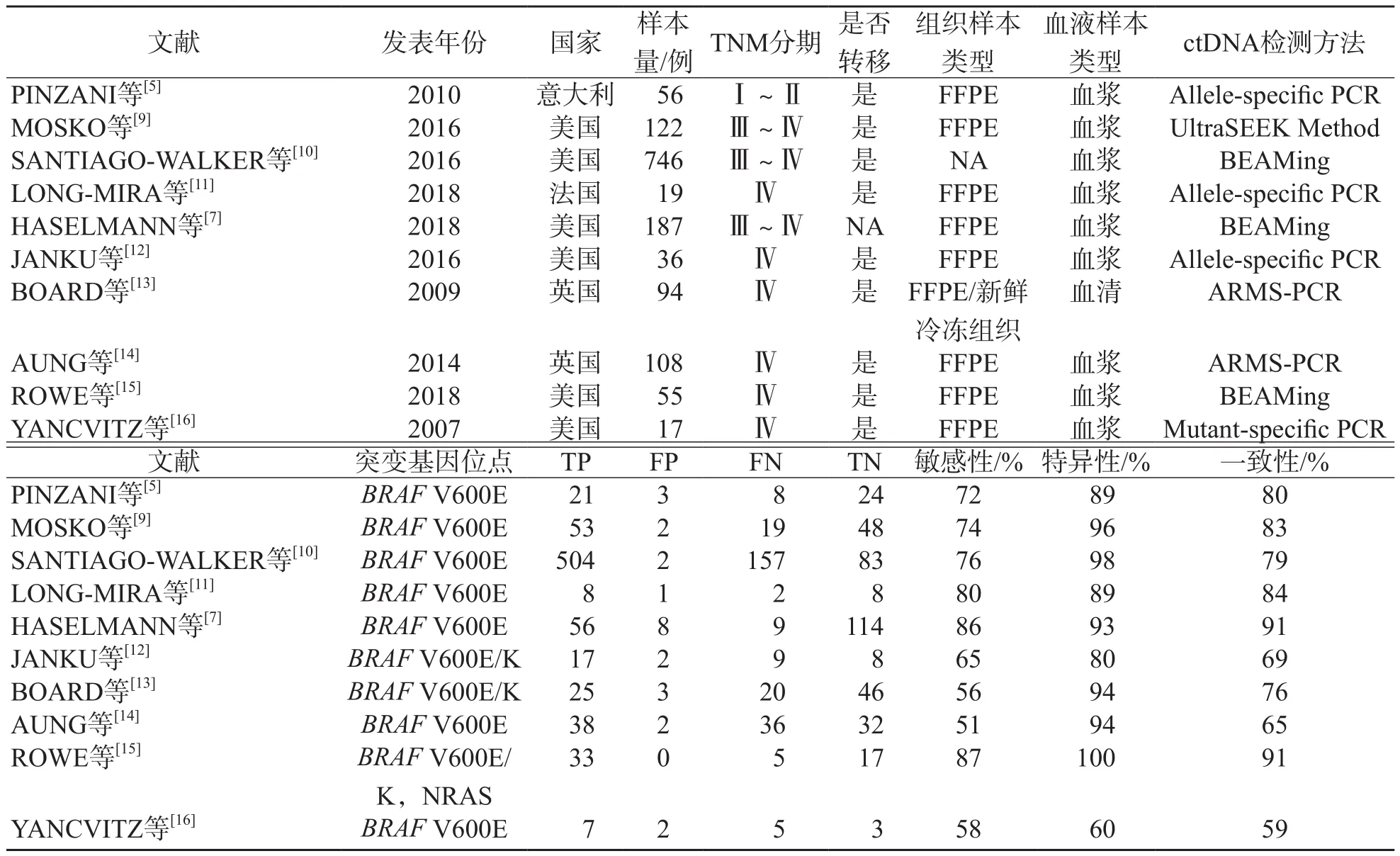
表1 入组文献的基本特征
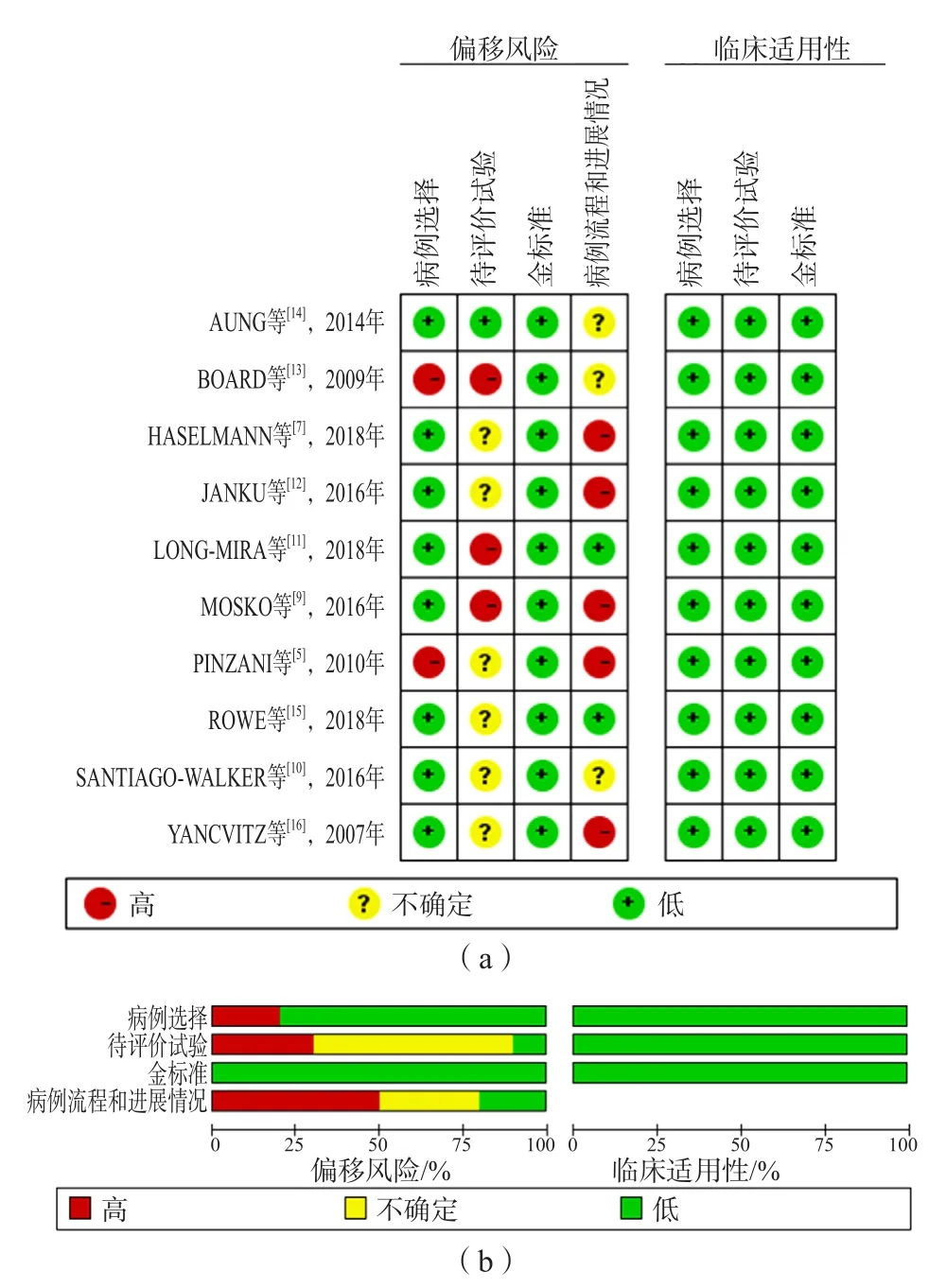
图2 文献质量评价图

图3 Deeks'漏斗图
2.6 特征分析
根据疾病的TNM分期、ctDNA检测的方法、检测基因、研究对象例数等特征进行分析(表2)。来自北美洲的研究合并敏感性为0.76(95%CI为0.69~0.81),合并特异性为0.94(95%CI为0.85~0.98),合并AUC为0.81(95%CI为0.78~0.85),合并DOR为47(95%CI为14~152),合并PLR为12.2(95%CI为4.7~32.1),合并NLR为0.26(95%CI为0.19~0.35),合并后异质性I2=0;来自欧洲的研究合并敏感性为0.60(95%CI为0.48~0.71),合并特异性为0.92(95%CI为0.85~0.96),合并AUC为0.90(95%CI为0.87~0.92),合并DOR为18(95%CI为8~40),合并PLR为7.8(95%CI为4.1~15.0),合并NLR为0.43(95%CI为0.32~0.58),合并后异质性I2=0。相较于来自北美洲的研究,来自欧洲的研究具有更高的AUC,而敏感性、特异性、DOR、PLR值更低。检测方法不同对结果也有影响,在ARMS-PCR方法组中,合并敏感性为0.61(95%CI为0.51~0.71),合并特异性为0.91(95%CI为0.84~0.95),合并AUC为0.87(95%CI为0.84~0.90),合并DOR为16(95%CI为8~33),合并PLR为6.9(95%CI为3.8~12.6),合并NLR为0.43(95%CI为0.33~0.55),合并后异质性I2=0。另外,人群样本量大小对结果有影响,在研究对象≤100人的研究中,合并后异质性I2=0,合并敏感性为0.70(95%CI为0.58~0.80),合并特异性为0.91(95%CI为0.82~0.96),合并AUC为0.90(95%CI为0.87~0.92),合并DOR为23(95%CI为8~66),合并PLR为7.7(95%CI为3.5~16.8),合并NLR为0.33(95%CI为0.22~0.49);在研究对象>100人的研究中,合并后异质性I2=39,合并敏感性为0.73(95%CI为0.60~0.83),合并特异性为0.95(95%CI为0.92~0.98),合并AUC为0.96(95%CI为0.94~0.97),合并DOR为58(95%CI为26~130),合并PLR为16.1(95%CI为8.8~29.4),合并NLR为0.28(95%CI为0.18~0.43)。
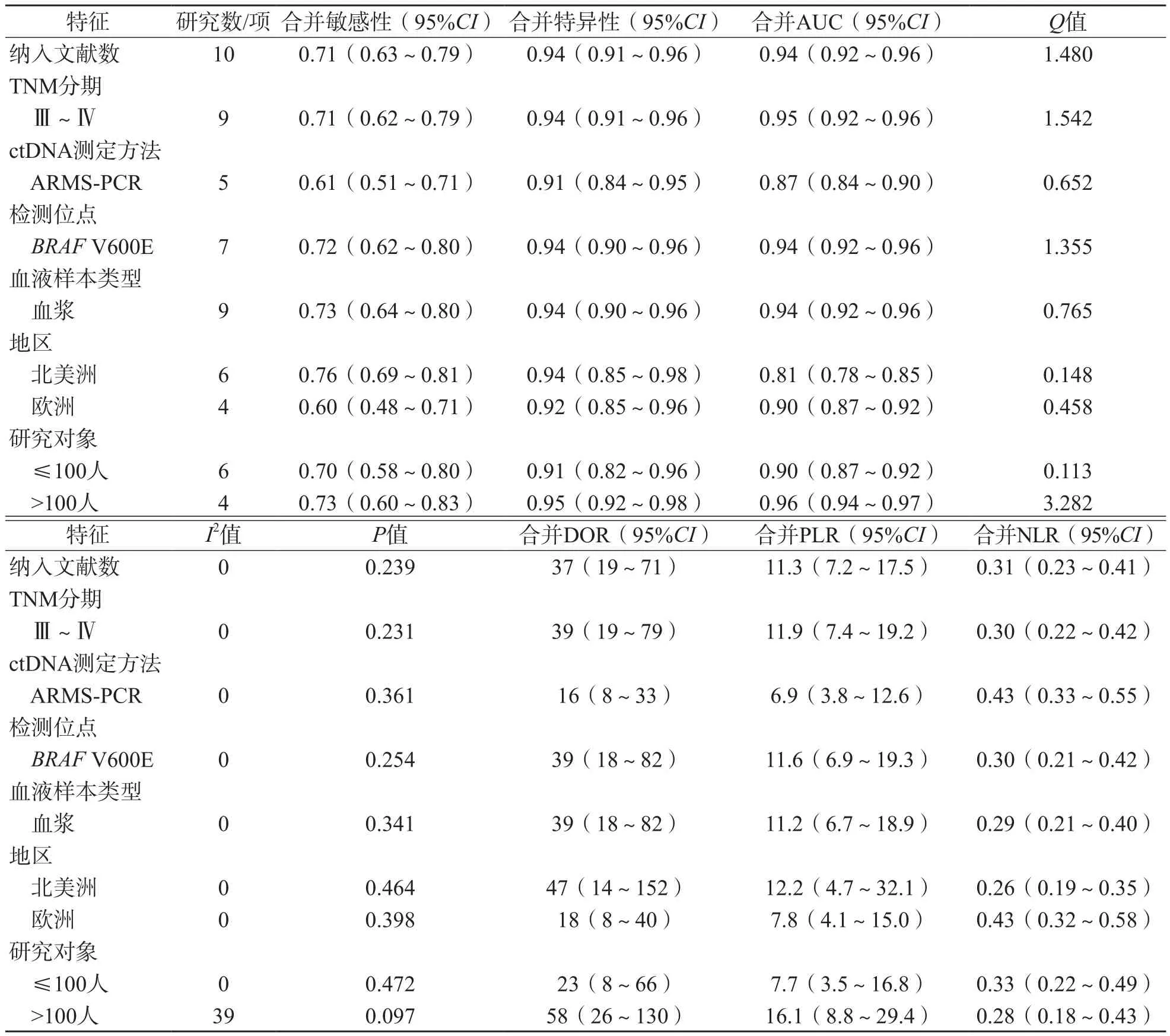
表2 ctDNA在黑色素瘤中诊断价值的特征分析
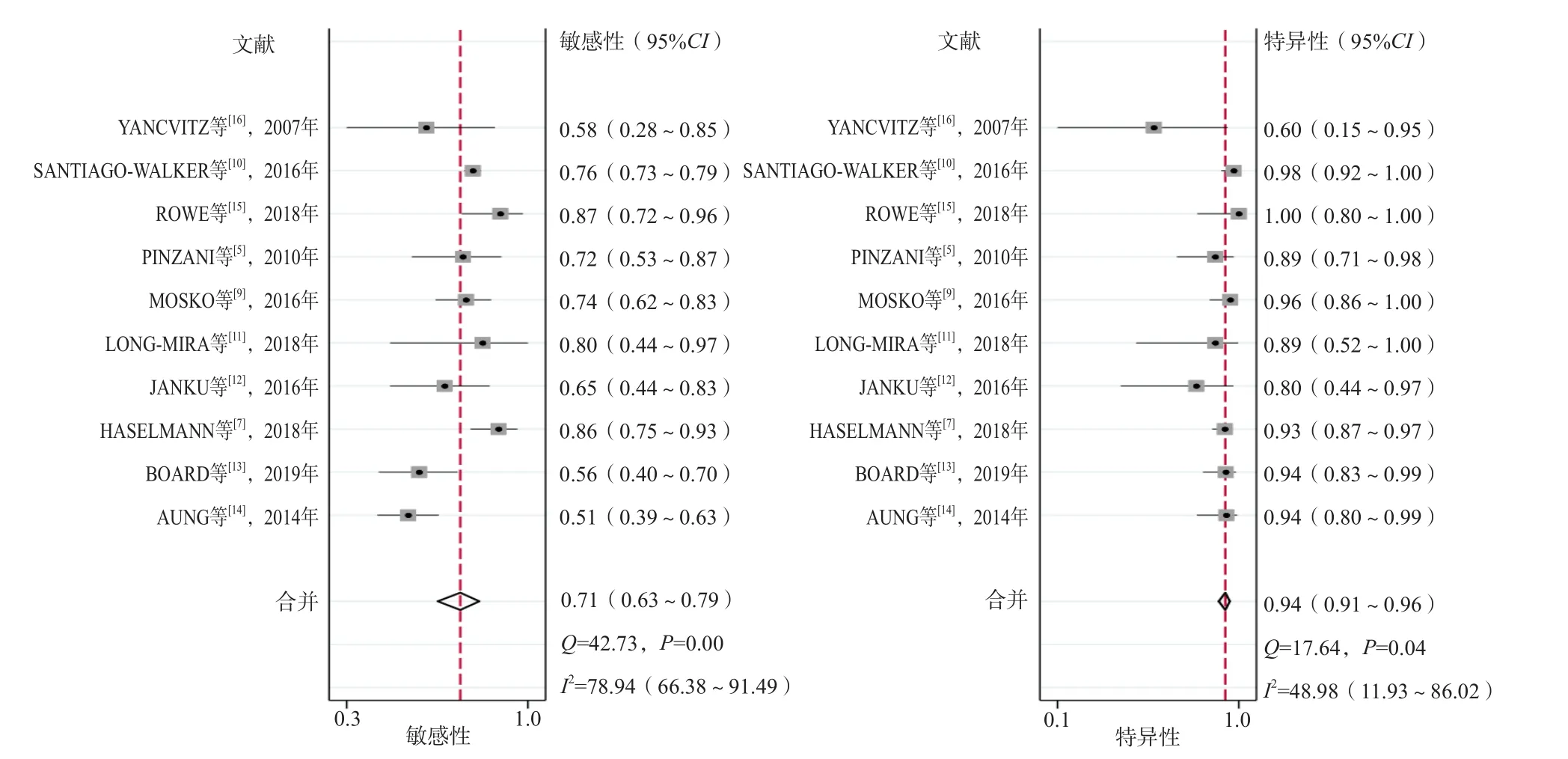
图4 敏感性和特异性森林图

图5 ctDNA在黑色素瘤中的综合受试者工作特征曲线
2.7 敏感性分析
为了解研究结果的可靠性,分别逐一排除单项研究,对其余研究进行合并分析,发现结果可靠。
3 讨论
本研究对10篇符合纳入标准的文献进行Meta分析,研究对象共涉及1 360例。Q检验和I2检验结果表明,合并效应量I2值为0,Q值为1.480,P=0.239,不存在异质性。ctDNA检测的合并敏感性为0.71(95%CI为0.63~0.79),合并特异性为0.94(95%CI为0.91~0.96),合并AUC为0.94(95%CI为0.92~0.96),其中AUC是一个综合性指标,值越接近1说明诊断价值越高。合并PLR为11.3,表明黑色素瘤患者中ctDNA检测出真阳性的概率约是假阳性的11倍。合并NLR为0.31,说明在ctDNA的阴性结果中,可能存在31%的假阴性。DOR是实验组中阳性结果与对照组中阳性结果的比值,能够较好地反映出诊断试验的“鉴别”能力,DOR值与其鉴别能力呈正相关[17]。合并DOR为37,提示ctDNA检测有较高的综合诊断效能。
本研究分析了影响ctDNA检测准确度的因素。BOARD等[13]指出ctDNA水平与肿瘤分期高度相关,ctDNA突变具有肿瘤分期依赖性,一般早期检测的准确率较低。相较于Ⅰ期患者,Ⅳ期患者的ctDNA更高水平[18],并且ctDNA水平与肿瘤的转移有关[19]。此外,肿瘤的异质性可能致使ctDNA和相应的肿瘤组织基因突变检测结果不一致。肿瘤异质性来自3个方面:肿瘤内、肿瘤间和时间异质性。组织仅代表所取肿瘤组织部位的突变信息,而ctDNA则代表全部肿瘤组织的突变信息[20]。血液样本的前期处理方式和检测方法也会影响检测结果。目前,不同提取试剂盒的ctDNA提取效率差别很大,并且不同提取方法之间无统一的质量判断标准。敏感性和特异性是评估检测平台准确率高低的2个重要指标。根据报道,各种仪器的检测敏感性不同,二代测序、ARMS-PCR、微滴度聚合酶链反应(droplet digital polymerase chain reaction,ddPCR)和BEAMing的检测限分别为0.1%~1.0%、0.05%~0.10%、0.001%和0.010%[21-23]。血液中ctDNA水平极低,并且存在正常细胞的DNA干扰,如何有效提取和准确检测ctDNA是目前亟待解决的问题。
本研究尚存在以下不足:因ctDNA对黑色素瘤诊断一致性方面的研究较少,故入组文献较少,文献质量不一,未来仍需纳入更多质量较高的研究,并进一步扩大样本量,对可能产生的异质性因素继续研究;纳入的10项研究存在发表偏移,可能是由检索的数据库有限,纳入文献不全导致;纳入的文献以评估ctDNA与组织活检结果的一致性为评价指标,存在作者偏向于发表阳性结果的可能性;入组文献纳入的病例数少,会导致统计结果的准确度受到影响。
基于目前的研究数据我们发现,在黑色素瘤患者中,ctDNA与配对的肿瘤组织之间的诊断结果一致性较高。ctDNA具有低创伤、便于动态监测、操作简便等优点,有望成为黑色素瘤基因突变诊断的辅助方法。希望今后能有更多高质量的研究数据,为ctDNA黑色素瘤基因检测的临床应用提供循证医学依据。
