腹腔镜与开腹肝切除术治疗肝血管瘤的疗效分析:倾向性评分匹配研究
2020-09-04尹毅锐翁佳雷邱双健
尹毅锐 翁佳雷 邱双健 任 宁 易 勇
(复旦大学附属中山医院肝外科 上海 200032)
肝血管瘤是最常见的肝脏良性肿瘤,其中以海绵状血管瘤最多见,占肝脏所有良性肿瘤的73%[1]。尸检结果表明,肝海绵状血管瘤在人群中患病率为0.4%~7.3%[2],且有明显的性别倾向(男女比例为1∶5)[3]。肝血管瘤的发病机制尚未完全理解,目前认为是胚胎发育阶段血管异常增生形成的血管畸形[4]。
肝血管瘤的治疗原则上以随访观察为主,但伴有明显症状或严重并发症时应积极干预。对具有手术指征的患者,以血管瘤剥离术或肝切除术为治疗肝血管瘤的首要选择[5]。目前,腹腔镜技术在手术治疗肝血管瘤中的应用日益增加,且已有回顾性研究报道,其相比于开腹手术具有创伤小、疗效相近而术后并发症少等优点[6-8]。但腹腔镜手术也存在肿瘤位置限制、肝实质横断技术未标准化、术中出血难以控制等问题[5]。另外,和开腹手术相比,腹腔镜手术在特定肝段或特定大小的血管瘤中是否具有明显的治疗优势尚无定论。因此,本研究旨在深入探讨和对比腹腔镜与开腹肝切除术在肝血管瘤治疗中的有效性及安全性,以助于正确、全面地把握腹腔镜技术在肝血管瘤中的应用指征。
资料和方法
一般资料选取2015 年5 月至2019 年9 月在复旦大学附属中山医院接受手术治疗的肝血管瘤患者共119 例,其中接受腹腔镜手术的患者共66 例,接受开腹手术的患者共53 例。腹腔镜和开腹手术由同一团队的肝外科医生操作,并在综合考虑疾病情况和患者意愿的基础上确定手术方式。所有患者术前均签署知情同意书。本研究得到中山医院临床研究伦理委员会的批准(批文号:Y2018-155)。
纳入标准和排除标准纳入标准:患者均经术前影像学检查及术后病理确诊为肝血管瘤;符合肝血管瘤手术治疗适应证;Child-pugh 肝功能分级为A 级;相关临床资料完整可查。
排除标准:合并严重肝硬化等肝脏疾病或Child-pugh 肝功能分级为C 级;合并严重心、肺、肾等器官功能障碍;合并肝脏或其他脏器恶性肿瘤;腹腔镜手术中转开腹手术的肝血管瘤患者。
倾向性评分匹配倾向性评分匹配(propensity score matching,PSM)分析因其能够使非随机对照研究或观察性研究中干预或患者的选择偏倚最小化而得到广泛应用[7]。在本研究中,将两组患者间不均衡的观察资料作为协变量,包括年龄、性别、腹部手术史、合并症、肿瘤最大直径、数量及位置、实验室指标以及切除范围,纳入到PSM 模型中,通过Logistic 回归计算相应的倾向性评分,然后利用最小毗邻法对两组倾向性评分相近的个体进行1∶1 匹配。PSM 分析通过R 3.6.1 软件MatchIt 包实现。
手术方法腹腔镜组患者予以全身麻醉后取平卧剪刀位(左叶病灶)或右侧抬高45°卧位(右叶病灶),术野皮肤常规消毒铺巾,于脐上正中1 cm 处作12 mm 观察孔,置入Trocar,建立人工气腹,维持腹压在15 mmHg 左右。采用经典四孔法,根据肿瘤位置直视下分别于腹部相应部位置入5 mm 和12 mm Trocar。Storz 高清镜头全面探查肿瘤位置及与相邻血管关系,必要时予超声协助定位。游离解剖肝周韧带,充分暴露第一肝门后预置阻断带(图1A)。沿肿瘤外缘0.5~1 cm 处于肝表面做预切线,应用超声刀沿切线由浅入深分离肝组织,联合电凝止血,断面较大管道予hemolok 或钛夹夹闭后离断(图1B)。必要时采用直线型切割吻合器强生EC60A闭断肿瘤所属门静脉分支及肝静脉后,将肿瘤及肝段完整切除(图1C)。冲洗,确认断面无胆漏或活动性出血后覆盖止血纱布(图1D)。瘤体置于标本袋中,扩大穿刺孔后取出,常规放置腹腔引流管。
开腹组麻醉成功后,患者取右侧抬高卧位,术野皮肤常规消毒铺巾,沿右侧肋缘下方做一约20~30 cm 弧形切口,逐层切开进腹。离断肝周韧带,充分暴露第一肝门及肿瘤所在肝叶。沿肿瘤外缘0.5~1 cm 标记预切线,两侧缝扎牵引线,应用超声刀及血管钳沿切线分离肝组织,必要时可预先阻断肝门。断面管道均予切断结扎,必要时缝扎,逐渐深入直至将肿瘤及相应肝组织完整切除。缝扎断面出血点,冲洗,确认无胆漏或活动性出血后予大针粗线及肝缝线缝扎关闭或覆盖止血纱布及生物蛋白胶,放置引流管后逐层缝合关腹。
两组患者术后常规予以预防感染、补液、营养支持等治疗,密切观察其生命体征及腹腔引流等情况。
观察指标详细记录并比较两组患者的手术情况(术中失血量、术中输血率、肝门阻断率、肝门阻断时间)、术后情况(术后引流量,术后第1、3、5 天实验室指标,并发症)、住院时间和住院费用。实验室指标包括总胆红素、直接胆红素、白蛋白、谷丙转氨酶、谷草转氨酶、C 反应蛋白、降钙素原、血红蛋白、白细胞计数、中性粒细胞比例和凝血酶原时间;胸腔积液和腹腔积液等通过影像学检查评估。
统计学方法采用IBM SPSS Statistics 22.0 软件进行数据统计分析。计量资料用x±s 表示,计数资料用例数及百分比表示。计量资料组间差异比较采用Student’s t 检验,计数资料组间差异比较采用χ2检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
结 果
基本资料匹配共119 例符合标准的患者纳入本研究,其中腹腔镜组66 例,开腹组53 例。在未进行PSM 前,两组在年龄(P=0.005)、肿瘤数量(P=0.009)和肿瘤位置(P=0.003)方面存在显著差异。经PSM 后,腹腔镜组共有45 例患者与开腹组进行匹配且基本资料较均衡,具有临床可比性(仅白细胞计数和中心粒细胞比例有统计学差异,但均处于正常范围)(表1)。
观察指标比较腹腔镜组患者术中,失血量、术中输血率、术中肝门阻断率、术后引流量、并发症、住院时间与开腹组相比差异无统计学意义。但腹腔镜组肝门阻断时间显著长于开腹组[(26.1±11.5)min vs.(15.0±10.0)min,P<0.001],住院费用显著高于开腹组[(44 934.6±7 328.6)元vs.(36 212.4±7 247.4)元,P<0.001](表2)。
两组患者术后总胆红素水平、血红蛋白、凝血酶原时间无明显差异。在肝功能指标中,腹腔镜组患者术后白蛋白水平始终较高,术后第1 天谷丙转氨酶和谷草转氨酶水平及术后第3、5 天直接胆红素水平均显著低于开腹组;在炎症相关指标中,腹腔镜组患者术后C 反应蛋白水平始终较低,术后第1、3 天白细胞计数和术后第3、5 天中性粒细胞比例、降钙素原水平均低于开腹组,差异有统计学意义(表3)。
表1 PSM 前后腹腔镜组和开腹组患者基本资料比较Tab 1 Baseline information of laparoscopic group and open group before and after PSM [±s or n(%)]
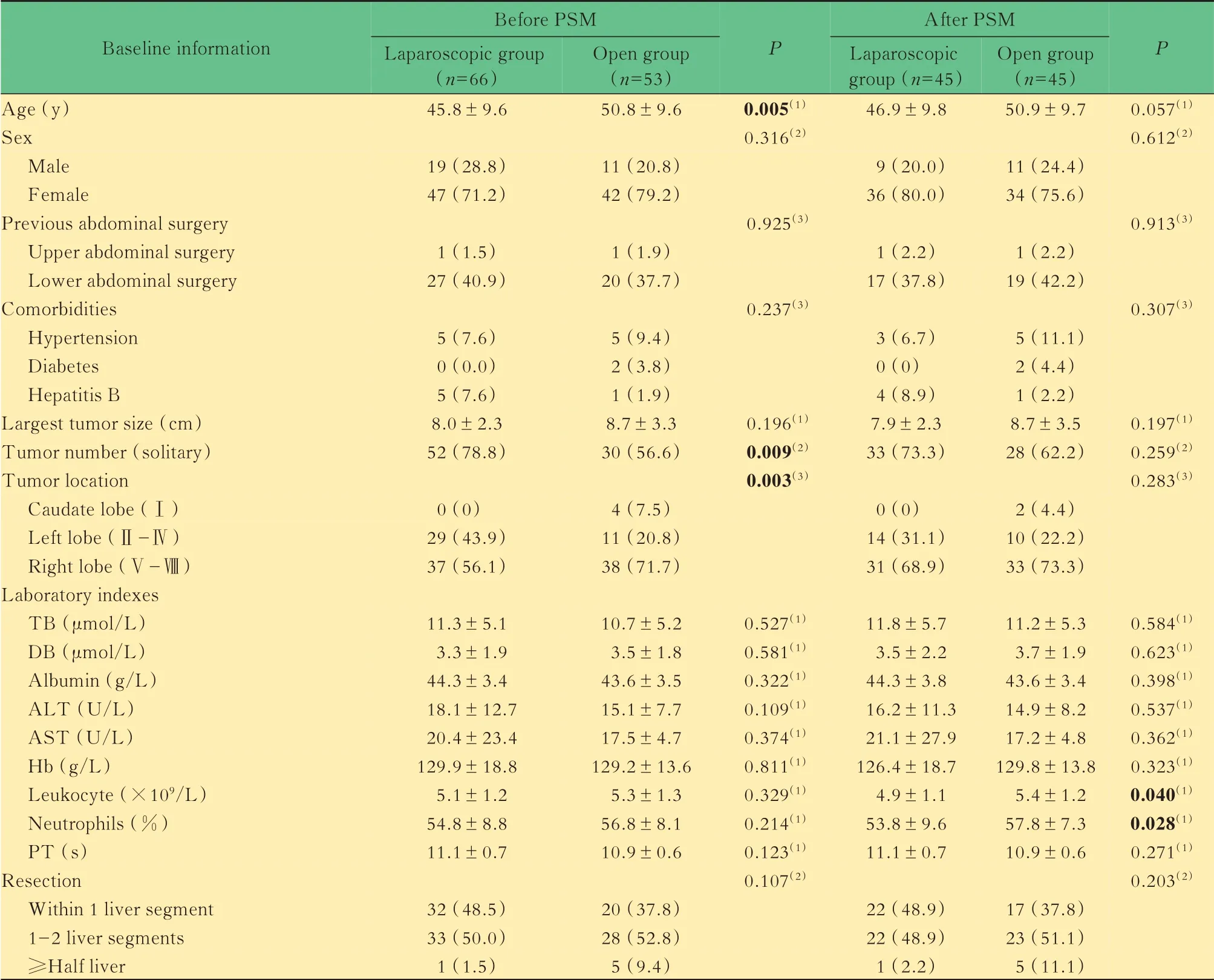
表1 PSM 前后腹腔镜组和开腹组患者基本资料比较Tab 1 Baseline information of laparoscopic group and open group before and after PSM [±s or n(%)]
(1)Student’s t test.(2)Pearson χ2 test.(3)Fisher’s exact test.TB:Total bilirubin;DB:Direct bilirubin;ALT:Alanine aminotransferase;AST:Aspartate aminotransferase;Hb:Hemoglobin;PT:Prothrombin time;PSM:Propensity score matching.
?
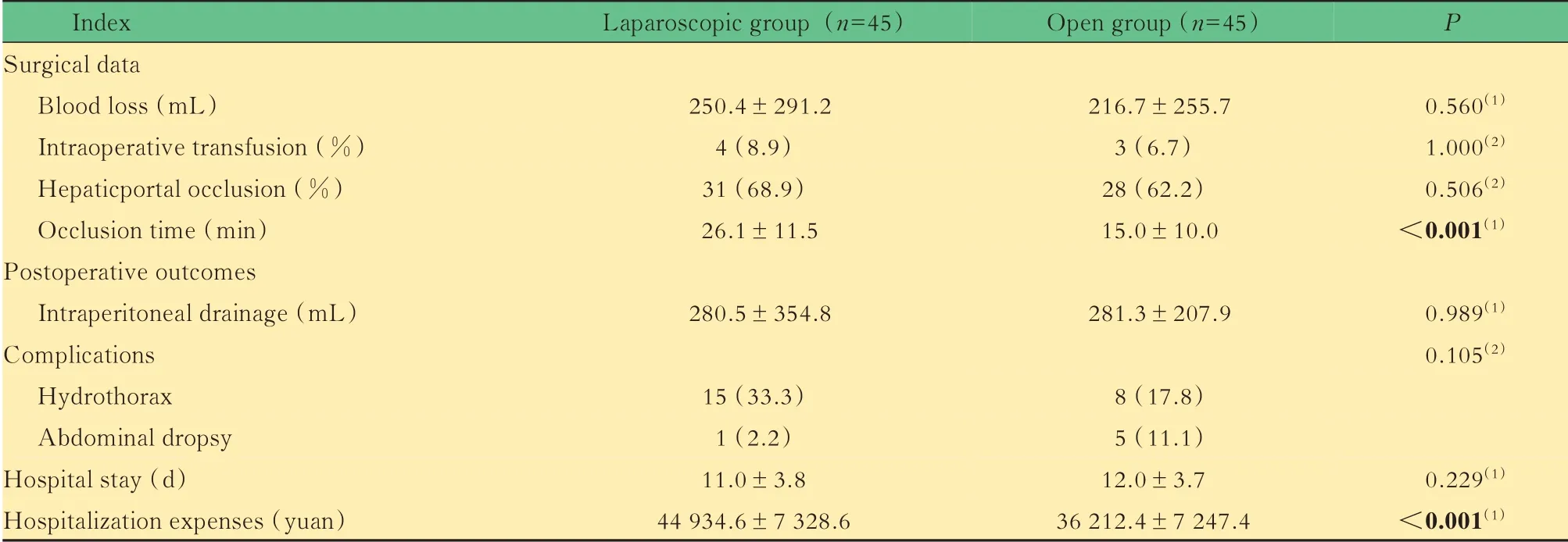
表2 腹腔镜组和开腹组患者疗效及术后恢复比较Tab 2 Comparison of efficacy and postoperative recovery between laparoscopic group and open group [x±s or n(%)]
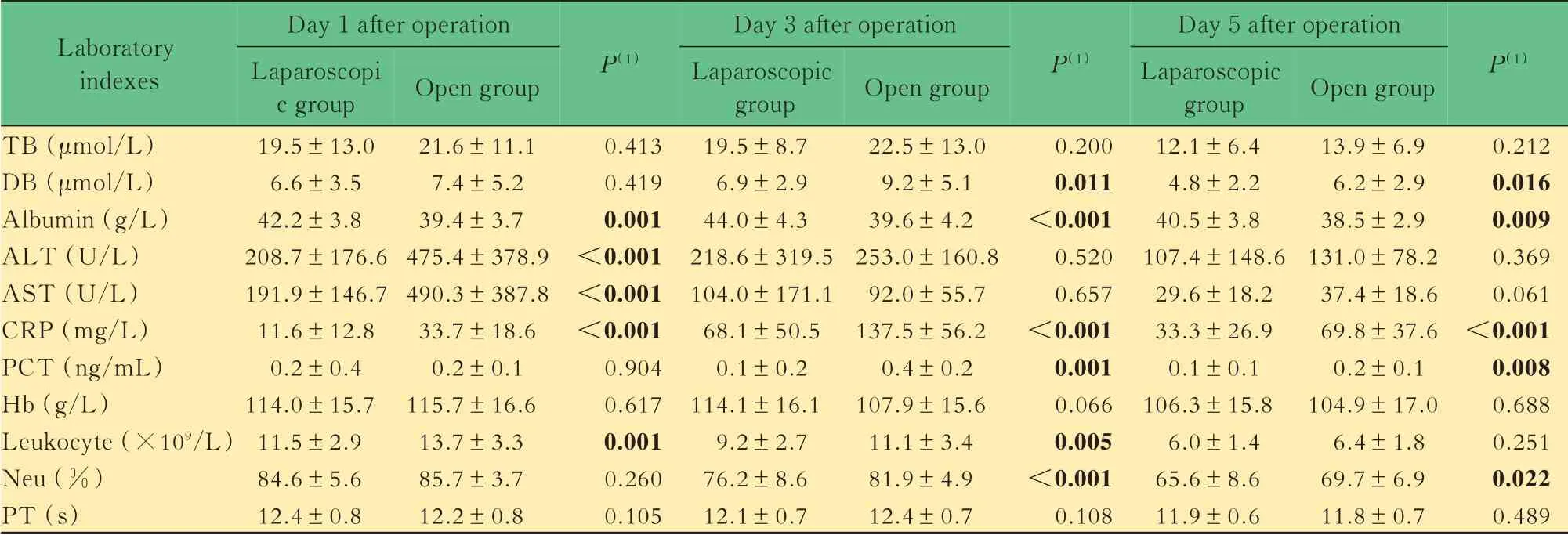
表3 腹腔镜组和开腹组患者实验室指标比较Tab 3 Comparison of laboratory indexes between laparoscopic group and open group (x±s)
特定肝段或特定肿瘤大小的两组患者基本资料比较在119 例研究对象中,共有51 例肝血管瘤患者肿瘤完全或部分位于特定肝段(Ⅰ、Ⅶ和Ⅷ段),其中腹腔镜组19 例、开腹组32 例,两组患者基本资料具有可比性(除肿瘤数量差异有统计学意义);共有38 例患者肿瘤最大直径≥10.0 cm,属于巨大肝血管瘤,其中腹腔镜组18 例、开腹组20 例,两组患者基本资料具有可比性(除肿瘤数量和凝血酶原时间差异有统计学意义)(表4)。
特定肝段或特定肿瘤大小的两组患者观察指标比较在特定肝段或特定肿瘤大小的肝血管瘤患者中,腹腔镜组患者术中失血量、术中输血率、术中肝门阻断率、术后引流量、并发症、住院时间与开腹组相比差异均无统计学意义。腹腔镜组肝门阻断 时 间 显 著 长 于 开 腹 组[(30.8±10.3)min vs.(16.1±10.5)min,P<0.001;(34.5±9.1)min vs.(16.8±11.2)min,P<0.001],住院费用显著高于开腹组[(47 098.0±7 536.2)元vs.(37 049.2±6 509.6)元,P<0.001;(47 787.9±6 537.8)元vs.(37 246.8±6 912.3)元,P<0.001](表5)。
特定肝段的两组患者术后总胆红素水平、谷丙转氨酶、降钙素原、白细胞计数、中性粒细胞比例差异均无统计学意义。在肝功能指标中,腹腔镜组患者术后白蛋白水平始终高于开腹组,术后第1 天谷草转氨酶水平和术后第5 天直接胆红素水平显著低于开腹组;在炎症相关指标中,腹腔镜组术后第1、3天C 反应蛋白水平低于开腹组。另外,腹腔镜组患者术后第3 天血红蛋白高于开腹组。腹腔镜组患者术后第1 天凝血酶原时间高于开腹组(表6)。
特定肿瘤大小的两组患者术后总胆红素水平、降钙素原、血红蛋白差异无统计学意义。在肝功能指标中,腹腔镜组患者术后第1、3 天白蛋白水平显著高于开腹组、术后第1 天谷丙转氨酶和谷草转氨酶水平以及术后第3、5 天直接胆红素水平均显著低于开腹组;在炎症相关指标中,腹腔镜组患者C 反应蛋白水平始终低于开腹组,术后第3 天白细胞计数及术后第3、5 天中性粒细胞比例均低于开腹组。腹腔镜组患者术后第1 天凝血酶原时间高于开腹组(表7)。
讨 论
肝血管瘤作为最常见的肝脏良性肿瘤,其发病机制和生长模式尚未完全明确。对于伴有明显症状或严重并发症的患者,手术切除是目前公认的最为确切的治疗方法[4]。随着腹腔镜技术的发展,腹腔镜下肝血管瘤切除手术的开展日益增加,但其相比于开腹手术的疗效优势缺乏充分的随机对照试验证据支持。同时,目前对腹腔镜手术在特定肝段或巨大肝血管瘤中的适用性报道较少。
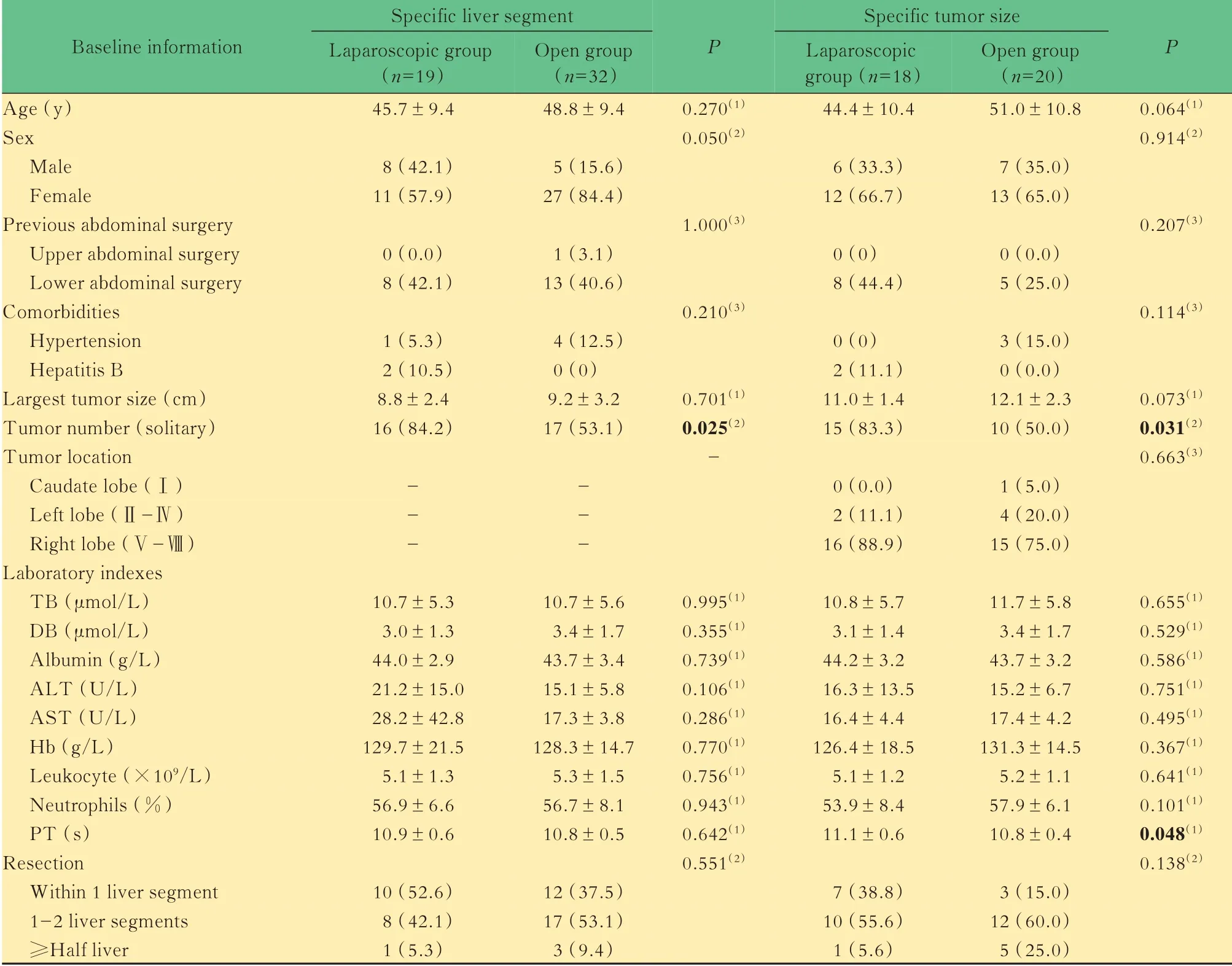
表4 特定肝段或特定肿瘤大小的两组患者基本资料比较Tab 4 Baseline information of the two groups with specific liver segment or tumor size [x±s or n(%)]
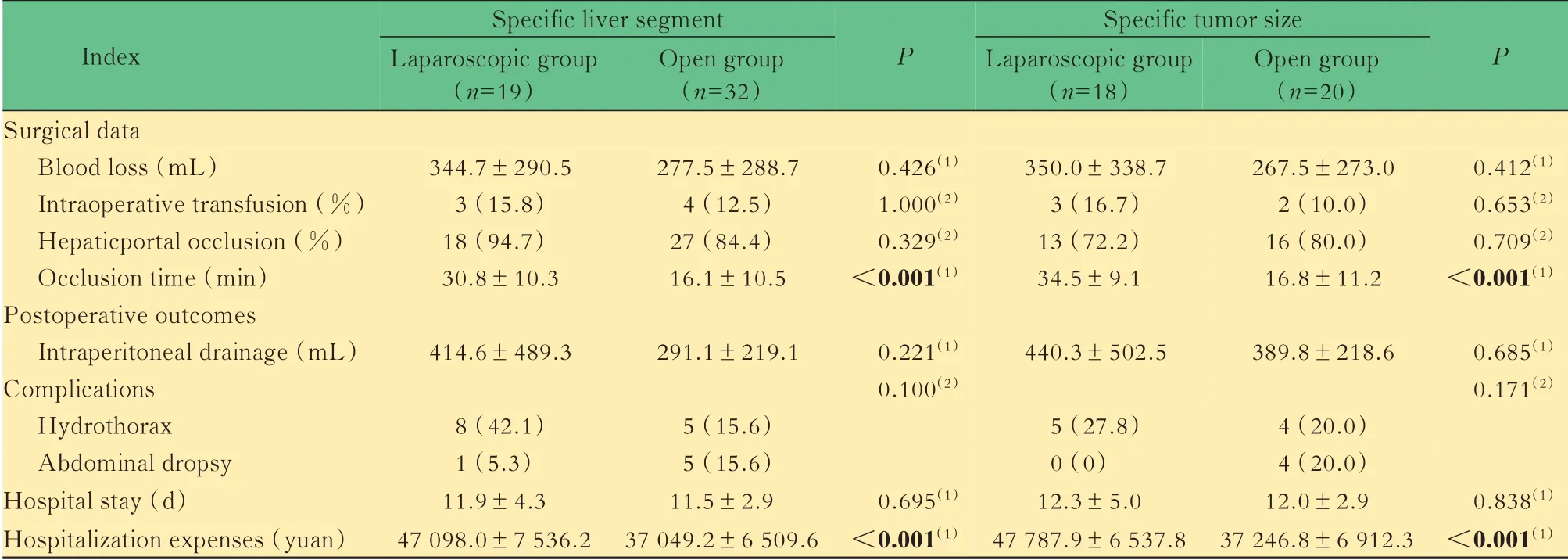
表5 特定肝段或特定肿瘤大小的两组患者疗效及术后恢复比较Tab 5 Comparison of efficacy and postoperative recovery between the two groups with specific liver segment or tumor size[x±s or n(%)]
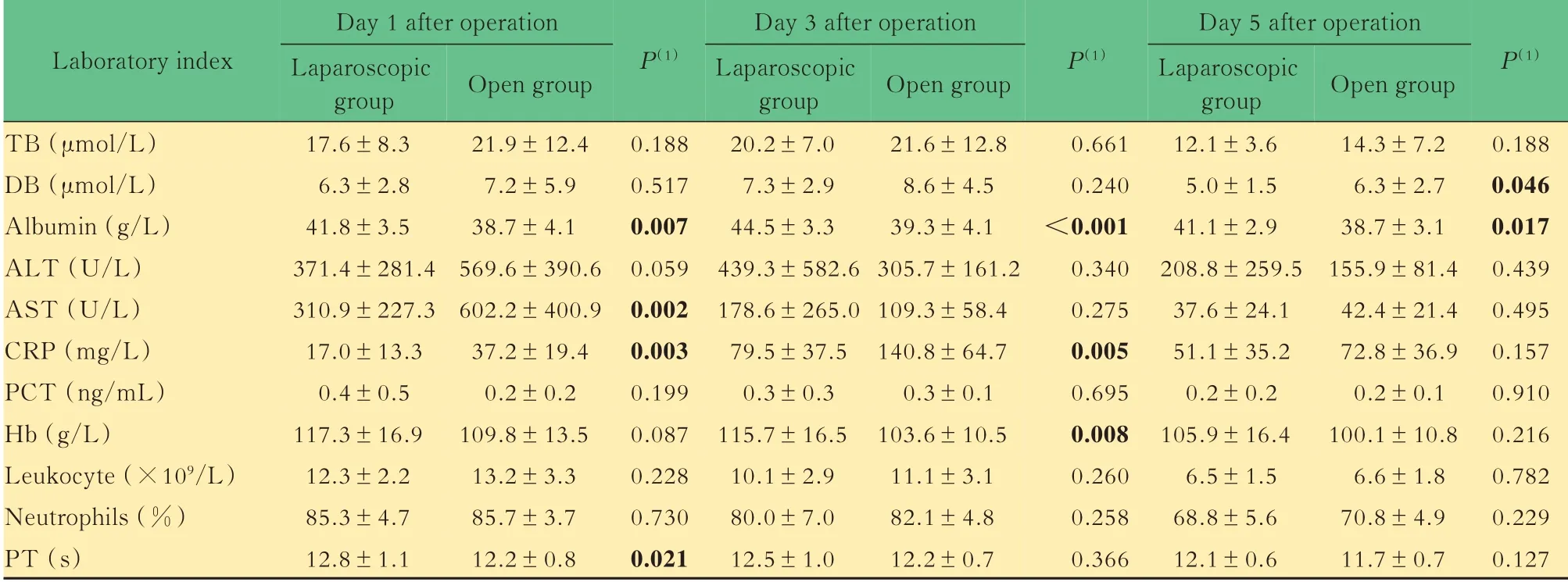
表6 特定肝段的腹腔镜组和开腹组患者实验室指标比较Tab 6 Comparison of laboratory indexes between laparoscopic group and open group with specific liver segment (x±s)
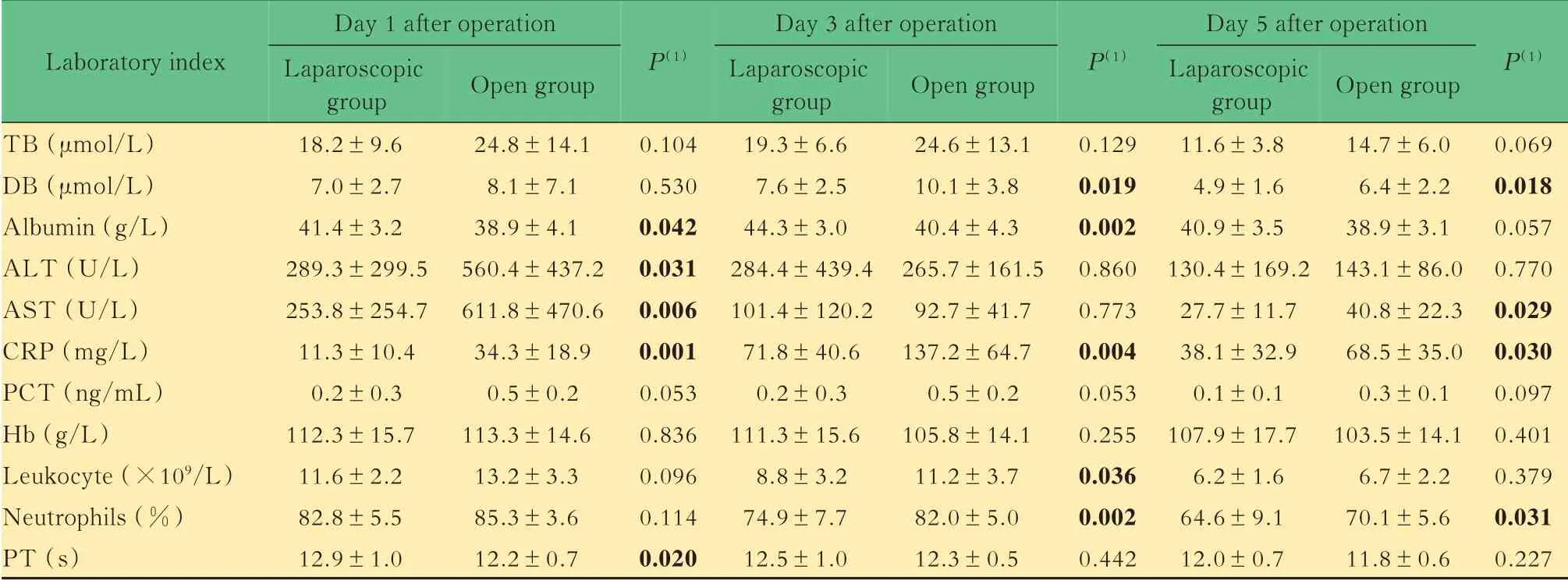
表7 特定肿瘤大小的腹腔镜组和开腹组患者实验室指标比较Tab 7 Comparison of laboratory indexes between laparoscopic group and open group with specific tumor size (x±s)
肝血管瘤的手术指征尚存在争议。本研究对肝血管瘤的临床治疗决策主要以多学科专家共识为参考,同时对具有明显焦虑情绪和强烈手术意愿的患者酌情放宽手术指征:(1)具有明显伴随症状或严重并发症;(2)进行性增大的血管瘤(直径增大>2 cm/年);(3)诊断不明确,不能排除恶性肿瘤可能[4]。
本研究纳入的两组患者在年龄、肿瘤数量和位置等基本资料上存在显著差异,这可能与外科医师倾向于选择简单病例(单发、左叶)进行腹腔镜手术有关。肿瘤大小和肝段切除范围是影响手术操作和术后结局的两个重要因素。既往腹部手术史造成的腹腔粘连以及合并糖尿病等疾病对术后恢复的不利影响,也都可能对研究结果造成偏差。因此,我们采用PSM 以减少病例选择的偏移。在将年龄、肿瘤数量和位置等不均衡的协变量纳入PSM 模型的基础上,本研究同时考虑了性别、腹部手术史、合并症、术前实验室指标以及肿瘤最大直径和切除范围等变量,以进一步增加匹配后两组患者的同质性和指标评价的客观性。另外,所有的腹腔镜和开腹手术均由同一团队的肝外科医师进行操作,以减少不同术者手术操作水平差异的影响。
本研究证实,两组患者的术中失血量、输血率及肝门阻断率没有显著差异,与之前的研究相符[9]。另外,在术后引流量、并发症和住院时间上两组间无明显差异,但腹腔镜组肝门阻断时间较长且住院费用较高。相关文献报道腹腔镜手术相比于开腹手术,具有术中出血量少[7-8,10-12]、术后引流量少[8]、并发 症 少[7-9,11-12]、住院 时 间 短[6-12]、住 院 费用低[6]等优点。另一项研究同样采用PSM 方法对146 例肝血管瘤患者进行匹配,发现腹腔镜手术能够减少术中出血、术后并发症和住院时间[7]。结果上的差异可能有几点原因:(1)腹腔镜对术野的放大作用有助于操作中减少血管损伤,同时气腹的建立和保证肝切时中心静脉压低于5 cmH2O 均有利于减少术中失血,但腹腔镜下对出血的控制难度高于开腹手术,易出现失血量较大的病例;(2)鉴于腹腔镜手术中更清晰的术野,要求术者的操作更为精细以减少组织损伤,因此肝门阻断时间会较长;(3)我院对肝血管瘤的手术治疗较为成熟规范,两组患者术后均无严重并发症发生,术后住院时长均为必需的病情观察时间,因此差异不显著;(4)在药物费用类似的情况下,手术过程中腔镜材料的消耗是腹腔镜组住院费用高于开腹组的主要原因;(5)与其他研究结果的差异可能与纳入的样本量大小、患者的选择偏移,不同中心术者的手术水平不同等原因有关。值得注意的是,虽然腹腔镜组的肝门阻断时间更长,但从动态的实验室指标看,其相比于开腹组肝功能损伤小,炎症程度轻,恢复快。这可能与腹腔镜手术操作精细使组织损伤更小,且术中对肝脏的挤压和移动较少有关。因此,腹腔镜治疗肝血管瘤的手术有效性和安全性与开腹手术相似,同时具有组织创伤小,功能恢复快的优势,但住院费用相对较高。
2008 年Louisville 共识建议适合腹腔镜肝切除的病变应位于左叶及右叶下段(Ⅱ~Ⅵ)[13],但随着技术的进展,腹腔镜肝切除的适应证在不断扩大。为了探究腹腔镜手术对位于Ⅰ、Ⅶ或Ⅷ段的肝血管瘤是否具有治疗优势,我们选取了51 例具有可比性的患者进行疗效评估。结果证明在特定肝段中,腹腔镜治疗仍具有相同的手术效果和微创、恢复快的优点,这与之前在Ⅰ、Ⅳa、Ⅶ和Ⅷ段血管瘤中比较腹腔镜与开腹手术疗效的结论相似[12]。Ⅰ、Ⅶ或Ⅷ段位置较深,且毗邻重要血管,进行腹腔镜手术的难度较大,但我们积累的手术经验表明对这些肝段的血管瘤进行切除的关键之一在于游离肝周韧带以充分暴露肝脏,如Ⅰ段的血管瘤要求完全游离左右肝叶,而Ⅶ和Ⅷ段则需要充分暴露右侧肝脏。腹腔镜在解剖视角上有独特的优势,尤其是针对Ⅰ段的血管瘤,能够获得更好的解剖间隙以游离肝脏。因此,本研究认为在手术操作熟练的前提下,可以选择腹腔镜手术治疗这些肝段的血管瘤,以减少肝脏损伤,促进术后恢复。
肿瘤直径≥10.0 cm 的肝血管瘤被称为巨大肝血管瘤[4],对其进行手术治疗可能发生难以控制的大出血,甚至危及生命[5]。鉴于腹腔镜手术对术中出血的控制较难,其对巨大肝血管瘤的治疗指征尚不明确。有报道称腹腔镜手术适合肝左外叶的巨大肝血管瘤,具有微创、恢复快、并发症少等优点[14]。为了避免巨大肝血管瘤手术过程中发生大出血,我们强调术中操作应更轻柔,且在离断肝脏的过程中注意寻找血管瘤的包膜,沿包膜进行实质离断以保证安全。腹腔镜能够减少术中巨大血管瘤的挤压出血风险,同时腔镜的放大功能也有助于寻找血管瘤包膜。本研究通过38 例巨大肝血管瘤患者间的比较,证实在术中严格管理血管的前提下,腹腔镜手术同样有效、安全且损伤较小。
本研究中存在一定的不足:首先,本研究是回顾性而非随机对照试验,虽然运用PSM 减少患者选择偏移,但论证力度仍有欠缺;其次,研究纳入的样本量较小,尤其是在特定肝段或特定肿瘤大小中,且为单中心研究,存在一定的偏移,需要进一步设计大样本多中心的随机对照试验以充分证明。
综上所述,腹腔镜肝血管瘤切除术不仅具有与开腹手术相似的疗效和安全性,而且有全身炎症反应轻、对肝脏损伤小、术后肝功能恢复快等优点。腹腔镜手术在特殊肝段(Ⅰ、Ⅶ、Ⅷ段)血管瘤及经过适当选择的巨大血管瘤治疗中同样具有优势,是一种安全、有效、微创的术式。
