响应面法优化藜麦糠中多酚超声提取工艺及其抗氧化活性
2020-09-03范建凤赵二劳
赵 强 刘 乐 杨 洁 范建凤 赵二劳
(忻州师范学院化学系,忻州 034000)
藜麦(ChenopodiumquinoaWilld.)又名藜谷、南美藜等,为藜科藜属双子叶植物,原产于南美洲安第斯山区[1]。藜麦具有丰富而独特的营养成分,被誉为“超级谷物”“营养黄金”[2-4]。我国1987年开始引种,现已在山西、陕西、青海、四川和宁夏等地规模化种植[5],资源较为丰富。研究表明[6,7],藜麦中含有多酚,且藜麦糠中多酚含量更高。多酚是植物次生代谢产物,具有清除自由基抗氧化、抗肿瘤、抑菌、降血脂以及调节人体免疫力等多种功能活性[8-10],在食品、医药、保健品等领域应用前景广阔。但目前,藜麦糠作为藜麦加工中的副产品,多用作饲料或废弃,造成资源的极大浪费。因此,研究藜麦糠中多酚提取及其生物活性,开发藜麦糠多酚功能产品,对于提升藜麦综合利用效益和经济价值,提高藜麦科技附加值,促进藜麦产业的发展,具有重要的实际意义。
目前,已有一些有关藜麦多酚的研究报道,如卢宇等[8]、阙淼琳等[11]研究了藜麦种子多酚的乙醇浸泡提取工艺,多酚提取率为2.27 mg/g左右;赵宝堂等[12]、陈树俊等[13]研究了藜麦种子多酚的超声辅助提取工艺及其抗氧化活性,多酚提取率为3.33 mg/g以上;陆敏佳等[1]则研究了几种藜麦叶片中多酚的提取工艺及其抗氧化活性,多酚提取率为3.815 mg/g以上。但有关藜麦糠中多酚的超声辅助提取鲜见报道。基于超声辅助在天然产物活性成分提取中具有提取时间短,成本较低,提取率高,不破坏有效成分活性的技术优势[14-16],本文研究藜麦糠中多酚的超声辅助提取,采用单因素实验结合响应面分析的方法优化提取工艺,并以DPPH·和·OH清除率为指标评价其抗氧化活性,为藜麦糠多酚的深入研究和开发应用提供参考。
1 材料与方法
1.1 材料与仪器
藜麦糠:山西静乐藜麦种植基地,粉碎过60目筛,石油醚浸泡脱脂24 h后,烘箱中60烘干,装瓶保存备用。
1,1-二苯基-2-苦肼基(DPPH·)、福林酚试剂;没食子酸、无水乙醇、2,6-二叔丁基对甲酚(BHT)、水杨酸、30%过氧化氢、硫酸亚铁、碳酸钠:分析纯;实验用水为二次去离子水。
KQ-400KDE型高功率数控超声波清洗器,723型可见分光光度计,SHZ-2D循环水式真空泵,QE-200型药材粉碎机。
1.2 方法
1.2.1 超声辅助提取工艺
工艺流程:预处理后藜麦糠→加入溶剂→超声辅助提取→抽滤→滤液定容→多酚提取液。
主要工艺参数:预处理后藜麦糠用量1.0 g,超声辅助提取1次,提取液定容体积100 mL。
1.2.2 藜麦糠多酚超声辅助提取单因素实验1.2.2.1 提取温度对藜麦糠中多酚提取率的影响
以50%乙醇为提取剂,料液比(g/mL)1∶35,超声功率200 W,分别在温度20、30、40、50、60、70 ℃条件下,超声辅助提取30 min,研究温度对藜麦糠中多酚提取率影响,确定最适提取温度。
1.2.2.2 超声功率对藜麦糠中多酚提取率的影响
以50%乙醇为提取剂,料液比(g/mL)1∶35,提取温度30 ℃,分别在超声功率160、200、240、280、320、360 W条件下,超声辅助提取30 min,研究超声功率对藜麦糠中多酚提取率影响,确定最适超声功率。
1.2.2.3 提取时间对藜麦糠中多酚提取率的影响
以50%乙醇为提取剂,料液比(g/mL)1∶35,提取温度30℃,超声功率200 W,分别超声辅助提取10、20、30、40、50、60 min,研究提取时间对藜麦糠中多酚提取率影响,确定最适提取时间。
1.2.2.4 料液比对藜麦糠中多酚提取率的影响
以50%乙醇为提取剂,提取温度30 ℃,超声功率200 W,分别在料液比(g/mL)1∶25、1∶35、1∶45、1∶55、1∶65和1∶75的条件下,超声辅助提取30 min,研究料液比对藜麦糠中多酚提取率影响,确定最适料液比。
1.2.2.5 乙醇浓度对藜麦糠中多酚提取率的影响
分别以40%、50%、60%、70%、80%和90%乙醇为提取剂,在料液比(g/mL)1∶35,提取温度30 ℃,超声功率200 W条件下,超声辅助提取30 min,研究乙醇浓度对藜麦糠中多酚提取率影响,确定最适乙醇浓度。
1.2.3 藜麦糠多酚超声辅助提取的响应面优化实验
根据单因素实验结果,选取对藜麦糠多酚提取率影响较大的乙醇浓度(A)、提取时间(B)、超声温度(C)和料液比(D)4个因素,进行4因素3水平响应面实验,优化藜麦糠多酚超声辅助提取工艺。选定的因素及水平见表1。
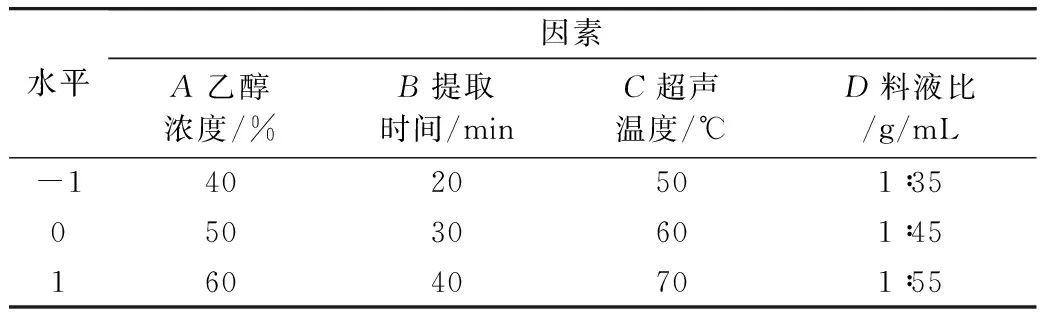
表1 Box-Benhnken实验因素与水平
1.2.4 藜麦糠中多酚提取率测定
参考文献[17,18]方法,以没食子酸为标准对照品,采用Folin-Ciocalteau法测定藜麦糠多酚提取率。
1.2.4.1 没食子酸标准曲线的绘制
精密吸取浓度为13.0 μg/mL的没食子酸标准液0.0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL,分别置于10 mL比色管中,都加入10%碳酸钠溶液1.5 mL和福林酚试剂 1 mL,摇匀,去离子水定容至刻度,40 ℃水浴中避光反应40 min后,冷却至室温,在选定的最大波长765 nm处测定其吸光度。以没食子酸对照品浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
1.2.4.2 藜麦糠中多酚提取率测定
精密移取适当稀释后的藜麦糠提取液1.0 mL,按1.2.4.1的没食子酸标准曲线方法测定其吸光度。按公式计算多酚提取率。
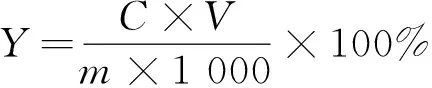
式中:C为提取液中多酚浓度/μg /mL;V为稀释后藜麦糠多酚提取液总体积mL;m为藜麦用量/mg。
1.2.5 藜麦糠多酚对·OH的清除率
实验参考文献[19,20]的方法,采用水杨酸法测定藜麦糠多酚和BHT对·OH的清除率并计算其IC50。IC50指对·OH的清除率达到50%时,所需藜麦糠多酚或BHT溶液浓度,IC50值越小,对·OH清除率越大,抗氧化活性越强。
清除率=[1-(Ai-Aj)/A0]×100%
式中:Ai为·OH溶液与加入一定量藜麦糠多酚提取液或BHT溶液体系的吸光度;Aj为仅藜麦糠多酚提取液或BHT溶液体系的吸光度;A0为仅·OH溶液体系的吸光度。
1.2.6 藜麦糠中多酚对DPPH·清除率的测定
实验参考文献[7,21]的方法,测定藜麦糠多酚和BHT对DPPH·的清除率并计算其IC50。
清除率=[1-(A1-A2)/A0]×100%
式中:A1为DPPH·溶液与加入一定量藜麦糠多酚提取液或BHT溶液体系的吸光度;A2为仅藜麦糠多酚提取液或BHT溶液体系的吸光度;A0为DPPH·溶液体系的吸光度。
1.3 数据处理
数据均为3次测定的平均值,作图用Excel,显著性用SPSS分析(P<0.05,差异显著;P<0.01,差异极显著),Box-Behnken进行响应面分析。
2 结果与分析
2.1 没食子酸标准曲线
没食子酸标准曲线如图1。没食子酸回归方程:A=0.081 5C+0.010 6,R2=0.999 2,没食子酸在0.0~9.1 μg /mL浓度范围内与其吸光度成良好线性关系。

图1 没食子酸标准曲线
2.2 单因素实验结果与分析
提取温度、超声功率、提取时间、料液比和乙醇浓度对藜麦糠多酚提取率影响如图1。
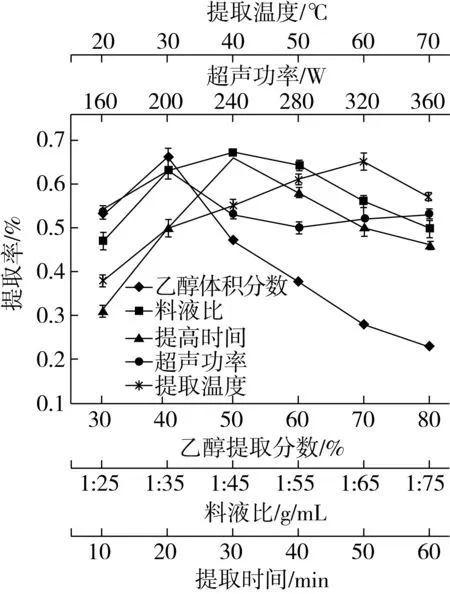
图2 不同因素对藜麦糠多酚提取率的影响
2.2.1 提取温度对藜麦糠多酚提取率的影响
由图1可知,随提取温度的升高,藜麦糠中多酚提取率增加,在60 ℃时达到最大,为0.65%。60 ℃后提取率下降。这是由于温度升高,分子运动加快,有利于多酚溶出;但温度过高,使乙醇挥发,且可能会破坏已提取出的多酚结构[17],导致藜麦糠多酚提取率降低。因此,选择60 ℃为最佳提取温度。
2.2.2 超声功率对藜麦糠多酚提取率的影响
由图1可见,随超声功率的增大,藜麦糠多酚提取率先增后降,但整体变化不大。在超声功率200 W时,多酚提取率最大,为0.63%。可能超声功率过大会破坏藜麦多酚结构。因此选择200 W为最佳超声功率。
2.2.3 提取时间对藜麦糠多酚提取率的影响
从图1可以发现,随着提取时间的延长,藜麦糠多酚提取率呈先增后降趋势。在提取时间为30 min时,提取率达到最大,为0.66%。这是由于提取时间短,多酚提取不充分,当达到适宜提取时间后,再延长提取时间,多酚在超声波作用下会降解,已提出多酚损失,导致多酚提取率下降。故选定30 min为最佳提取时间。
2.2.4 料液比对藜麦糠多酚提取率的影响
由图1可知,随料液比增加,藜麦糠多酚提取率先增后降,当料液比(g/mL)为1∶45时,多酚提取率达到峰值0.67%,以后随料液比增加,多酚提取率降低。其原因可能是在料液比(g/mL)为1∶45时,对多酚类物质的溶解已基本饱和,再增加料液比,其它脂溶性成分增多,与多酚产生竞争[22,23],使多酚提取率下降。故选定1∶45为最佳料液比。
2.2.5 乙醇浓度对藜麦糠多酚提取率的影响
从图1可知,随乙醇浓度增加,藜麦糠多酚提取率先增后降,当乙醇浓度为50%时,多酚提取率达最大值0.66%,再继续增加乙醇浓度,多酚提取率逐渐下降。其原因可能是乙醇浓度过高,使其它脂溶性物质浸出增多,减少了多酚类物质的溶出[24]。因此,选择50%为最佳乙醇浓度。
2.3 响应面优化分析
2.3.1 响应面设计与结果
以多酚提取率为响应值,固定超声功率为200 W,选取对藜麦糠中多酚提取率影响较大的乙醇浓度(A)、提取时间(B)、超声温度(C)和料液比(D)4个因素,设计进行4因素3水平响应面实验,优化藜麦糠中多酚超声辅助提取工艺。响应面设计及结果如表2。

表2 响应面实验设计及结果
2.3.2 响应面回归模型与方差分析
通过Design Expert 8.0.6 软件对表2数据进行拟合,得到藜麦糠多酚超声辅助提取工艺模型的四元二次回归方程:提取率Y=0.80-0.025A+0.010B+0.014C-0.028D-0.010AB+0.010AC-(1.000E-002)AD+0.040BC+0.025BD-0.017CD-0.021A2-0.071B2-0.055C2-0.080D2,由模型中因素一次项系数不难发现,影响藜麦糠多酚提取率的因素大小顺序为:D(料液比)>A(乙醇浓度)>C(温度)>B(提取时间)。多酚回归模型的方差分析结果如表3。

表3 回归模型方差分析
2.3.3 工艺条件验证实验
为检验工艺的可靠性,考虑实际可操作性,将理论最优工艺条件修正为:乙醇浓度44%,提取时间31 min,温度61 ℃,料液比(g/mL) 1∶43,超声功率200 W。3次实验藜麦糠中多酚提取率分别为0.79%、0.79%和0.80%,平均为0.79%,与理论预测值相对误差为1.25%,进一步表明所建模型的稳定可靠,可用于实际操作。
2.4 藜麦糠多酚抗氧化活性
2.4.1 藜麦糠多酚对·OH的清除率
藜麦糠多酚和BHT对·OH的清除率结果如图2。在实验浓度范围内,藜麦糠多酚与BHT对·OH的清除率都随浓度的增加而增大,具有明显量效关系。求得藜麦糠多酚与BHT的IC50分别为13.52、20.12 μg/mL,显见,藜麦糠多酚清除·OH 的能力强于BHT,表明藜麦糠多酚具有强的抗氧化活性。

图3 藜麦糠多酚与BHT对·OH的清除率
2.4.2 藜麦糠多酚对DPPH·的清除率
藜麦糠多酚和BHT对DPPH·的清除率结果如图3。在实验浓度范围内,藜麦糠多酚与BHT对DPPH·的清除率都随浓度的增加而增大,具有明显量效关系。求得藜麦糠多酚与BHT的IC50分别为2.48、17.33 μg/mL,显见,藜麦糠多酚清除DPPH·的能力远强于BHT,也表明藜麦糠多酚具有强的抗氧化活性。

图4 藜麦糠多酚与BHT对DPPH·的清除率
3 结论
以藜麦糠中多酚提取率为指标,通过单因素实验结合响应面分析优化了藜麦糠中多酚超声辅助提取工艺,确定的最佳工艺条件:乙醇浓度44%,提取时间31 min,温度61 ℃,料液比(g/mL)1∶43,超声功率200 W。该工艺条件下,藜麦糠中多酚提取率为0.79%,与模型理论预测值0.80%的相对误差为1.25%,表明响应面优化的藜麦糠多酚提取工艺稳定可行。抗氧化活性研究发现,藜麦糠多酚对·OH和DPPH·的IC50分别为13.52、2.48 μg/mL,藜麦多酚具有强的抗氧化活性。本研究为藜麦糠中多酚的提取及其抗氧化活性的深入研究提供了一定的参考,若要达到藜麦糠多酚的产业化生产,还需开展藜麦多酚纯化及其体内抗氧化活性的研究。
