米发糕胃肠水解物抗氧化性及肽段差异性分析
2020-09-03李楠楠贾才华赵思明张宾佳熊善柏林亲录
王 静 陈 晨 李楠楠 贾才华 赵思明张宾佳 牛 猛 熊善柏 林亲录
(华中农业大学食品科学技术学院1,武汉 430070) (中南林业科技大学食品科学与工程学院2,长沙 410004)
传统食物发酵过程可使食物产生特有的风味,且原材料中的大分子物质可被降解为易于人体吸收的营养成分,提升食物的生物利用率,因而发酵食物备受人们的青睐[1]。不同微生物在发酵过程中产生的酶系存在差异,复合发酵产生的风味物质和生物活性物质的种类、含量较单一发酵的高[2, 3]。已有研究报道,采用复合发酵制作的馒头风味物质种类多且含量高[4];利用米根霉和少孢根霉复合发酵豆渣可以提高豆渣营养成分并增强其抗氧化活性[5]。
米发糕是中国南方传统的大米发酵制品,常采用酵母菌、乳酸菌和霉菌等微生物发酵制作米发糕,不同发酵微生物使得米发糕在感官品质和营养特性方面存在差异[6, 7]。且已有研究报道,利用蛋白酶水解大米蛋白分析鉴定得大米抗氧化肽[8]。而在米发糕发酵过程中,微生物产生的蛋白酶会对大米蛋白进行水解,可释放活性肽。此外,胃肠消化过程中蛋白质、多肽在胃蛋白酶、胰蛋白酶的作用下可进一步被水解或修饰,暴露出更多的活性基团[9, 10]。因此,研究胃肠水解条件下米发糕的健康效应具有重要意义。本实验采用凝胶层析色谱、超滤膜分离及液相色谱-四级杆飞行时间(TOF LC/MS/MS)质谱技术,通过Fe2+螯合能力和还原能力评价米发糕体外胃肠水解物的抗氧化活性,探究不同发酵剂制备米发糕的水提物和胃肠水解物中肽段差异性与抗氧化性的关系,为米发糕的营养健康特性提供参考。
1 材料与方法
1.1 材料
籼米粉(粉状)、安琪耐高糖活性干酵母和甜酒曲(甜味型);卡斯特酒香酵母ZSM-001、米根霉ZSM-003:华中农业大学食品工程系从米发糕泥浆中分离筛选获得[11]。
1.2 主要试剂
葡聚糖凝胶G-25、DPPH、胰蛋白酶(4 000U/mg蛋白)、菲咯嗪、胃蛋白酶(3 000 U/mg蛋白)、甲酸(色谱纯)、氯化亚铁、氯化铁、铁氰化钾、双氧水、硫酸亚铁、三氯乙酸。未标注试剂均为分析纯。
1.3 主要仪器与设备
电热恒温水浴锅(HHS),离心机(TDL-5A),凝胶层析柱(Sephadex G-25),可见光光度计(722N型),真空冷冻干燥机(FD-1A-50型),半制备液相色谱仪(Agilent 1260),TechMate C18色谱柱(ST C18 4.6 mm×150 mm),AB Sciex TOF LC/MS/MS(TripleTOF 5 600+)。
1.4 方法
1.4.1 米发糕的制备
米发糕的制备采用文献[12]报道的方法,以籼米粉为原料,3种发酵剂为辅料,加入纯净水搅拌均匀,于35 ℃发酵12 h后,注模蒸制而成3种不同的米发糕。其中3种发酵剂分别为发酵剂1、发酵剂2和发酵剂3。
1.4.2 水提物制备
捣碎的米发糕与去离子水以1∶5比例混合,适度搅拌后在37 ℃水浴提取4 h后,置于沸水浴中10 min,待冷却后,4 000 r/min离心20 min,过滤,取上清液,冷冻干燥,即得水提物。
1.4.3 胃肠水解物制备
胃肠水解物的制备参考文献[13]的方法,并有所修改。捣碎的米发糕与去离子水以1∶5比例混合,用1.0 mol/L盐酸调节体系pH至2,加入胃蛋白酶(添加量为米发糕蛋白质量的4%),适度搅拌后37 ℃恒温2 h,恒温结束后,1.0 mol/L氢氧化钠调pH值至7.0,然后加入胰蛋白酶(添加量为米发糕蛋白质量的4%),适度搅拌后37 ℃恒温2 h,恒温结束后,置于沸水浴中10 min灭酶,冷却,4 000 r/min离心20 min,取上清液,冷冻干燥,即得米发糕胃肠水解物。米发糕蛋白质含量测定参照GB 5009.5—2010,得到菌株ZSM-001制备的米发糕(J)、菌株ZSM-001与ZSM-003制备的米发糕(JG)和安琪酵母与酒曲制备的米发糕(AJ)的蛋白含量分别为(6.31±0.01)、(6.42±0.07)、(6.34±0.06) g/100 g。
1.4.4 分子质量分布测定
样品分离时,加入1 mL浓度为20 mg/mL的样品,以0.4 mL/min的流速洗脱,记录仪记录下流出液流出情况,用10 mL离心管收集流出液体,并于280 nm测定吸光值,记录各物质出现最大吸收峰的时间及吸光值大小。分子质量标准曲线的绘制,分别取L-酪氨酸(181.19 u)、还原型谷胱甘肽(307.33 u)、VB12(1 355.38 u)、溶菌酶(14 400 u)和牛血清蛋白(67 000 u)各20 mg溶于1 mL洗脱液中,得到20 mg/mL 的标准溶液,按上述操作加入1 mL进行分析,以最大吸收峰的出峰时间和标品的分子质量对数绘制标曲[14, 15]。经过葡聚糖G-25凝胶层析色谱柱,洗脱时间分别为375、345、285、225和120 min,以分子质量的对数(lgM)为纵坐标,出峰时间T为横坐标作标准曲线,其直线方程为y=-0.010 6x+6.244 5(R2=0.973 3),以此估算水解产物的分子质量分布范围,为抗氧化肽进一步分离提供信息。
1.4.5 超滤
根据分子质量测定结果,选用3 ku、10 ku的超滤膜,将样品液分离为3个组分(Ⅰ>10 ku、Ⅱ3~10 ku、Ⅲ<3 ku),收集3个超滤组分,冷冻干燥,用于抗氧化活性测定。
1.4.6 抗氧化活性测定
将样品分别配成质量分数为10、20、40、60、80、100 mg/mL的溶液,测定米发糕超滤组分的抗氧化活性。
1.4.6.1 Fe2+螯合能力
Fe2+螯合能力的测定按照文献[16]报道的方法,并略作修改。取1 mL的样品溶液,加入3.7 mL乙醇和0.1 mL 2 mmol/L的氯化亚铁溶液混合,混匀后加入0.2 mL 5 mmol/L的菲咯嗪溶液启动反应。室温静置10 min后,测定溶液在562 nm波长处检测吸光值。
Fe2+螯合能力=(A0-A1)/A0×100%
式中:A0为空白吸光值,A1为样品吸光值。
1.4.6.2 还原能力的测定
还原能力的测定按照文献[17]报道的方法,并稍作调整。取多肽溶液1 mL,加入0.2 mol/L的磷酸盐缓冲液(pH 6.6)2.5 mL和1%的铁氰化钾溶液2.5 mL,充分混合以后,在50 ℃下,保温20 min后加入2.5 mL 10%的三氯乙酸。经充分混合后以3 000 r/min离心10 min。取上清液2.5 mL,加入2.5 mL去离子水和0.5 mL 0.1% 氯化铁,混匀后,测定反应液在700 nm处的吸光度值。
1.4.7 米发糕消化前后水解物质谱分析
使用TOF LC/MS/MS检测米发糕水提物和胃肠水解物中小于3 ku的组分[17]。将样液上样到C18捕获柱(5 μm,5 mm× 0.3 mm,Agilent Technologies)上,然后洗脱到C18分析柱(75 μm×150 mm,3 μm粒径,孔径100 Å,Eksigent)中。
使用流动相A(3%DMSO,97%H2O,0.1%甲酸)和流动相B(3%DMSO,97%ACN,0.1%甲酸),洗脱程序为:0~15 min,5%B;15~35 min,5%B~35%B;35~36 min,35%B~80%B;36~41 min,80%B;41~41.1 min,80%B~5%B;41.1~50 min,5%B。恒定流量为0.3 mL/min。MS扫描从350到1 500 m/z进行,时间跨度为250 ms。MS/MS分析,每个扫描周期由一个全扫描质谱(m/z:350~1 500,电荷状态:2~5)组成,随后是40个MS / MS事件。使用ProteinPilot软件分析来自TripleTOF 5 600+的原始数据。使用以下参数在UniProt(Rice indica)参考数据库中搜索数据:样品类型,鉴定;Cys烷基化,无;消化,无。
1.5 数据统计分析
每次实验重复3次,取平均值,实验数据以平均值±标准差表示,并采用Origin 8.5软件作图。
2 结果与分析
2.1 米发糕水提物和胃肠水解物的分子质量分布
将米发糕水提物和胃肠水解物的凝胶色谱图(图1)统计成表1,由表1可知,不同微生物发酵制成的米发糕,其水提物和胃肠水解物的分子质量分布差异较大。JGs、AJs的分子质量主要集中在3 ku以下,分别为64.14%、70.29%,Js的分子质量主要集中在>10 ku(41.52%)和<3 ku(43.64%)。由于复合发酵对米发糕中的蛋白质水解能力强于酵母菌单独发酵水解能力,复合发酵剂使得米发糕中小分子多肽、游离氨基酸较多[18]。经胃肠水解后,Jw、JGw、AJw米发糕胃肠水解物的分子质量减小,集中在<3 ku,分别占到总含量的69.41%、74%、71.11%。结果表明,米发糕在胃蛋白酶、胰蛋白酶作用下,蛋白质和多肽进一步降解,产生更多小分子肽和游离氨基酸。有研究报道分子质量越小的物质,穿过肠道屏障并发挥生物效应的可能性越高[19, 20]。因此,米发糕胃肠水解物中含有抗氧化活性的小分子肽,可能穿过肠道屏障并发挥抗氧化性,提升米发糕功能性。同时,分子质量分布情况也为后续实验超滤膜的选择提供依据。
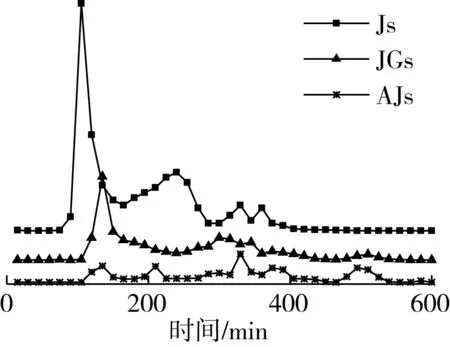
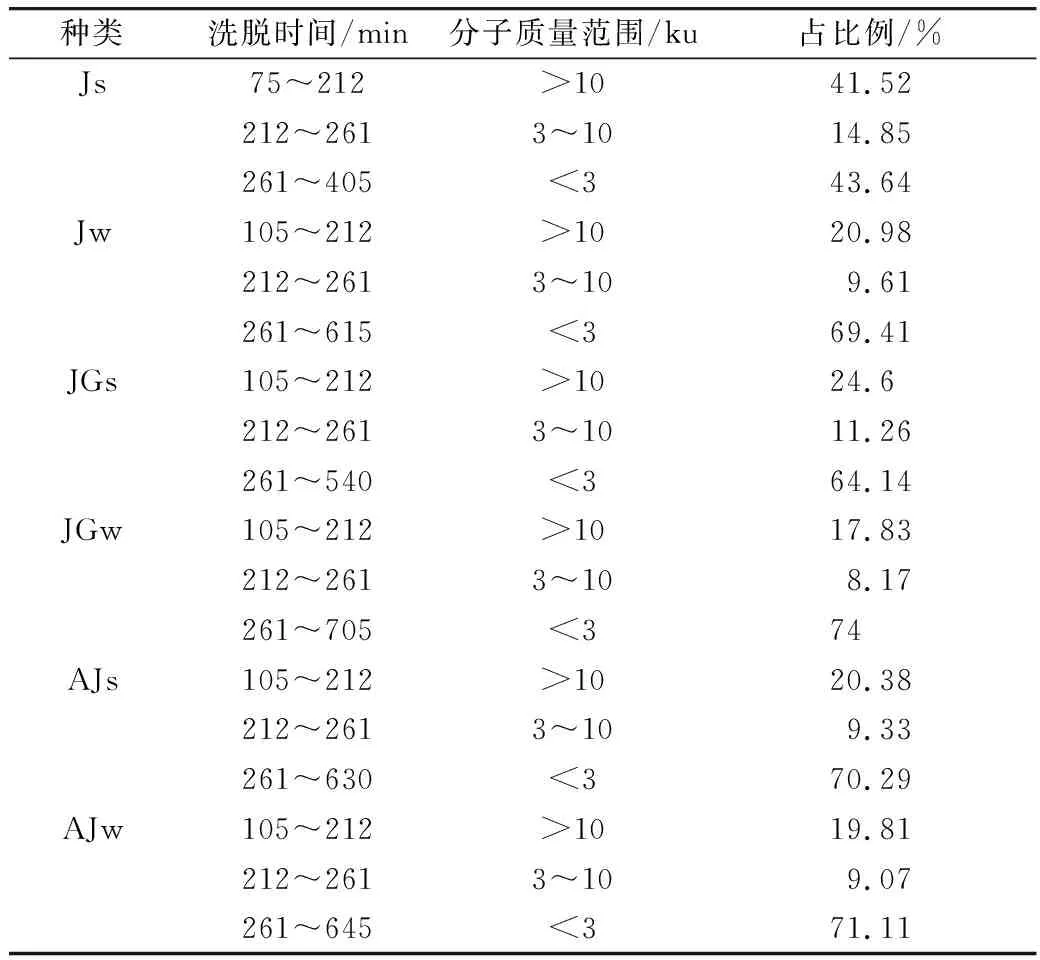
表1 不同种类米发糕水提物和胃肠水解物的分子质量分布
2.2 米发糕胃肠水解物超滤组分抗氧化活性
过渡金属离子可催化加快自由基产生,促进氧化反应的发生,可导致油脂氧化加速和人体自由基产生能力大于机体清除能力,因此螯合金属可间接反应物质的抗氧化活性[21]。物质的抗氧化能力与还原能力也密切相关,还原能力越强,抗氧化能力越强[21]。基于实验室前期研究,已发现米发糕水提物和胃肠水解物均具有一定抗氧化性,其Fe2+螯合能力和还原能力分别与0.001~0.006 mg/mL EDTA溶液和0.01~0.06 mg/mLVc溶液相当,且胃肠水解物的抗氧化性较水提物的抗氧化性高[22]。米发糕胃肠水解物的超滤组分抗氧化能力由图2可知,质量浓度在10~100 mg/mL范围内时,Fe2+螯合能力、还原能力与浓度之间都呈现出较好的量效关系。3种米发糕胃肠水解物呈现出分子质量越小,Fe2+螯合能力越强的趋势,其中AJw-Ⅲ最大,其次为JGw-Ⅲ。Jw-Ⅲ、AJ w-Ⅲ的还原能力强于组分Ⅱ和组分Ⅰ,而JGw-Ⅰ的还原能力强于JGw-Ⅲ和JGw-Ⅱ。整体而言,分子质量<3 ku的组分表现出较好的抗氧化性,且AJw的抗氧化活性较高。肽的抗氧化性与其分子质量大小密切相关,具有抗氧化性的多肽片段分子质量一般<3 ku[23, 24]。米发糕胃肠水解物表现出一定的Fe2+螯合能力,可能是由于蛋白质、多肽的水解导致铁离子与其侧链上的氨基和羧基结合[25]。此外,较高的还原能力表明水解肽具有供电子能力的基团,这些肽只有在适当的分子质量,供电子基团才能得到充分暴露发挥抗氧化作用[24, 26]。

2.3 总离子流图谱差异
将米发糕水提物和胃肠水解物的超滤组分Ⅲ进行抗氧化肽差异性研究,用TOF LC/MS/MS质谱仪鉴定。由总离子流图3可知,三种米发糕水提物和胃肠水解物中的肽段存在显著性差异。JGs-Ⅲ总离子流图洗脱峰范围出现较广,肽段数量较多,主要集中在10~60 min,Js-Ⅲ、AJs-Ⅲ洗脱峰主要集中在10~40 min,出峰较早,说明肽段极性较大。胃肠水解物的超滤组分Ⅲ的肽段数量显著增多,洗脱峰主要集中在10~70 min。JGw-Ⅲ、AJw-Ⅲ出峰较晚,强度较高的肽段集中在30~60 min出现,说明肽段疏水性较强。有研究报道蛋白质被水解成更小的肽段使更多的疏水基团暴露,而有利于提高抗氧化活性[14, 27]。基于抗氧化活性评价结果,推测复合微生物发酵制备的米发糕(JG、AJ)的抗氧化活性与其在胃肠水解中暴露出更多的疏水基团密切相关。
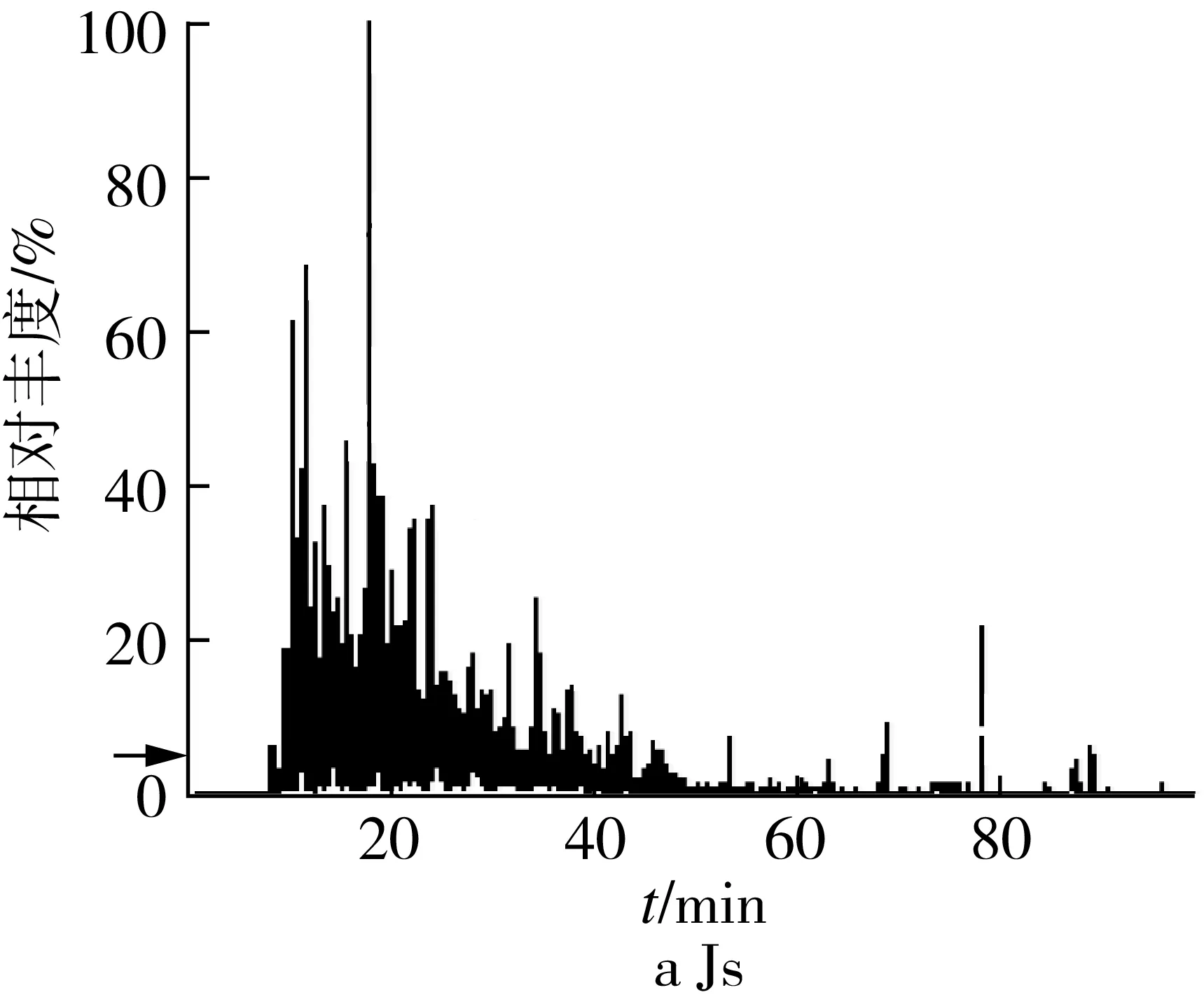
2.4 肽段数的差异性
将TOF LC/MS/MS鉴定到的肽段在Uniprot数据库搜索比对,得到米发糕水提物和胃肠水解物的超滤组分Ⅲ的肽段序列。将肽段进行统计分析可得米发糕肽段数分布情况(图4),JGs的肽段最多,检测到1 799个肽段,其次是Js(368个)、AJs(310个)。表明酵母ZSM-001与米根霉ZSM-003复合发酵对米发糕中蛋白质的酶解作用较强,产生较多肽段。经胃肠水解后,AJw和Jw可检测到的肽段数相比其水提物的肽段数明显增加,其中AJw肽段总数最高(1 148个),而JGw肽段数相对减少,可能由于JG中多肽降解为分子质量较小的氨基酸,仪器无法检测。说明胃蛋白酶和胰蛋白酶促进蛋白质、多肽进一步水解,产生更多小肽,暴露出更多抗氧化活性基团,提升了米发糕胃肠水解物的抗氧化性。其中安琪酵母和甜酒曲复合发酵制备的米发糕(AJ),由抗氧化活性评价结果可知,其胃肠水解物的Fe2+螯合能力最大,还原能力较高,推测可能是AJ在胃肠水解过程产生更多的抗氧化肽。
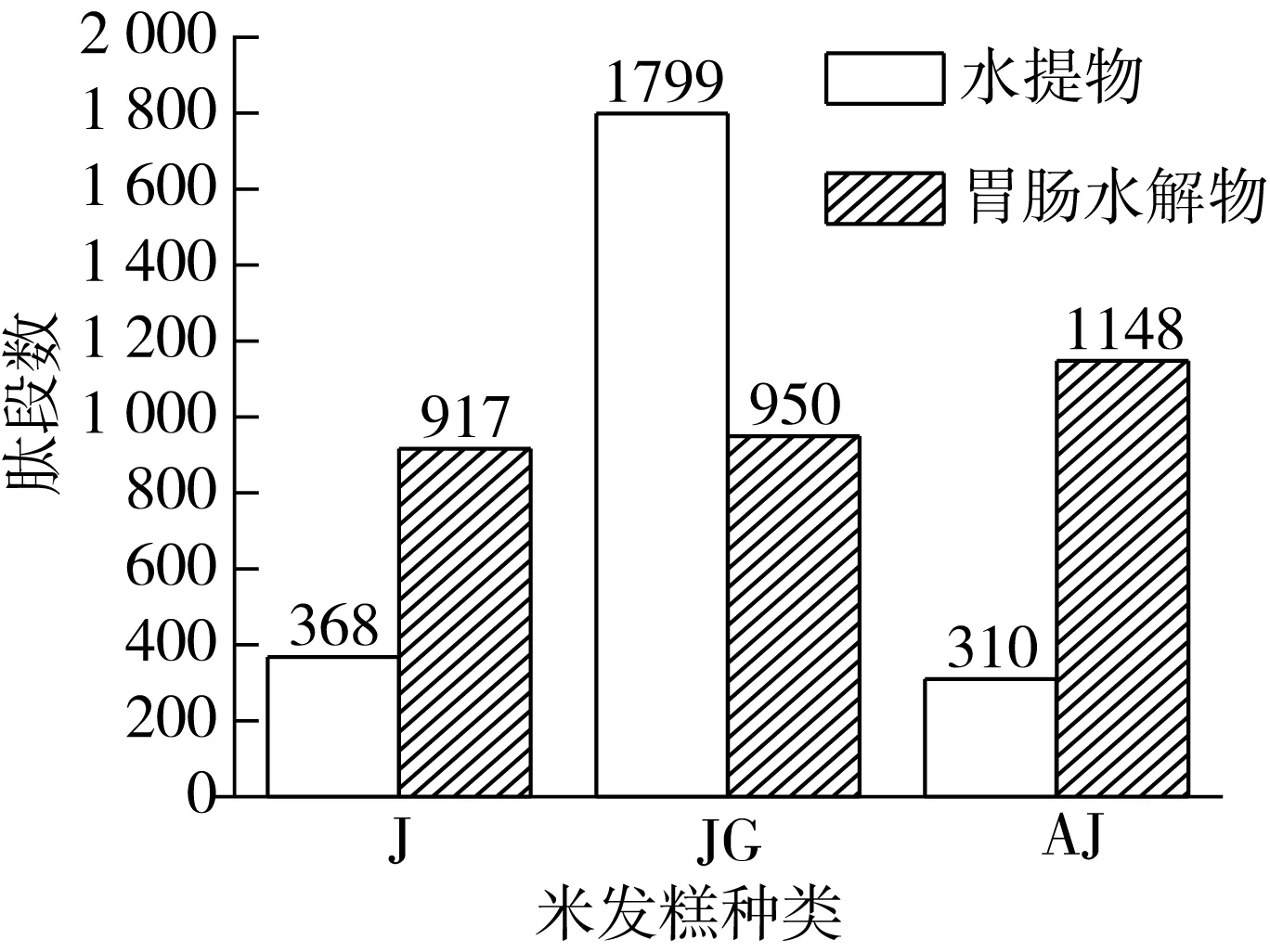
图4 米发糕水提物和胃肠水解物中肽段数总数
3 结论
米发糕经胃肠水解后,其抗氧化活性提高,分子质量集中在3 ku以下,并且分子质量小于3 ku组分的抗氧化能力高。通过TOF LC/MS/MS总离子流图分析,确是米发糕胃肠水解物中肽段疏水性越强其抗氧化活性越强。不同发酵剂导致米发糕在胃肠水解中产生多肽的能力存在差异,复合发酵菌株水解蛋白质的能力较强,产生较多小分子肽。以安琪酵母与酒曲复合发酵制作的米发糕在胃肠水解后,胃肠水解物中分子质量小于3 ku组分的肽段数最多,疏水性较强,Fe2+螯合能力最大,还原能力较高。
