玉米赤霉烯酮降解菌的筛选与鉴定
2020-09-03张俊楠王金全吕宗浩郑云朵
杨 凡 张俊楠 王金全 吕宗浩 刘 杰 郑云朵
(中国农业科学院饲料研究所,北京 100081)
玉米赤霉烯酮(Zearalenone, ZEN)是一种具有类雌激素作用的非甾醇类真菌毒素,主要由镰刀菌属如禾谷镰刀菌(Fusariumgraminearum)、黄色镰刀菌(Fusariumculmorum)、三线镰刀菌(Fusariumtricinctum)等真菌产生。ZEN是全球污染程度最严重、污染范围最广泛的真菌毒素之一,在玉米、小麦、大麦、大豆、高粱、大米等饲料原料以及大部分农副产品中均可被检出[1-3]。ZEN及其衍生物的结构与内源性雌激素17β-雌二醇十分相似,因此能够竞争性与雌激素受体结合,从而引发一系列类雌激素效应,对母猪等雌性哺乳动物尤为明显,主要中毒症状表现为阴户红肿、假发情等,严重者甚至出现流产、死胎和阴道脱垂[4,5]。此外,ZEN还具有肝肾毒性、免疫毒性和潜在致癌性[2]。ZEN可以通过食物链进入动物或人体内,严重威胁畜牧业的发展和人类健康。
为了减少饲料及其原料中的ZEN,提高畜产品安全,降低毒素污染造成的经济损失,物理、化学和生物转化的方法已经在不断的尝试和改进。物理(清洗、吸附剂、辐射等)和化学(碱性水解、氧化等)脱毒法往往因其效果不稳定、容易造成营养缺失、饲料适口性差、成本昂贵等缺点,很难应用于生产实践[6-8]。利用微生物或酶将毒素转化为无毒或低毒代谢产物的生物转化法则具有高效专一、对环境污染小、不破坏饲料营养成分等优点[9]。地球上的微生物种类丰富,数量庞大,自然界中总能找到相应降解某种或几种毒素的微生物。目前为止,国内外已经发现多种能够降解ZEN的微生物,主要为真菌类和细菌类。已报道的真菌类如粉红粘帚菌、丝孢酵母菌、黑曲霉等都可以降解ZEN,然而由于部分真菌自身会产生毒素或致病,因此真菌直接作为饲料添加剂来解毒受到限制[10-12]。目前发现的能降解ZEN的细菌种类也较多,如不动杆菌、短小芽孢杆菌、赖氨酸芽孢杆菌等[12-15]。
本研究拟利用富集驯化的方法,从猪粪便中筛选出一株可以高效降解ZEN的细菌,通过研究菌株降解特性,优化降解条件,并探索其降解机理,为其在饲料中的脱毒应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
猪粪便样品采集自河北邢台南和县农家猪舍,新鲜的粪便样品分装到无菌的50 mL离心管中,当天带回实验室保存于-20 ℃冰箱直至使用。
1.1.2 试剂与培养基
甲醇、乙腈均为色谱纯级;ZEN标准品:纯度≥98%;细菌基因组DNA提取试剂盒。其他试剂均为国产分析纯。
LB培养基(g/L):胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,pH 6.8~7.2,121 ℃高压蒸汽灭菌20 min,固体培养基添加1.8%的琼脂。
1.2 仪器与设备
高效液相色谱仪(LC-20AT),荧光检测器(RF-20A),超声波细胞破碎仪(JY92-IIN)。
1.3 实验方法
1.3.1 ZEN的测定方法
样品中ZEN的浓度测定采用高效液相色谱法(HPLC)测定,色谱柱:安捷伦SB-C18柱(150 mm×4.6 mm,5 μm);流动相:乙腈/水/甲醇=46∶46∶8;流速1.0 mL/min;柱温30 ℃;进样量10 μL;荧光检测器:激发波长(Ex)=235 nm,发射波长(Em)=460 nm。
ZEN降解率=(1-降解后培养基中ZEN浓度/空白对照组中ZEN浓度)×100%
1.3.2 ZEN降解菌的筛选
取1.0 g猪粪便样品于10 mL无菌蒸馏水中,37 ℃,200 r/min摇床振荡培养3 h左右,静置10 min,取上清液100 μL加入到10 mL的LB培养基中(ZEN初始浓度为20 mg/L),37 ℃,200 r/min摇床振荡培养4 d。按此步骤驯化3次,结束后取0.2 mL样品,加入0.6 mL甲醇,涡旋1 min,12 000 r/min离心10 min,将上清液过0.22 μm的尼龙滤膜,HPLC检测ZEN浓度。最后一次驯化的菌液梯度稀释涂布LB平板,37 ℃培养48 h,挑取形态不同的菌落划线纯化3次。将纯化后的单克隆菌落接种到1 mL含10 mg/L的LB培养基中,37 ℃,200 r/min摇床振荡培养48 h,空白对照组不接种菌落,每组3个重复。按前述步骤进行样品前处理,HPLC检测不同菌株对ZEN的降解率,其中ZEN降解率最高的菌株命名为ZJ-2019-1,用于后续实验研究。
1.3.3 ZJ-2019-1菌株的鉴定
形态鉴定:将获得的菌株在LB平板划线,37 ℃培养48 h观察菌落形状、大小、边缘、表面、隆起形状、透明度、菌落颜色等。对菌株进行革兰氏染色,在光学显微镜下观察菌体的形态特征。
16S rDNA鉴定:将降解活性最高的菌株接种到LB培养基中,37 ℃,200 r/min摇床振荡培养16 h,按照细菌基因组DNA提取试剂盒操作说明提取基因组DNA作为模板进行PCR扩增。引物为细菌通用引物:16S-27F(5’-AGAGTTTGATCMTGGCTCAG-3’)和16S-1495R (5’-TACGGYTACCTTGTTACGACTT-3’),扩增后的产物由检测公司纯化和测序。测序结果在NCBI上进行BLAST比对,系统发育进化树使用Mega 6.0生物信息学软件分析完成。
1.3.4 ZJ-2019-1吸附与降解ZEN的活性验证
将培养至稳定期的ZJ-2019-1菌液(3.1×1010cfu/mL)等体积分成两份,其中一份菌液6 000 r/min离心5 min,弃去上清,用无菌的磷酸盐缓冲溶液(PBS,50 mmol/L,pH 7.4)清洗菌体沉淀3次,然后用等体积含10 mg/L ZEN的无菌PBS悬浮。另一份菌液于121 ℃高压蒸汽灭活20 min,然后按同样的方法处理。以含ZEN的无菌PBS缓冲溶液为空白对照,每个样品3个重复,37 ℃,200 r/min摇床振荡培养48 h,各取样1 mL,12 000 r/min离心10 min,检测上清液中的ZEN的残留量。离心后的菌体用甲醇浸提30 min后检测菌体对ZEN的吸附量。
1.3.5 ZJ-2019-1菌株降解ZEN的活性成分定位
将培养至稳定期的ZJ-2019-1菌液(3.4×1010cfu/mL)在8 000 r/min、4 ℃离心20 min,上清液过0.22 μm的Millipore Express PES滤膜,获得无细胞上清液,暂存于4 ℃。离心后的菌体沉淀用PBS清洗3次,然后用PBS重悬,重悬后的细胞置于冰水浴中,采用超声波细胞破碎仪进行细胞破碎,破碎条件:超声5 s,停5 s,超声功率600 W,超声时间33 min。破碎后的细胞碎片10 000 r/min,4 ℃离心20 min,上清液过0.22 μm的Millipore Express PES滤膜,获得细胞内容物。将无细胞上清液分成五部分,其中一份不做处理,其余四份分别进行不同处理:处理组1在100 ℃水浴2 h;处理组2添加1%SDS;处理组3添加蛋白酶K(2 mg/mL, 58 ℃水浴2 h);处理组4添加蛋白酶K(2 mg/mL, 58 ℃水浴2 h)和1%SDS。将不同处理组各取1 mL,添加10 mg/L ZEN共培养,每个样品3个重复,培养48 h后采用HPLC检测不同处理组中ZEN的残留量。
1.3.6 不同因素对ZJ-2019-1菌株降解ZEN的影响
将培养至对数生长期的ZJ-2019-1菌液6 000 r/min离心5 min,弃去上清,用无菌LB液体培养基清洗细胞沉淀3次后重悬菌体细胞,使得菌悬液OD600=0.3~0.5。按照培养温度(22、27、32、37、42 ℃)、初始pH(4.0、5.0、6.0、7.0、8.0、9.0)、培养时间(0、6、12、24、36、48 h)和初始ZEN浓度(2、5、10、20、40 mg/L)进行实验。培养基的初始pH采用1 mol/L NaOH或1 mol/L HCl溶液进行调节。当其中一个因素变化时,其他因素固定为温度37 ℃,初始pH 7.0,ZEN浓度10 mg/L和反应时间48 h。接种量均为2%,空白对照组不接种菌液,其他处理与实验组相同,每个处理组3个重复。将所有反处理组置于200 r/min的恒温摇床中,反应结束后取样,HPLC检测ZEN的残留量。
2 结果与分析
2.1 降解菌株的筛选
猪粪便样品经过3次富集驯化后,对ZEN的降解率为94.1%。将富集驯化3次的菌液在LB平板上稀释涂布,挑取形态不同的菌落进行划线纯化,共获得10株菌株。将这10株菌株进行复筛,验证其对ZEN的降解效率,复筛结果如表1所示。经HPLC检测,其中一株菌株在LB培养基中对ZEN的降解率能达到98%以上,该菌株命名为ZJ-2019-1。图1为ZJ-2019-1降解ZEN的HPLC色谱图,由图1可看出,当ZJ-2019-1和ZEN共培养48 h后,ZEN的峰(6.83 min)明显降低,与不加入ZEN的对照组相比,产生了新的物质峰(2.25 min),该物质可能为ZEN的代谢产物,其结构和毒性有待进一步研究。

表1 降解玉米赤霉烯酮菌株的复筛结果
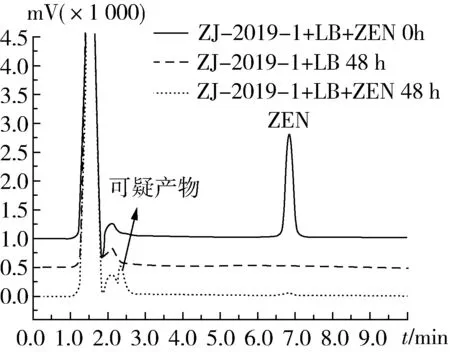
图1 ZJ-2019-1菌株降解ZEN的HPLC图谱
2.2 ZJ-2019-1菌株的鉴定
ZJ-2019-1在LB培养基上培养48 h后的菌落形态为:菌落为淡黄色,不透明,菌落大小不一,直径2~8 mm,边缘不规则,表面有褶皱;革兰氏染色为阳性,菌体呈短杆状。将ZJ-2019-1菌株的16S rDNA基因序列在NCBI上进行BLAST比对,结果显示ZJ-2019-1菌株与枯草芽孢杆菌(Bacillussubtilis)的16S rDNA序列相似性最高,达到99.9%。从图2可以看出,ZJ-2019-1与枯草芽孢杆菌在同一分支上。综上分析,初步鉴定ZJ-2019-1为枯草芽孢杆菌。一些芽孢杆菌能够降解ZEN,但是不同菌株对ZEN的降解活性,降解条件差异较大,这可能与菌株种类和生存环境有关[16-17]。芽孢杆菌具有较强的抗逆性,枯草芽孢杆菌和地衣芽孢杆菌更是广泛应用于畜产和水产饲料添加剂中,因此,筛选不同益生菌株,并增强其降解ZEN的功能,将具有重要应用价值。
2.3 ZJ-2019-1菌株对ZEN吸附与降解活性验证
将ZJ-2019-1菌株的活细胞与灭活细胞与10 mg/L ZEN共培养,检测ZEN在共培养上清液和菌体细胞中的含量,判断菌株对ZEN的清除作用是降解还是吸附。经检测,活细胞、灭活细胞、活细胞上清液和灭活细胞上清液中的ZEN含量分别为(6.2±2.1)%、(47.3±4.7)%、(16.1±3.6)%和(54.0±3.8)%。实验结果表明,活细胞反应体系中ZEN的清除率均高于灭活细胞体系,说明除吸附作用外,活细胞对ZEN还有降解作用。而活细胞中ZEN含量远低于灭活细胞中ZEN含量,原因可能是加热灭活过程破坏了细菌细胞壁的结构,使得细胞壁变薄而孔径增大,从而增强了吸附真菌毒素的能力[17,18]。同时,活细胞上清液中的ZEN含量远低于灭活细胞上清液中的ZEN含量,这表明ZJ-2019-1菌株活细胞对ZEN的清除主要是降解作用。
2.4 ZJ-2019-1菌株降解ZEN的活性成分定位
由图3可知,ZJ-2019-1的无细胞上清液对ZEN的降解活性远高于细胞内容物,说明降解ZEN的活性物质主要存在于胞外。将无细胞上清液经过不同的失活处理后,其对ZEN的降解效率均有不同程度下降。经100 ℃水浴或者SDS失活处理后,无细胞上清液对ZEN的降解率均降低了50%左右,但仍保留了一部分降解活性,说明降解ZEN的活性物质对高温有一定的耐受性。Shu等[19]筛选的一株贝莱斯芽孢杆菌(BacillusvelezensisDY3108)的无细胞上清液能够高效降解黄曲霉毒素B1,且上清液经过沸水浴或121 ℃高压蒸汽处理30 min后仍有很高的降解活性,本研究筛选的枯草芽孢杆菌产生的作用于ZEN的活性物质可能与其具有相似的热稳定性。当用蛋白酶K处理后,无细胞上清液对ZEN的降解率下降至24.0%,而用蛋白酶K和SDS共同处理后,降解活性则基本丧失,说明能降解ZEN的胞外活性物质能够被蛋白酶K水解而失活,由此推断该活性物质可能是ZJ-2019-1分泌的胞外酶[20]。

注:处理组1为100 ℃水浴2 h;处理组2为SDS处理;处理组3为蛋白酶K处理;处理组4为蛋白酶K和SDS共同处理。图3 ZJ-2019-1菌株活细胞和灭活细胞对ZEN的去除效果
2.5 不同因素对ZJ-2019-1菌株降解ZEN的影响
图4显示了反应时间、温度、初始pH和ZEN浓度等因素对ZJ-2019-1菌株降解ZEN的影响。从图4可看出,ZJ-2019-1菌株对ZEN的降解率随着时间的增加而增加,在48 h内可以将LB培养基中10 mg/L ZEN清除99.7%,且降解速率在24 h后趋于平缓,原因可能是24 h后菌体开始进入衰亡期,产酶活性下降。此外,培养基中底物的浓度减小也会导致降解速率下降[6]。温度对ZJ-2019-1降解ZEN的效率有较大影响,37 ℃为该菌降解ZEN的最适温度。当温度低于37 ℃时,该菌株对ZEN的降解率随温度降低而降低。ZJ-2019-1菌株具有广泛的pH适应能力,在初始pH 5.0~9.0时对ZEN均保持很高的降解活性。在初始pH为4.0时,ZJ-2019-1对ZEN的降解率明显降低,初始pH 7.0为ZJ-2019-1降解ZEN的最适pH。ZEN的初始质量浓度对降解效果也有影响,当ZEN的初始质量浓度不超过20 mg/L时,ZJ-2019-1对ZEN的降解率高于95%,而当ZEN的初始质量浓度为40 mg/L时,ZEN的清除率明显降低。

图4 不同因素对ZJ-2019-1菌株降解ZEN的影响
3 结论
通过富集驯化的方法从猪粪便中分离出一株能够高效降解ZEN的菌株ZJ-2019-1,通过形态和16S rDNA分析的方法,初步鉴定为枯草芽孢杆菌。该菌株在LB培养基中48 h内能将10 mg/L的ZEN去除99%以上。对降解机理的研究表明,该菌株可以通过吸附和酶降解共同清除ZEN,其中酶降解为主要作用。该菌株对ZEN的降解活性受反应温度、pH和ZEN浓度的影响,降解反应的最适温度和初始pH分别为37 ℃和7.0。本研究中所获得的的枯草芽孢杆菌可为霉菌毒素的生物脱毒提供新的研究材料,在本研究基础上,我们将进一步对降解产物进行结构鉴定和毒性研究,同时也将对降解酶进行分离纯化。
