慢性肾脏病患者外周血胎球蛋白A水平与血管钙化的相关性
2020-09-03陈继红
陈继红
(西平县人民医院 检验科,河南 驻马店 463900)
血管钙化是慢性肾脏病(chronic kidney disease,CKD)的常见并发症,指发生于心血管系统软组织内的生物钙化,表现为磷酸钙盐沉积,多数以羟基磷灰石的形式存在[1]。目前有关CKD患者并发血管钙化的机制尚不明确,缺乏有效的早期诊断及预防措施,而血管钙化持续加重可增加心脑血管疾病的发生风险,有一定的致死率。针对上述情况,对CKD患者血管钙化机制及影响因子进行研究具有重要意义。有研究指出,外周血胎球蛋白A可能与血管钙化存在某种联系[2]。胎球蛋白A是由肝脏分泌的一种酸性糖蛋白,被释放到血液中,广泛存在于细胞外液。作为一种循环钙化抑制剂,胎球蛋白A可抑制瓣膜及血管钙化,在CKD病情进展中发挥着重要的作用[3]。目前有关胎球蛋白A水平与血管钙化的相关性暂无统一定论。鉴于此,本研究探讨CKD患者外周血胎球蛋白A水平与血管钙化的相关性,具体如下。
1 资料与方法
1.1 一般资料回顾性分析2018年7月至2019年7月西平县人民医院收治的70例CKD患者的临床资料。按照有无血管钙化将患者分为无钙化组(29例)和钙化组(41例)。选取同期于西平县人民医院进行体检的30名人员作为对照组。对照组男18例,女12例,年龄50~78岁,平均(62.31±5.42)岁,无原发病。无钙化组:男19例,女10例;年龄49~80岁,平均(62.52±5.18)岁;糖尿病肾病6例,高血压肾小动脉硬化7例,慢性肾小球肾炎11例,其他5例。钙化组:男27例,女14例;年龄51~79岁,平均(62.18±5.89)岁;糖尿病肾病9例,高血压肾小动脉硬化11例,慢性肾小球肾炎14例,其他7例。3组性别、年龄比较,差异无统计学意义(均P>0.05)。
1.2 入选标准(1)纳入标准:①无钙化组和钙化组的患者符合有关诊断标准[4];②无钙化组和钙化组的为CKD 4~5期患者,行血液透析治疗,治疗方案相近;③临床资料齐全。(2)排除标准:①合并肾移植的患者;②合并急性肾衰竭的患者;③合并冠心病、心肌梗死、脑梗死的患者;④合并心律失常、心力衰竭的患者;⑤合并精神疾病的患者。
1.3 检查方法选用德国SIEMENS公司的ACUSON系列Sequoia512彩色多普勒超声诊断仪,依次检查患者双侧颈总动脉及分叉处、颈内外动脉,记录颈动脉内膜中层厚度(intima-media thickness,IMT)(≥1 mm代表增厚)。钙化标准:于纵轴和横轴图像的同一位置可见动脉壁增厚,超过相邻区域厚度的50%,回声不均匀。
1.4 观察指标(1)外周血胎球蛋白A水平。采集空腹外周静脉血5 mL,离心取血清,采用上海朗顿生物科技发展有限公司提供的试剂盒及双抗夹心酶联免疫吸附试验检测胎球蛋白A水平,正常范围为500~1 000 mg·L-1。(2)颈动脉IMT。
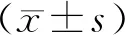
2 结果
2.1 胎球蛋白A、颈动脉IMT3组胎球蛋白A水平比较,差异有统计学意义(P<0.05)。钙化组胎球蛋白A水平低于对照组和无钙化组,无钙化组胎球蛋白A水平低于对照组(均P<0.05)。3组颈动脉IMT比较,差异有统计学意义(P<0.05)。钙化组颈动脉IMT大于对照组和无钙化组,无钙化组颈动脉IMT大于对照组(均P<0.05)。见表1。

表1 3组外周血胎球蛋白A水平、颈动脉IMT比较
2.2 外周血胎球蛋白A水平与血管钙化的相关性经Pearson相关性分析发现,外周血胎球蛋白A水平与颈动脉IMT呈负相关(r=-0.842,P<0.001)。
3 讨论
CKD的病程较长,可逐步进展终末期肾病,易引起血管钙化。目前有关CKD引发血管钙化的确切机制尚不明确,可能与高磷血症、高钙血症的发生有关。高磷血症在CKD 5期患者中广泛存在,部分细胞因子表达上调,导致磷摄入升高,细胞钙离子水平升高,引发钙沉积[5]。高钙血症可使平滑肌细胞在高磷、高钙的条件下出现钙盐沉积,造成主动脉钙水平升高,加重血管钙化程度[6]。
CKD患者血管钙化的类型主要包括主动脉钙化、冠状动脉钙化、外周血管钙化、心脏瓣膜钙化等。主动脉钙化可引起血管顺应性下降,僵硬度增加,引起脉压增大,左心室肥厚和左心室后负荷增加,加重冠状动脉缺血;冠状动脉钙化可造成心肌灌注减少,增加心律失常发生率,若斑块破裂或血栓形成还可引发心源性猝死;外周血管钙化多见于血管中膜,可增加血管壁僵硬度,降低顺应性,使脉压增加,引起左心室肥大及冠状动脉灌注不足,存在阻塞管腔的可能;心脏瓣膜钙化多见于长期维持性血液透析患者,主动脉瓣受累后导致心血管疾病风险升高[7]。CKD患者血管钙化的危害严重,可诱发冠心病、左心室肥大、心肌缺血及心力衰竭等多种心血管疾病。因此,需要分析CKD患者的血管钙化情况并实施有效治疗,以延缓血管钙化进程。目前临床可采用的手段包括血清学检查及影像学检查等,但仅可确诊患者有无血管钙化,难以明确患者血管钙化的严重程度,不利于治疗方案的制定。
有研究指出,在进行维持性血液透析的CKD患者中,胎球蛋白A水平与患者心脏瓣膜钙化程度有关[8]。但刘凌等[9]研究指出,胎球蛋白A水平与未透析CKD患者的血管钙化程度的关系暂不明确。本研究结果显示,钙化组胎球蛋白A水平低于对照组和无钙化组,无钙化组胎球蛋白A水平低于对照组,钙化组颈动脉IMT大于对照组和无钙化组,无钙化组颈动脉IMT大于对照组。经Pearson相关性分析显示,外周血胎球蛋白A水平与颈动脉IMT呈负相关。这表明胎球蛋白A水平与CKD患者血管钙化情况密切相关。临床医生可结合胎球蛋白A水平评估血管钙化情况,制定治疗方案。胎球蛋白A是一种近年被发现的钙化抑制物,在不同组织中呈现不均衡表达,在骨组织中存在高浓度聚集的现象[10]。胎球蛋白A的主要作用机制在于与钙、磷或基质Gla蛋白结合,促进可溶性蛋白矿物复合物生成,促进基质Gla蛋白表达,从而抑制磷灰石前体形成,阻碍其沉淀,预防钙化发生[11]。
胎球蛋白A作为一种负性的急性反应蛋白,可减少炎症因子释放,抑制炎症细胞激活,从而预防炎症对血管内皮造成损伤。但在炎症状态下,肝脏合成胎球蛋白A的功能受到抑制,溶菌酶的降解作用增强,导致胎球蛋白A水平降低,这对血管钙化也有一定的影响[12]。因此,随着炎症状态和血管钙化程度的加重,胎球蛋白A呈降低趋势。但胎球蛋白A在CKD未透析人群中的作用机制暂未明确,这可能与未进行透析的CKD患者的炎症状态及血管钙化的程度较轻有关。
综上所述,胎球蛋白A水平与CKD患者血管钙化呈负相关。临床医生可通过监测上述指标以采取对应的干预措施。
