酸性法高锰酸盐指数准确测定的影响因素探讨
2020-09-02杨力王钊陈任翔
杨力 王钊陈任翔
( 湖南省湘潭环境保护监测中心,湖南湘潭 411104)
1 引言
根据《 水质 高锰酸盐指数的测定》( GB 11892—89)的定义,高锰酸盐指数是指在一定条件下,用高锰酸钾氧化水样中的某些有机物及无机还原性物质,由消耗的高锰酸钾量计算相当的氧量[1]。高锰酸盐指数是反映水中有机污染物和可氧化性无机污染物的常用指标。 但高锰酸钾并不能氧化样品中的全部可氧化污染物, 高锰酸盐指数仅能反映在一定实验条件下样品中的可氧化污染物的含量[2]。因此,高锰酸盐指数的测定属于条件实验[3],测得的结果与实验条件密切相关,一旦实验条件发生变化,所测得的高锰酸盐指数就可能变化。本文从取样量、K 值范围、反应体系的酸度、水浴条件、空白值、滴定过程控制等方面分别进行探讨分析, 总结出测定高锰酸盐指数的各影响因素并获得准确测定的可靠经验。
2 实验部分
2.1 实验原理
高锰酸盐指数的测定原理是,在样品中加入一定已知量的KMnO4和H2SO4, 在沸水浴中加热30 min左右,KMnO4将样品中的部分有机物和无机还原性物质氧化,反应后再加入过量的Na2C2O4以还原剩余的KMnO4, 然后再用KMnO4标准溶液回滴过量的Na2C2O4。 实验中涉及的主要反应式[4]有:
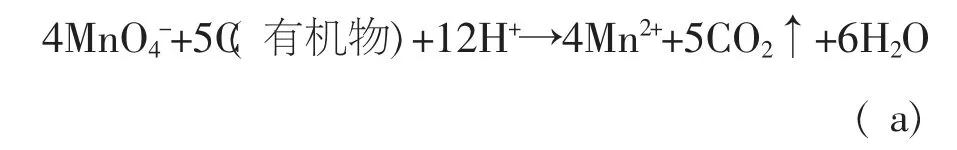
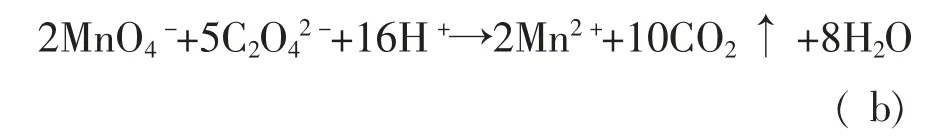
滴定结束后, 按照样品是否经过稀释分别通过下列公式计算得出样品中的高锰酸盐指数:
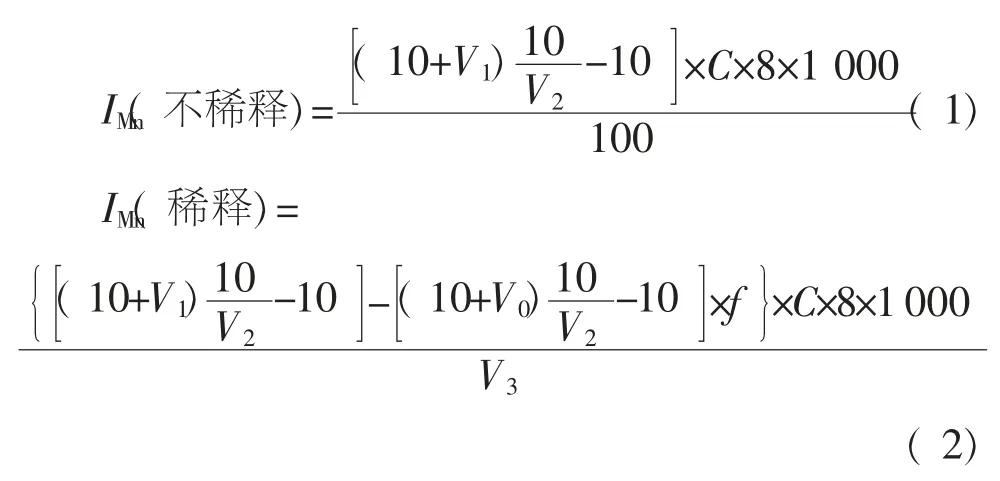
式中,V1为样品滴定时所消耗的KMnO4标准溶液的体积,mL;V2为标定时所消耗的KMnO4标准溶液体积,mL;C 为( 1/2Na2C2O4)标准溶液的浓度,0.010 0 mol/L;V3为所取样品体积,mL;V0为空白实验所消耗的KMnO4标准溶液体积,mL;f 为样品稀释过程中去离子水在100 mL 测定用体积内所占的比例。
KMnO4标准溶液的校准系数K 值为[5]:

2.2 主要仪器与试剂
2.2.1 仪器和材料数显恒温水浴锅;250 mL 锥形瓶;25 mL 棕色酸式滴定管;计时器;不锈钢直尺。
2.2.2 试剂
KMnO4标准溶液,C(1/5 KMnO4)略低于0.01 mol/L;硫 酸,优 级 纯;Na2C2O4标 准 溶 液,C( 1/2Na2C2O4)为0.010 0 mol/L。
2.3 实验步骤
2.3.1 样品的测定
吸取100.0 mL 经充分摇动、 混合均匀的样品( 或取适量样品,用水稀释至100 mL),置于250 mL锥形瓶中。 在锥形瓶中依次加入5 mL( 1+3)硫酸溶液和10.00 mL 的KMnO4标准溶液,摇匀。 放于沸水浴中约30 min( 水浴沸腾,开始计时)。 取出后加入10.00 mL 的0.010 0 mol/L Na2C2O4标准溶液至溶液变为无色。稍冷后,趁热用0.01 mol/L 的KMnO4标准溶液滴定至溶液刚出现粉红色,保持30 s 不褪,记录消耗的KMnO4标准溶液体积。
2.3.2 空白值的测定
用100 mL 水代替样品,按上述步骤测定,记录回滴KMnO4标准溶液的体积。
2.3.3 K 值的获得
向空白实验滴定后的溶液( 如果溶液温度低于60 ℃,将其稍微加热至80 ℃左右)中再次加入10.00 mL的0.010 0 mol/L Na2C2O4标准溶液。用KMnO4标准溶液继续滴定至溶液刚出现粉红色,并保持30 s 不褪,记录消耗的KMnO4标准溶液的体积。求得KMnO4溶液的K 值,按公式求出高锰酸盐指数值。
3 结果与讨论
3.1 取样量的确定
GB 11892—89 适用浓度范围较窄, 仅为0.5~4.5 mg/L,对于污染较严重的水,需要将水样适当稀释后测定。 取样量过小,KMnO4的量相对较大,将使测定结果偏高。取样量过大,反应液体系的氧化能力不足,将使测定结果偏低。 根据标准要求,样品量以加热氧化后残留的KMnO4为其加入量的1/2~1/3 为宜。 在实际测定时,对于需要稀释的样品,取样量应按照回滴过量Na2C2O4标准溶液时消耗的KMnO4标准溶液的体积在3~6 mL 之间确定。即稀释后的样品高锰酸盐指数应在2.2~4.5 mg/L 之间, 这样既能保证反应体系中有足够的氧化能力,又能减少滴定误差。
3.2 KMnO4 标准溶液浓度及K 值范围的确定
KMnO4标准溶液的浓度对空白值、K 值和样品测定结果影响非常大。它的主要影响有:当其浓度过低时,会增加滴定量,使滴定时间过长,体系温度过低,可能会使反应进行不完全,结果偏低;当其浓度过高时,在空白实验中,加入的Na2C2O4标准溶液不能完全还原剩余的KMnO4,溶液的颜色仍呈紫红色,无法进行回滴; 此外,KMnO4标准溶液浓度较高时,不利于滴定终点的掌握,容易造成滴定过量,导致误差增大。
根据实际分析中确定的KMnO4标准溶液浓度适宜范围及K 值的计算公式, 确定K 值在0.975~0.995 之间较为合适。
3.3 反应体系酸度的影响
从反应式( a)和( b)可以看出,酸性法测定高锰酸盐指数属于氧化还原反应,2 个反应式中均有氢离子参与反应。 因此反应体系的酸度对反应过程中各元素存在的价态以及反应速度和方向均有较大影响。 若酸度过低,反应速度缓慢,使高锰酸盐指数测定值偏小。 同时,还可能使KMnO4被还原后生成褐色的MnO2沉淀,反应不能按一定的计量关系进行。根据反应速率公式[6],当酸度增加,即氢离子浓度升高时,将大大加快反应式( a)向右进行,促进KMnO4的还原分解,使高锰酸盐指数测定值偏大,见表1。其他条件不变时,理论上氢离子浓度增加10%,反应瞬时速率增大2 倍。 同时,若酸度过高,氢离子会与Na2C2O4反应,使草酸根发生分解[7],影响测定结果。要使高锰酸盐指数测定准确, 一般氢离子浓度应在0.5~1.0 mol/L,而国标要求测定时( 1+3)硫酸的添加量为5±0.5 mL,即氢离子浓度约为0.5 mol/L。 由于加酸量属于本实验中较容易控制的操作点, 为保证反应的有效进行及实验条件的稳定, 溶液中的加酸量宜固定为5.0 mL。
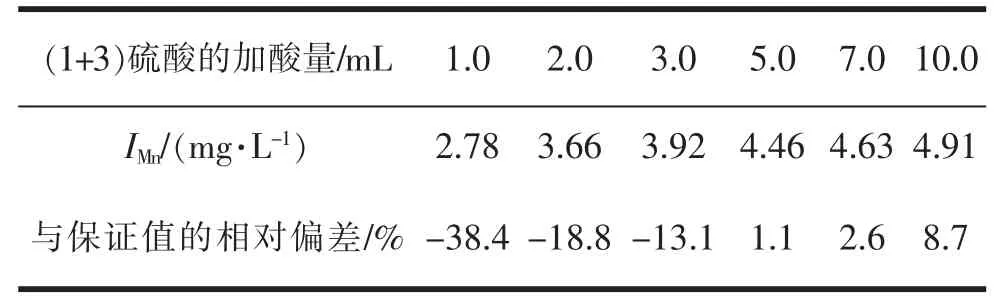
表1 不同加酸量的影响
3.4 水浴加热条件的确定
水浴加热条件主要包括3 个方面: 水浴加热温度和时间、水浴液面高度以及水浴锅的水质。
水浴加热时间和温度能直接影响氧化还原反应的最终效果。 根据GB 11892—89,水浴加热温度为沸水浴,时间为30±2 min( 水浴沸腾,开始计时)。 若水浴加热时间不足,将会导致反应不充分,使测得的高锰酸盐指数偏低。 反之,若水浴加热时间过长,将会使测得的高锰酸盐指数偏高。 市售水浴锅有多种规格,包括单孔、双孔、4 孔、6 孔和8 孔等。多孔特别是6 孔以上的水浴锅,常出现精密度不好的情况。原因是水浴锅内的加热管是U 形,会产生受热不均匀,离加热管较远的位置可能达不到水的沸点, 甚至仅为96~97 ℃。当不同位置水温不一致时,应将样品放在水温相同的位置进行水浴, 或在同一位置加热所有样品,这是保证测定精密度的关键。当出现水温低于沸点时, 可通过适当延长水浴加热时间来进行修正,见表2。 同时,实际操作时还应根据水浴锅功率、散热情况、室温等实际情况合理调整水浴加热时间。
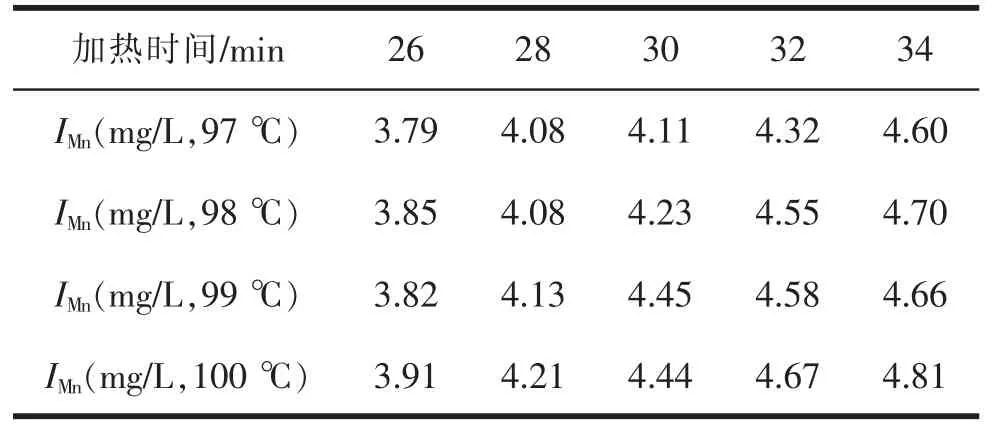
表2 不同加热温度和时间的测量结果
对于水浴液面高度主要控制2 个方面: 一是水浴液面应高于样品溶液液面, 防止加热过程中样品反应体系受热不均; 二是需要考虑整个实验过程由于蒸发损失导致的水浴液面下降。因此,水面高度应按照样品数量和整个实验时间留有一定的裕量,可配备一把不锈钢直尺, 在实验前将水加到合适的高度。
水浴锅中所加水通常是自来水, 它常含有少量盐类,长期使用后会使盐类逐渐富集。 另外,水浴锅内的锈渣也会有一部分溶解在水中。 这些盐类可能会使水的沸点发生变化, 导致高锰酸盐指数测定结果出现偏差。 因此,水浴锅中的水应定期进行更换。
3.5 空白试验
高锰酸盐指数的计算涉及2 种情况: 一种是直接测定的,采用不稀释的公式( 1);当高锰酸盐指数较大时,样品需要稀释,需采用稀释公式( 2)。采用公式( 2)的目的主要是为了减去稀释水的空白值,减少测定误差。 实际水样分析时可按照是否稀释分别代入上述2 个公式进行计算, 但在分析高锰酸盐指数标准物质时存在2 种情况: 一种是标准物质以安瓿瓶中的原样进行定值, 另一种是标准物质以定容至容量瓶中的溶液进行定值。 不同厂家的标准物质定值方法不同, 而这2 种情况对空白值的要求截然不同。
对于以安瓿瓶中的原样进行定值的标准物质,以及需要稀释的实际水样,空白值可相对放宽;而对于以定容至容量瓶中的溶液进行定值的标准物质,则空白值应相对严格, 以减小误差。 实验对比了按GB 11892—89 制备的“ 不含还原性物质的水”、蒸馏水、超纯水、市售的几种纯净水后发现,空白值范围均在0.18~0.45 mg/L 之间,见表3。 空白值不为0 可能基于2 个原因, 一是所选的实验用水中还存在少量的还原性物质;二是由于KMnO4在加热条件下发生了少量分解。 一般而言,空白值不宜超过0.30 mg/L。

表3 几种实验用水的空白值对比 mg/L
3.6 滴定过程的控制
3.6.1 滴定温度的控制
Na2C2O4在高于90 ℃时会发生分解[8],即:2H++C2O42-=CO2+CO+H2O, 使反应不能按计量关系进行。因此,将样品从水浴锅取出后应轻轻摇晃,稍微冷却10~20 s。 然后再加入Na2C2O4标准溶液,此时溶液的温度一般在78~83 ℃,方可进行滴定操作。
3.6.2 滴定速度的控制
一般分析项目的滴定操作应遵循“ 成滴不成线”的原则,滴定速度越慢越有利于反应充分进行。但对于高锰酸盐指数的测定,KMnO4与Na2C2O4的反应在60~80 ℃的温度范围内才能正常进行[9]。 若反应温度低于60 ℃,则反应速度进行缓慢,影响定量。因此滴定操作时间不宜过长, 须在2 min 内完成。KMnO4被还原的过程属于自催化反应, 生成的Mn2+对反应本身起催化作用。反应初始速度很慢,当生成一定量的Mn2+后反应速度迅速加快。因此,在开始时可按约1 滴/s 的速度滴4~6 滴, 使之生成足够的Mn2+;随后,加快速度按约2 滴/s 的速度滴定至接近终点;最后3~5 滴缓慢逐滴加入直至终点。整个滴定过程按“ 慢—快—慢”的速度进行。至滴定终点时,溶液温度一般在63~75 ℃范围内,符合要求。
4 结论及建议
高锰酸盐指数测定的不是水样中能够被氧化的物质的总量, 而是在一定条件下能被氧化的物质的量。 它与实验条件密切相关, 一旦实验条件发生变化,测得的高锰酸盐指数就会变化。即任意实验条件下都能测得一个高锰酸盐指数, 但测得的高锰酸盐指数未必是“ 准确的”高锰酸盐指数。 控制实验条件的主要目的是为了减少实验误差, 提高测定结果与标准的“ 符合性”。通过大量实验分析,建议采取以下措施使测定结果的精密度、 准确度和可比性满足质控需要:
( 1)对于需要稀释的样品,取样量应使回滴过量Na2C2O4标准溶液时消耗的KMnO4标准溶液体积在3~6 mL 之间。
( 2)为有效节省滴定时间及减小滴定误差,应配制合适浓度的KMnO4标准溶液,控制K 值在0.975~0.995 之间。
( 3)加酸量在一定范围内均能够保证反应有效进行,但考虑到实验条件的稳定性,反应液中( 1+3)硫酸的加入量宜固定为5.0 mL。
( 4)水浴加热条件包括3 个方面:水浴液面应考虑反应体系均匀受热和实验过程的蒸发损失, 合理留有裕量;鉴于水中盐分的富集,应定时更换水浴锅内的水;不同水浴锅的功率、水温和散热情况不同,应根据实际情况适当调整水浴加热时间。 同时采用标准物质进行验证, 确保在该加热条件下测定值的精密度和准确度符合要求。
( 5)对于以安瓿瓶中的原样进行定值的标准物质,以及需要稀释的实际水样,空白值可相对放宽;而对于以定容至容量瓶中的溶液进行定值的标准物质,空白值不宜大于0.30 mg/L,以减小误差。
( 6)滴定过程应把握“ 稍冷不过冷”的原则。样品从水浴锅取出后应经10~20 s 稍冷, 使温度下降到90 ℃以下,防止Na2C2O4分解。 滴定应按“ 慢—快—慢”的速度进行,整个滴定过程控制在2 min 内,避免温度过冷至60 ℃以下。
综上所述, 影响酸性法高锰酸盐指数准确测定的因素有很多,这些因素在一定范围内可调。当确定好实验条件及操作细节, 并经标准物质验证其结果准确可行后,宜固定采用,而不应随意改变,使分析数据稳定可靠。
