miR-99a对类风湿性关节炎及TH17/Treg细胞的影响
2020-09-02李佳莹刘暘内蒙古医科大学附属医院风湿免疫科呼和浩特010050
李佳莹,刘暘(内蒙古医科大学附属医院风湿免疫科,呼和浩特 010050)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以慢性炎症、持续性滑膜炎和滑膜关节破坏为特征的自身免疫病[1-2]。辅助性T 细胞17(T helper cell 17,TH17)及其效应细胞因子是炎症、自身免疫和变态反应的关键参与者,并与调节性T细胞(regulatory cells, Tregs)的活性密切相关,共同参与了RA的调节[3]。目前,RA患者仍然没有十分有效的治疗方法,因此迫切需要阐明RA的分子机制,以寻求RA的潜在治疗靶点。
研究表明,RA患者T细胞或外周血单核细胞(PBMC)中miRNA的表达调控与炎症和先天免疫有关[4-6]。在原发性免疫血小板减少症患者中,miR-99a通过抑制TH17促进因子——哺乳动物雷帕霉素靶蛋白(mTOR)的表达,导致患者体内TH17/Treg失衡;而血浆或血清中miR-99a的表达水平显著升高,可能作为卵巢癌等肿瘤疾病的前瞻性生物学标志物[4,7]。miR-99a的表达是否影响RA患者TH17/Treg的调节失衡目前尚不清楚。因此,本研究旨在通过检测miR-99a、TH17/Treg相关的细胞因子、转录因子以及炎症相关因子,分析RA患者miR-99a表达与TH17/Treg失衡之间的相关性,以寻找RA的可能发展机制。
1 材料与方法
1.1研究对象 收集2014年5月至2019年5月在我院就诊的RA患者80例作为病例组,男16例,女64例,年龄(46.5±14.8)岁,均符合美国风湿病协会(ACR)2010年修订的RA诊断标准[8]。排除有严重肝病、糖尿病、肾病、甲状腺、心脏、肿瘤疾病者,以及全身性使用高剂量激素患者或有长期吸烟、饮酒史的人群。按照疾病的活动性评分(DAS28)分为活动期RA组[42例,男8例,女34例,年龄(40.3±12.4)岁],稳定期RA组[(38例,男8例,女30例,年龄(44.1±13.7)岁]。收集同期于体检中心就诊的体检健康者42例作为健康人对照组,男16例,女26例,年龄(43.9±13.3)岁。3组受试者年龄和性别差异均无统计学意义(P>0.05)。本研究经内蒙古医科大学附属医院医学伦理学委员会批准(No.WZ2020008),所有研究对象均知情同意。
1.2主要仪器及试剂 FACS Calibur流式细胞仪(美国BD公司),PT-3502型酶联仪(北京普天新桥公司),ABI 7500实时荧光定量PCR仪(美国Applied Biosystem公司),Synegene凝胶成像系统(英国 Syngene 公司)。Ficoll试剂、逆转录试剂盒、CD4+T细胞分离试剂盒、胎牛血清、蛋白转运抑制剂BFA、SYBR实时荧光定量试剂盒、Trizol试剂(北京索莱宝公司),IL-17、IL-6、TFN-α、IFN-γ、IL-4和IL-10 ELISA检测试剂盒(上海恒远生物科技公司),兔抗人RORγt多克隆抗体、兔抗人FoxP3多克隆抗体和兔抗人β-actin多克隆抗体、HRP标记的山羊抗兔二抗、FITC标记的小鼠抗人CD4抗体、PE-Cy5标记的小鼠抗人CD25单克隆荧光抗体、PE标记的小鼠抗人CD4抗体、PE标记的兔抗人IL-17抗体、羊抗兔IgG二抗、ECL Plus试剂、蛋白质裂解液(武汉三鹰生物技术公司)。
1.3标本采集及细胞分离 采集各患者就诊时和健康人体检时的空腹静脉血10 mL,肝素(20 U/mL)抗凝。新鲜血液于2 h内2 000×g离心10 min,取上清液,置于-20 ℃保存。其余血液采用密度梯度离心法,按照Ficoll试剂说明书分离PBMC,PBS洗涤3次后备用。
1.4流式细胞术分选TH17和Treg细胞 取1.3中的各组PBMC 5 mL,按照CD4+T细胞分离试剂盒及FACS Calibur流式细胞仪说明书操作检测CD4+T淋巴细胞亚群。
1.4.1TH17细胞测定 取1.3中分离得到的PBMC,用PBS重悬至1×106/mL,在细胞悬液中加入新鲜配制的细胞活化液。取PBMC悬液至24孔细胞培养板内,置于37 ℃、5%CO2培养箱中温育5 h。活化后的细胞加入FITC标记的小鼠抗人CD4抗体(1∶1 000稀释),室温避光温育20 min。加入PE标记的兔抗人IL-17抗体(1∶1 000稀释)。同时设同型管加入等量同型对照抗体(小鼠抗人IgG1)用于确认抗体特异性及调节荧光补色,加入PE标记的山羊抗兔IgG二抗(1∶1 000稀释),采用FACS Calibur流式细胞仪及配套的Cellquest软件分析结果,每个样本分析1×106个细胞,以CD4+IL-17+在CD4+T细胞中的百分比表示为TH17细胞比率。
1.4.2Treg细胞测定 取上述PBMC细胞悬液,加入PE标记的小鼠抗人CD4抗体(1∶1 000稀释)和PE-Cy5标记的小鼠抗人CD25单克隆荧光抗体(1∶1 000稀释),室温避光温育15 min。加入FITC标记的兔抗人Foxp3多克隆抗体(1∶1 000稀释),同时设同型管加入等量同型对照抗体(小鼠抗人IgG1)用于确认抗体特异性及调节荧光补色,采用FACS Calibur流式细胞仪及配套的Cellquest软件分析结果,以CD4+CD25+FoxP3+在CD4+T细胞中的百分比表示为Treg细胞。
1.5ELISA法检测血清细胞因子 按照IL-17、IL-6、TFN-α、IFN-γ、IL-4和IL-10 ELISA检测试剂盒说明书操作,采用PT-3502型酶联仪在450 nm处检测吸光度(A)值,并绘制标准曲线。结果判读:IL-4:62.50~2 000 pg/mL,IL-6:6.25~200 pg/mL,IL-10:9.4~3 000 pg/mL,IL-17:62.50~4 000 pg/mL,TFN-α:16.80~1 000 pg/mL和IFN-γ:46.80~3 000 pg/mL。
1.6miR-99a及相关转录因子检测 严格按照Trizol试剂说明书提取1.3中5 mL PBMC中的总RNA,用 NanoDrop 2000 超微量分光光度计检测RNA的浓度和纯度,取吸光度 (A260/280 nm)为1.8~2.0的样本,按照逆转录试剂盒说明书将RNA逆转录为cDNA,样本置-20 ℃保存。根据 Genbank 数据库中公开发表的基因序列,采用Primer Premier 5.0引物设计软件设计,并由上海生工公司合成。引物序列见表1。采用 ABI 7500实时荧光定量PCR仪检测miR-99a的表达,以U6作为内参照,PCR总反应体系为20 μL,包括:0.3 mmol/L dNTPs 2.0 μL,1× GC-I buffer 2.0 μL,10 μmol/L上、下游引物各1.0 μL,TaqDNA聚合酶1.0 U,模板DNA 1.0 μL,ddH2O补足至20 μL。循环参数:95 ℃ 5 min;94 ℃ 15 s,58 ℃ 30 s,70 ℃ 34 s,共40个循环。RORγt和FoxP3mRNA检测以β-actin作为内参照,反应体系同上,循环参数:95 ℃ 10 s;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s,共40个循环。使用Step OneTM软件采集荧光信号并进行熔解曲线分析,各基因的相对表达水平用Ct表示,并以2-△△Ct法计算。每组设3个复孔,试验重复3次。
1.7western blot检测RORγt和FoxP3蛋白 取各组PBMC 5 mL,经蛋白质裂解液充分裂解后,用BCA法测定蛋白质浓度,按50 μg的总蛋白质量进行聚丙烯酰胺凝胶电泳(积层胶采用80 V电压,分离胶采用160 V电压),电泳结束后在350 mA恒流条件下4 h,将蛋白质转移至PVDF膜上。转膜结束后将膜置于50 g/L脱脂牛奶中室温封闭2 h,分别加入兔抗人RORγt多克隆抗体(1∶1 000稀释)、兔抗人FoxP3多克隆抗体(1∶1 000稀释)和兔抗人β-actin多克隆抗体(1∶1 000稀释),4 ℃温育过夜。加入HRP标记的山羊抗兔IgG二抗(1∶2 000稀释),室温温育2h,TBS-T漂洗,按照ECL Plus试剂说明书进行显色及成像。采用Synegene凝胶成像系统扫描目的条带的灰度值,以β-actin为内参照,试验重复3次。
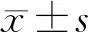
2 结果
2.1RA患者TH17和Treg细胞的检测结果 活动期和稳定期RA患者的TH17细胞数显著多于健康人对照组,且活动期RA患者的TH17细胞数显著多于稳定期RA患者(P均<0.01);Treg细胞数在活动期和稳定期RA患者中的差异无统计学意义(P>0.05),但与健康人对照组相比,稳定期患者和活动期患者的Treg细胞数均显著升高,见表2。

表2RA患者和健康人对照组TH17和Treg细胞的检测结果
2.2RA患者特异性转录因子RORγt和FoxP3mRNA及蛋白质的表达情况 活动期和稳定期RA患者RORγtmRNA和蛋白质的表达量显著高于健康人对照组;而活动期RA患者FoxP3mRNA和蛋白质表达量显著低于稳定期RA患者和健康人对照组,但健康人对照组与稳定期RA患者间的差异无统计学意义(P>0.05),见表3。

表3RA患者和健康人对照组RORγt和Foxp3 mRNA及蛋白质的表达
2.3RA患者各种细胞因子的表达水平变化 活动期和稳定期RA患者血清IL-17、IL-6、TNF-α、IFN-γ的表达水平均显著高于健康人对照组,且活动期RA患者显著高于稳定期RA患者(P均<0.01)。而活动期和稳定期RA患者血清IL-10和IL-4的表达水平均显著低于健康人对照组,且活动期RA患者显著低于稳定期RA患者(P均<0.01),见表4。

表4RA患者和健康人对照组各细胞因子水平比较
2.4RA患者TH17及Treg细胞中miR-99a的表达比较 活动期RA患者的TH17细胞中miR-99a表达水平显著高于稳定期RA患者,且二者均显著高于健康人对照组;活动期RA患者Treg细胞中miR-99a表达水平显著低于稳定期RA患者,且二者显著低于健康人对照组(P均<0.01)。此外,稳定期和活动期RA患者TH17细胞中miR-99a的表达水平显著高于Treg细胞(P<0.01),见表5。

表5RA患者和健康人对照组中miR-99a的相对表达水平
2.5TH17和Treg细胞中miR-99a的表达与其转录因子的相关性分析 Pearson分析结果表明,TH17细胞中miR-99a表达与RORγtmRNA 呈正相关(r=0.721,P<0.01),而Treg细胞中miR-99a的表达与FoxP3mRNA亦呈正相关(r=0.815,P<0.01)。
3 讨论
大量研究表明,TH17/Treg细胞的失衡可导致包括RA在内的炎性自身免疫性疾病,致使滑膜炎、关节软骨发生破坏,但其具体的调节机制目前尚不清楚。本研究发现,RA患者外周血中TH17细胞数增加,Treg细胞数减少,而非活动期RA患者外周血中TH17/Treg细胞比例显著高于健康人对照组,但明显低于活动期RA患者。此外,本研究发现在RA患者中TH17相关细胞因子如IL-17、IL- 6、TNF-α和IFN-γ的表达水平显著增加,Treg相关细胞因子IL-10的表达水平显著减少。这种失衡可能是由于淋巴细胞或脂多糖能够刺激单核细胞或者巨噬细胞分泌大量的炎症细胞因子,促进TH17细胞的分化,抑制Treg细胞的发育[4-6]。同时,本研究还发现在活动期RA患者中,TH17细胞特异性转录因子RORγt的表达量显著高于健康人对照组,Treg细胞特异性转录因子FoxP3的表达量显著低于健康人对照组。与Klein等[9]发现在RA患者中TH17细胞增加且与RORγt表达量密切相关的结果较为一致。表明RA患者TH17/Treg失衡与特异性转录因子RORγt和FoxP3有着密切的关系,并且证实改变RORγt和FoxP3的表达可能是调节TH17/Treg细胞失衡的新机制。
为了进一步探究RA与TH17/Treg细胞失衡的调节机制,我们检测了RA患者和健康人群外周血中miR-99a的表达,并分析了TH17/Treg细胞失衡与miR-99a的相关性,结果显示,在TH17细胞中,稳定期RA患者miR-99a的表达水平显著高于健康人对照组,而在Treg细胞中,稳定期RA患者miR-99a的表达显著低于健康人对照组。但无论RA患者在活动期还是稳定期,TH17细胞中miR-99a的表达水平均显著高于Treg细胞。Zhu等[10]研究证实,miR-99a是一种抑制基因,可以通过调控T细胞的活化抑制细胞增殖,诱导细胞凋亡,与本研究结果较为一致。本研究还发现在RA患者中,miR-99a可能通过影响TH17/Treg细胞的失衡从而加速疾病进程。因此,检测miR-99a的表达水平可能是一种早期诊断和监测RA进展的潜在指标。
Jaiswal等[11]研究发现,miR-99a可能参与调控TNF-α等炎症因子。本研究检测了不同人群中炎症相关因子的表达情况,并分析TH17/Treg细胞失衡的相关性。结果显示, IL-17、IL-6、TNF-α和IFN-γ等TH17细胞相关因子在RA患者中的表达水平显著高于健康人对照组,且与miR-99a的表达密切相关。故而推测miR-99a可能通过促进TH17细胞增殖、Treg细胞凋亡,致使TH17/Treg 细胞调节失衡,进而影响了机体炎症相关因子的表达,促进了机体炎症的发生,最终加速了RA的进程。本研究还发现,miR-99a的表达水平与TH17细胞转录因子RORγt的表达水平呈正相关,与Treg细胞转录因子FoxP3的表达水平亦呈正相关。故而认为miR-99a可能通过调节RORγt和FoxP3的表达水平,进而导致TH17/Treg细胞的不平衡。然而,该推论还需进一步的研究验证。
综上所述,本研究发现miR-99a可能通过调节RORγt和FoxP3的表达,影响RA患者TH17和Treg细胞的免疫调节机制,对于临床诊断、筛选靶标分子具有指导意义。然而,本研究尚存在一些局限性。例如多项研究表明,RA患者外周血中miR-99a、miR-132、miR-146和miR-155的表达水平均高于健康人对照组[4-6]。但由于条件限制,本研究未能检测其他miRNA在RA患者中的表达水平,其与TH17/Treg细胞比例或相关性关系尚有待进一步研究证实。其次,本研究纳入的例数偏少,今后还需要在更大样本量的基础上分析miR-99a的功能作用并进一步验证转录因子RORγt和FoxP3的调节机制。
