消融指数指导心房颤动导管消融的短期疗效及安全性∗
2020-09-02王温立邹操李勋林佳杜小娇孙世坤宣勤考孟晶蒋廷波
王温立 邹操 李勋 林佳 杜小娇 孙世坤 宣勤考 孟晶 蒋廷波
心房颤动(简称房颤)是临床上最常见的心律失常之一,导管消融已成为房颤治疗的有效手段之一,其中肺静脉电隔离(pulmonary vein isolation,PVI)是房颤导管消融的基石[1]。研究表明房颤消融术后复发主要原因是肺静脉和心房间电传导恢复,这归咎于消融点未实现连续透壁损伤[2]。近几年来研究表明,消融指数(ablation index,AI)是融合了功率、压力以及时间而得出的参数,在CARTO 三维系统指导下行射频消融时,可实时评估消融点的损伤程度,从而保证每个消融点透壁损伤[3]。国外研究表明,应用AI指导PVI可以明显提高肺静脉单圈隔离即刻成功率以及一年成功率[4-5],但国内文献报道不多。因此,笔者将采用CARTO3 三维标测系统、在AI指导下行房颤射频消融术,随访观察其疗效及安全性。
1 资料与方法
1.1 研究对象 前瞻性入选自2018年6月至2019年5月在苏州大学附属第一医院心内科行房颤射频消融术的患者116例[年龄(60.4±10.62)岁,男性67例],其中阵发性房颤患者75例和持续性房颤患者41例。所有患者术前均签署手术知情同意书。
其中患者入组标准:①患者年龄位于18~90岁之间;②术前有明确房颤发作常规心电图或24 h动态心电图;③房颤持续发作或房颤发作频繁且明显影响患者生活质量;④予以控制心室率治疗或者药物复律及电复律效果较差者;⑤术前已予以充分抗凝,并完善经食管超声明确左房内未存在血栓形成。排除标准:①3个月内曾发生过不稳定心绞痛或急性心肌梗死病史;②6个月内需要进行心脏外科手术者;③口服抗凝药治疗存在禁忌证;④严重的慢性肾脏或肝损伤;⑤既往曾予以导管消融。
1.2 术前准备 术前常规行经胸超声心动图检查(仪器型号为Vivid7彩色多普勒超声仪,探头频率1.7~3.4 MHz),并于术前24 h内行食管超声检查,排除左房血栓;常规行左房重建,了解左房和肺静脉解剖结构形态以及食管毗邻关系。术前暂停抗凝药,常规低分子肝素皮下注射,每12 h 1次,桥接3~5天,并于术前12 h 停用一次。术前抗心律失常药物在阵发性房颤中停用,持续性房颤患者中不停用。合并其他疾病的患者予以相应治疗,如控制血压、控制血糖等。
1.3 手术过程 术中穿刺右侧颈内静脉送入10极冠状窦电极,穿刺右侧股静脉2次,送入SL1长鞘2根,经SL1长鞘穿刺房间隔2次,然后立即给予普通肝素,首剂是100 单位/公斤,随后每小时追加1000单位普通肝素。经其中一根SL1 长鞘送入Lasso电极(Biosense Webster,USA)至左上肺静脉;经另一根SL1行肺静脉造影。
所有患者均在CARTO3 三维标测系统定位下,通过SL1长鞘送入Smart Touch冷盐水灌注射频消融电极(Biosense Webster,USA),构建左房,左上、下肺静脉及右上、下肺静脉三维模型,确定肺静脉开口,并在肺静脉开口外0.5~1 cm 处设置肺静脉前庭环状消融线。全程采用呼吸门控;若导管稳定性满足移动范围≤2.5 mm、持续时间≥5 s,应用Visi Tag技术自动采点。
术中采用逐点消融方式(图1),点(3号点)与点间距离小于6 mm,压力保持在5~15 g;前壁功率30~35 W,后壁功率25~30 W,冷盐水流速17~25 ml/min,温度43℃。前壁和嵴部AI≥400 以及后壁、顶部和下壁AI≥300为消融目标。消融过程中采用芬太尼镇痛。阵发性房颤仅行PVI术;持续性房颤行PVI后,房颤不终止者,予以电复律;房颤持续时间大于2年或左房直径大于45 mm 者附加左房顶部线、前壁线或二尖瓣峡部线;患者既往或术中记录到典型心房扑动(简称房扑)者,则附加三尖瓣峡部线性消融。

图1 PVI逐点消融术示意图
消融终点包括:所有肺静脉内电位均消失,且起搏验证左房与肺静脉间传导双向阻滞,以及各消融线完全阻滞;若存在非肺静脉触发灶则予以消融隔离;观察20 min后肺静脉与左房间电传导未恢复。
1.4 术后随访 所有患者术后服用新型口服抗凝药或华法林抗凝2~3个月;若服用华法林者,调整国际标准化比值至2~3。阵发性房颤术后常规不服用抗心律失常药物;若阵发性房颤术前发作频繁者或持续性房颤者,服胺碘酮或普罗帕酮2~3个月后停用。每位患者每日自测脉搏3次;术后3个月时门诊复查超声心动图;术后定期与患者联系进行电话随访,随访内容包括胸闷、心悸等症状及药物服用情况,及时行常规心电图和动态心电图检查。消融成功标准:导管消融术3 个月空白期后未使用抗心律失常药物的情况下未发生持续时间>30 s的房性心律失常。
1.5 统计学分析 采用SPSS 20 统计软件进行数据统计分析。正态分布的计量数据均以±s 表示,组间比较采用t检验方法;非正态分布的计量资料以(M,Q1-Q3)表示,组间采用秩和检验;计数资料以率或构成比表示,组间比较采用卡方检验。应用Kaplan-Meier生存曲线分析房颤患者消融术后成功率。以P<0.05显示差异有显著性。
2 结果
2.1 房颤患者临床基线资料 共116例房颤患者入选本研究,其中阵发性房颤占64.7%,男性占57.8%,年龄(60.4±10.62)岁,体重指数(24.9±3.66)kg/m2,病程中位数为7 个月,CHA2DS2-VASc评分中位数为1分;房颤合并高血压、糖尿病及甲状腺功能异常的比例分别为52.6%(61/116)、5.2%(6/116)及23.3%(27/116);房颤合并器质性心脏病(SHD)比例为24.1%(28/116),其中持续性房颤伴SHD 者20例(包括15 例心动过速性心肌病者)。术前抗凝药物使用率达99.2%,其中新型口服抗凝剂占94.9%,华法林占4.3%。术前抗心律失常药物中胺碘酮占70.7%、普罗帕酮占25.9%、β受体阻滞剂占36.2%。
2.2 AI指导下肺静脉隔离及线性消融术式特征 肺静脉各节段后壁、底部、前壁、顶部、嵴部AI中位数分别为:359(346,379)、363(334,403)、434(390,458)、385(358,404)、449(409,461);另外左房顶部线、前壁线、二尖瓣峡部线以及右房三尖瓣峡部线AI中位数分别:405(399,407),408(387,425),443(416,455),412(401,420)。AI指导下肺静脉单圈隔离总成功率为91%、总消融时间为(60.8±10.6)min、每消融点FTI为(210.5±69.7)g.s、每消融点阻抗下降平均为(11.5±6.3)Ω(表1)。
2.3 AI指导下房颤消融的疗效和安全性 随访时间为(9.1±3.2)月,随访过程中有3例患者失访,包括2例阵发性房颤与1例持续性房颤患者;AI指导下房颤消融术后阵发性房颤患者成功率为90.4%(66/73),持续性房颤患者成功率为87.5%(35/40),log-rank检验P 值为0.69;房颤伴SHD 者成功率为75.8%(22/28),其中持续性房颤伴心动过速性心肌病者成功率为93.3%(14/15)。在围手术期及随访过程中,术中仅1例患者发生一过性脑缺血发作,2例(1.8%)患者术后心脏超声提示少量心包积液,无心包压塞、脑栓塞、肺静脉狭窄和心房食管瘘等严重并发症。
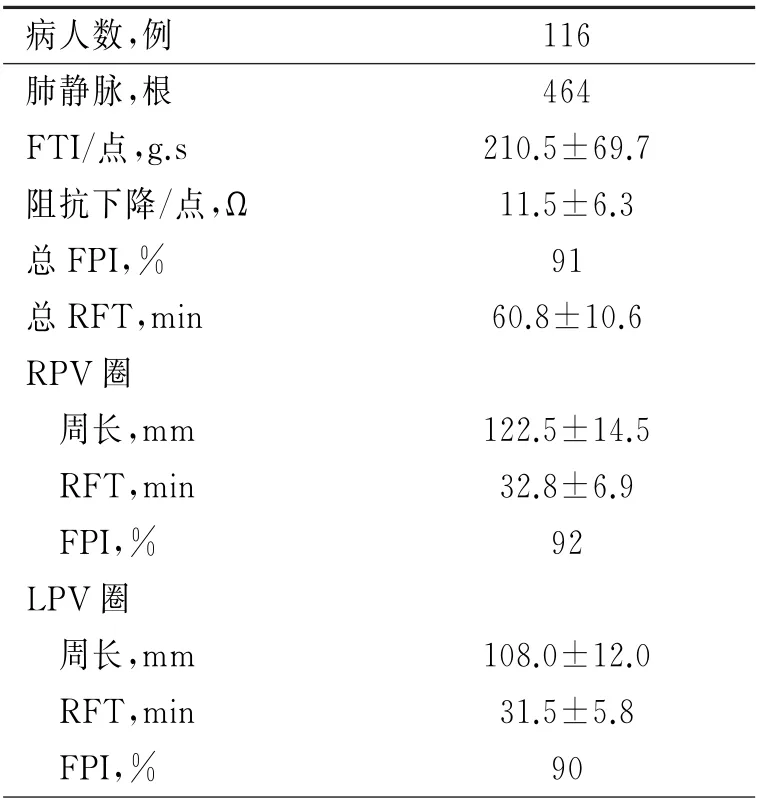
表1 AI指导下肺静脉隔离特征
2.4 AI指导下房颤消融对心脏结构和功能的影响 与术前相比,房颤未复发者消融术后左房内径[(41.0±5.2)mm vs(43.9±6.1)mm,P<0.01]和右房内径[(36.1±6.2)mm vs(39.5±5.1)mm,P<0.01]均明显缩小,而房颤复发者消融术前、术后心超指标差别无统计学意义。房颤伴心动过速性心肌病未复发组患者(n=16)左房和右房内径、左室收缩末径明显减小、射血分数明显增加(P<0.01)(表2);而在复发组病例只有3例,例数少未进行统计学处理。
3 讨论
本研究为一项单中心前瞻性研究,评估了Carto3 三维标测系统AI指导下房颤患者导管消融术后短期疗效及安全性。研究结果显示,AI指导下房颤导管消融可提高消融效率以及短期成功率,且无严重并发症。
自从应用压力监测导管指导房颤消融术后,房颤消融的安全性和1年成功率较非压力导管时代有所提高,但结果并不一致,仍然有20%左右的患者需要再次消融[6]。研究表明,压力指导下的肺静脉隔离急性期和晚期肺静脉心房间电传导恢复与消融点间不连续以及损伤深度不够有关[7]。Miller等[8]研究提示消融线上可见的gap对于肺静脉即刻隔离至关重要,而Park 等[9]研究表明在压力大于10 g的情况下,消融点间距大于5 mm 的位置与急性期肺静脉电传导恢复相关。SMART-房颤研究[10]亚组分析显示,40例阵发性房颤患者消融点间距离与成功率(33%~93%)明显负相关。但在“冰与火”的研究中,阵发性房颤采用逐点消融术式单次成功率仅为64%[11],提示除了间距外,每个消融点还需保证足够的能量输出和透壁损伤。
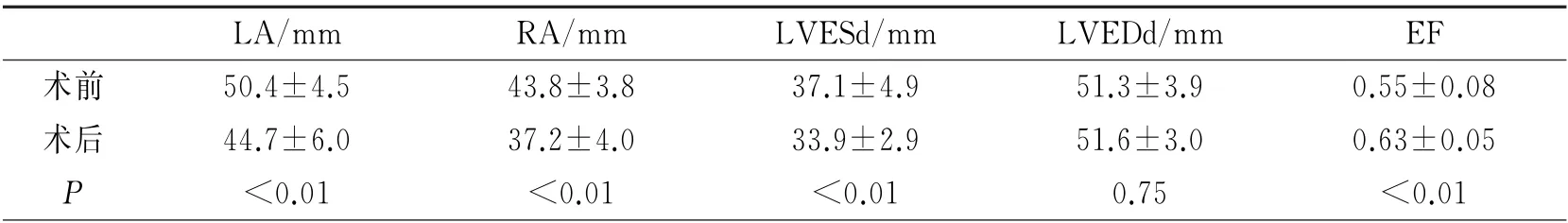
表2 房颤伴心动过速性心肌病未复发者消融术前、术后心超指标的比较
AI指导下的逐点消融术式不仅不同于传统的“拖拽式”消融方法,而且能够量化射频能量输出,这点也优于单纯压力或FPTI指导下的消融策略。AI指数是一种融合了功率、压力和时间的消融参数,不同于FPTI只是这三种指标的简单整合,功率在计算AI函数公式中所占权重更大;即使在压力较低情况下,也可通过提高功率确保能量输出;而且AI值预测损伤深度与实测深度相差在1 mm 范围内,所以AI可以用来定量反应能量输出、实时评估消融损伤程度[12]。
基于以上研究,CLOSE-PVI研究按照前壁AI大于550、后壁AI大于400、消融点间距小于6 mm的手术方案,对130例阵发性房颤患者行PVI,肺静脉首次单圈隔离成功率98%、消融时间缩短50%、1年房颤未复发率为91.3%[4,13]。本研究中右肺静脉和左肺静脉消融圈周长都与前者相似,但肺静脉首次单圈隔离率91%,低于前者,且每圈消融时间长于前者,这可能与本研究AI目标值明显低于CLOSE-PVI研究有关,所以本研究中近10%的患者未能实现首次单圈隔离而需寻找gap、补点,从而延长了消融时间。
另外,Solimene等[5]按照前壁AI 400~450、后壁AI 300~350、消融点间距小于6 mm 手术方案,对156例阵发性和持续性房颤患者行肺静脉大环隔离,平均随访14 个月,未复发率分别为89.2%和78%。本研究中AI 目标值以及实测AI 值与Solimene等研究相近,所以阵发性房颤患者房颤消融术后未复发率也与之相一致。但本研究持续性房颤患者消融成功率为87.5%,高于Solimene等研究结果,这一现象可能与以下几个方面相关:首先本研究中持续性房颤患者合并心动过速性心肌病占37.5%,这类患者消融成功率为93.3%,术后心脏结构和功能都有所逆转,从而有助于维持窦性心律和减少房颤复发;其次本研究除了肺静脉前庭消融外还辅助一些心房线性消融,而后者仅行肺静脉大环消融;另外,本研究随访时间相对较短,我们还需进一步延长随访时间。
研究报道压力监测导管发生心包压塞率1.3~2.5%[14-15]。我们采用的Smart Touch压力监测消融导管,术中压力控制在5~15 g之间,并实时监测AI目标值,从而避免了过度消融致心包压塞。心房-食道瘘是房颤导管消融术中最严重的并发症[16]。文献报道这种并发症极少见,多于术后5~7 天发现,然而一旦出现几乎都是致命的。多数学者认为,心房-食道瘘的发生可能主要与左房后壁消融的放电损伤过重和消融部位不当有关。本研究中,我们术前左房重建时将食管重建,了解食管与左房后壁、左右肺静脉的毗邻关系;在后壁消融过程中除了尽可能避开食管位置外,我们在此区域消融时功率25~30 W、压力5~10 g、AI300~350,消融时间基本在20 s以内;通过这些方法,到目前为止,我们未出现过心房-食管瘘。肺静脉狭窄为本类手术的另一常见并发症[17],公认与早期采用射频能量进行肺静脉内点消融、能量大于30 W、肺静脉口部的判断及消融部位较深有关。本研究术前每位患者都行心脏CT、左房重建,了解肺静脉形态、数量和结构变异,初步设计前庭消融线;术中建模时严格肺静脉定口,在肺静脉开口外0.5~1 cm 处行前庭消融;另外,在AI指导下肺静脉单圈隔离成功率较高、补点少;从而避免了肺静脉内的过渡消融而导致肺静脉狭窄。
由于AI仅融合了压力、功率、时间三种参数,不同的患者和术者间会有所差别。根据本研究中肺静脉不同节段实测AI值中位数、肺静脉单圈隔离率、短期疗效和安全性,我们认为,AI目标范围在后壁为300~380、顶部和底壁为350~400、前壁和嵴部为400~450是安全有效的,同样在三尖瓣峡部、左房顶部和前壁AI目标范围为400~420、二尖瓣峡部AI目标范围为400~450也是合理的。
由此可见AI指导下房颤导管消融可提高消融效率、短期成功率和安全性,但本研究也存在一定局限性。本研究随访主要通过常规心电图、24 h动态心电图以及患者主观症状,而没有持续监测心律,有可能低估了房颤的复发率;另外本研究是单中心的前瞻性研究,且样本数量偏少,随访时间短。我们将通过增加研究中心、病例数、延长随访时间以及7天的动态心电图,来克服这些局限性,并进一步评估AI指导下房颤量化消融的远期疗效。
