慢性肾脏病合并心房颤动的机制及其抗凝治疗∗
2020-09-02张玲董震宇汤宝鹏
张玲 董震宇 汤宝鹏
心房颤动(简称房颤)发病率随着年龄的增加而逐步上升,对人们的生活质量造成严重影响并造成极大的经济负担,其并发症如脑卒中、心力衰竭(简称心衰)等更严重危害着人们的健康[1]。慢性肾脏病(chronic kidney disease,CKD)常和房颤合并存在,CKD 和房颤相互作用引起严重后果,增加血栓性事件风险。CKD 合并房颤使患者发生心力衰竭、心肌梗死、卒中和死亡的风险增加了2~5倍[2-3]。目前已有多项研究揭示了CKD 合并房颤的机制和抗凝治疗,因此,笔者拟对此做一综述。
1 CKD合并房颤的患病率
CKD指对健康有影响的肾功能或结构异常,持续时间≥3个月。其中,肾小球滤过率(GFR)>90 ml/min/1.73 m2),同时肾损伤指标阳性的为1期;GFR 位于60~89 ml/min/1.73 m2之间为2期;GFR 位于30~59 ml/min/1.73 m2之间为3期;GFR 位于15~29 ml/min/1.73 m2之间为4期;GFR 低于15 ml/min/1.73 m2或患者接受透析为5期,亦被称为终末期肾病(ESRD)[4]。Zhou等[1]的统计结果显示,我国房颤患病率是0.65%,随年龄增长患病率增加,60 岁以上男女患病率分别增长至1.83%和1.92%,在80岁以上人群中高达7.5%。Zhang等[5]针对不同地区自然人群19 368例成年人(≥35岁)的横截面调查结果显示,我国房颤年龄校正后患病率为0.74%。据统计,我国成人CKD 患病率为13.2%[6]。
2008年的KAMS研究[7],为一项纳入41 417例患者的横断面研究,发现eGFR >75.5 ml/min/1.73 m2合并蛋白尿的房颤患病率为0.9%,eGFR 62.6~75.5 ml/min/1.73 m2的房颤患病率为1.2%,eGFR <62.6 ml/min/1.73 m2的患者房颤的患病率为2.8%。
2009年的Niijata研究[8],为一项纳入41 417例患者的前瞻性研究,发现eGFR 30~59 ml/min/1.73 m2的房颤患病率为5.10%,eGFR <30ml/min/1.73 m2的患者房颤的患病率为6.60%。
2010年开展的CRIC研究[9],为一项纳入3 267例患者的横断面研究,发现eGFR<60 ml/min/1.73 m2的3267例患者中,房颤的患病率为18%。
2011年的ARIC研究[10],为一项纳入41 417例患者的前瞻性研究,发现eGFR 15~29 ml/min/1.73 m2的房颤患病率为36%,尿微量白蛋白与肌酐比值30~299 mg/g的患者房颤患病率为15%,尿微量白蛋白与肌酐比值≥300 mg/g房颤患病率为26%。
2011年一项纳入26 917患者的横断面研究[11],发现eGFR >60 ml/min/1.73 m2合并蛋白尿的房颤患病率为1.2%,eGFR 30~59 ml/min/1.73 m2的房颤患病率为2.8%,eGFR <30 ml/min/1.73 m2的房颤患病率为4.2%。
2015年开展的NDR 研究为一项横断面研究[12],纳入83 162患者研究微量蛋白尿高的与房颤之间的关系,HR 为1.21。
2015年Xu等[13]开展的一项前瞻性的研究,纳入132 250例患者,发现eGFR >90 ml/min/1.73 m2,eGFR 60~89ml/min/1.73m2和eGFR <59 ml/min/1.73 m2的 患 者 房颤 的HR 分 别 为1、1.51(1.34~1.71)和3.05(2.50~3.72)。
2016年开展的一项前瞻性的研究[14],纳入1 840 例患者,发现eGFR >90 ml/min/1.73 m2,eGFR 60~89ml/min/1.73m2和eGFR <59 ml/min/1.73 m2的患者,房颤的发生率分别为3.3%,8.7%和14.3%。
2019年开展的一项横断面研究纳入272 722例透析患者,房颤发生密度约为140/1 000人年[15]。
多项研究均显示[7-15]在CKD 患病人群中,房颤的患病率大大增加,而且肾功能下降程度与房颤的患病率呈正相关。同时CKD 是房颤患者卒中、出血和死亡的独立危险因素。有报道称CKD 患者新发房颤使后期发生心力衰竭,心肌梗死及卒中和死亡的风险增加了2~5倍[14]。同时,对肾脏的治疗可以减少房颤的发生。PREVEND 试验对CKD 患者进行四年的药物治疗随访后,发现相比对照组,心血管事件的发生减少了40%[16]。
2 CKD患者发生房颤的常见原因和可能的机制
CKD 与房颤有很多共同的危险因素,包括年龄、高血压、电解质紊乱、心力衰竭、代谢综合征、分子信号通路异常等[17-18]。这些危险因素与其他复杂的病理生理机制,如自主神经系统功能紊乱、肾素-血管紧张素-醛固酮系统(RAAS)异常激活、炎症反应、氧化应激、组织纤维化等,以及CKD 带来的显著的血液动力学及代谢紊乱、贫血等机制相互作用,共同促进了房颤的发生和维持,见图1。
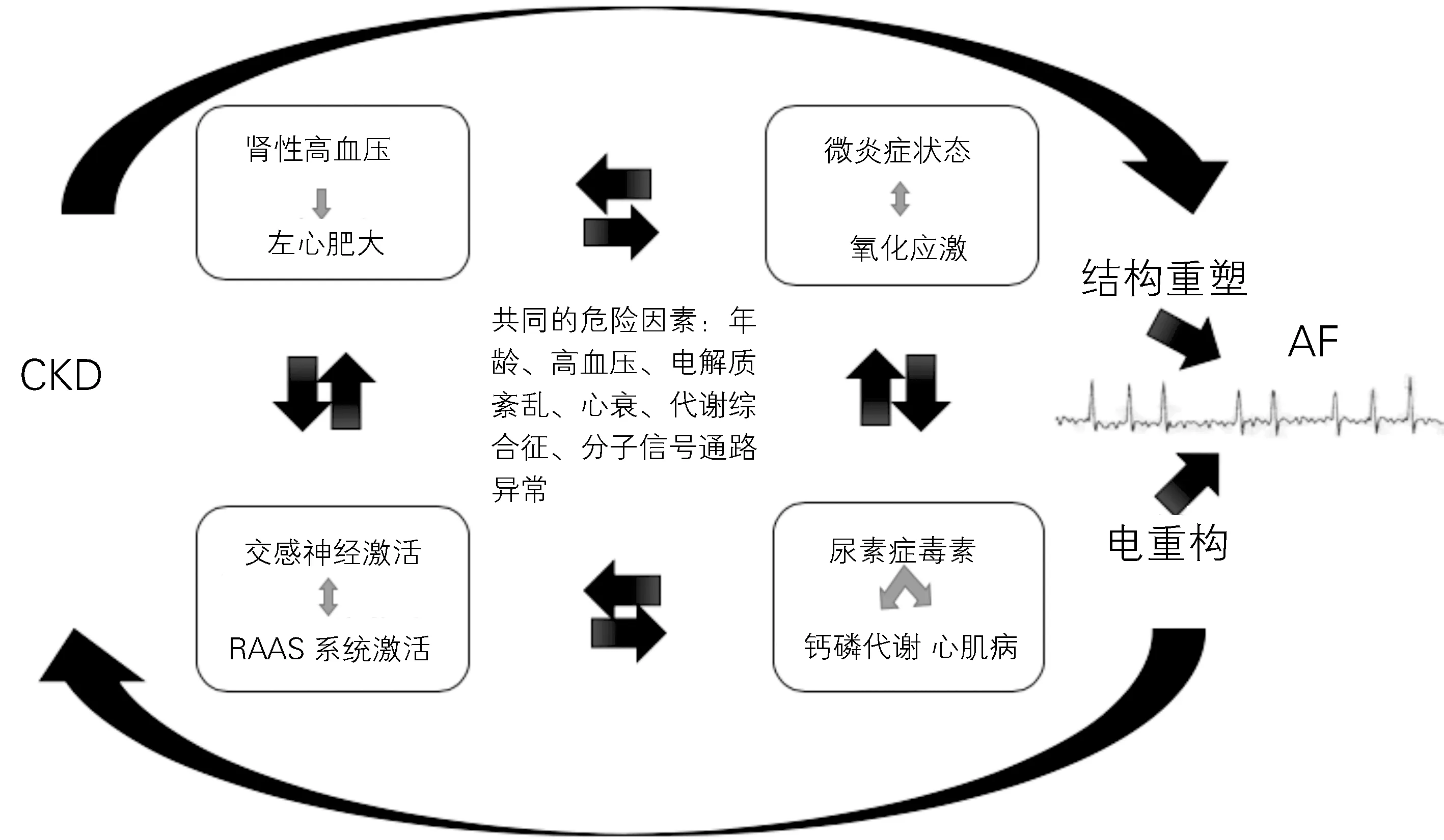
图1 CKD 合并房颤的机制
2.1 自主神经功能紊乱,RAAS系统激活 自主神经参与了心脏和肾脏正常和病理状态下的调控,自主神经失衡是房颤的重要诱发和维持机制。CKD 患者,尤其是ESRD 患者的心率变异性(HRV)发生了变化,提示该类患者出现了自主神经紊乱。PREVEND 是一项纳入4 605 名的观察性研究,显示CKD 患者的HRV 降低[16]。CKD 患者肾损伤引起的自主神经紊乱,主要表现为交感激活、迷走抑制,参与了房颤的发生发展。增强的交感神经主要通过增加细胞内钙浓度,增加心脏的自律性和触发活动[19]。RAAS激活致房颤的可能机制有以下三点:①直接导致水钠潴留和心房扩张直接导致房颤;②血管紧张素Ⅱ(AngⅡ)是一种促纤维化分子,介导Janus激酶/信号传导及转录激活子(JAK/STAT)信号通路作用于心房和TGF-β1 的下游激活,促进结构重塑[20];③RAAS系统可调节离子通道活性,进而缩短心房有效不应期,导致心房电重构。动物实验和临床试验都表明抑制RAAS系统可以有效阻断房颤的发生发展。
2.2 炎性反应、氧化应激及纤维化 炎性反应贯穿了肾脏疾病的发生发展过程,炎症同时参与了心房的重构,研究显示随着肾功能的下降,血清致炎因子水平明显增加[20]。很多因素促进了CKD 患者的炎症状态,包括肾脏清除促炎细胞因子能力逐渐降低、晚期糖基化终产物的蓄积、致炎因子的增加、氧化应激、酸中毒、慢性及反复感染、脂肪组织代谢的改变、尿毒症毒素的积累引起内皮炎症反应、肠道生态失调的改变。其中肠道炎症反应不仅可加重CKD 的进展,而且可加重贫血相关并发症及营养不良状态,从而诱发房颤。炎症首先可引起肾内微循环的变化和灌注重分布,可引起肾功能进一步损害并加重肾脏病的进展[21]。同时越来越多的证据显示,炎症反应在房颤的诱发和维持中起重要的作用,C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、IL-2、IL-6和IL-8均参与了房颤的发生发展[22]。REGARDS研究证明了炎症对CKD 合并房颤的重要作用,因为仅在3~5 期CKD 患者,升高的C反应蛋白与房颤之间的关联有统计学意义[23]。PREVEND 研究[16]发现CRP 升高合并微量白蛋白尿导致房颤的几率相较对照组增加约4倍。炎症参与调节钙稳态和连接蛋白,其与房颤的触发相关[24]。炎症参与房颤的原因有以下3点:①调节钙稳态和连接蛋白,参与房颤触发[24];②慢性炎症通过激活/损伤内皮细胞、增加组织因子分泌、激活血小板和增加纤维蛋白原表达,从而导致左房结构重构;③炎症通路的激活参与了心房电生理和结构重构,从而导致了房颤,房颤亦可增强炎症反应,这有助于形成“房颤致房颤”。
炎症与氧化应激关系密切。机体的微炎症状态可诱发并加强机体的氧化应激状态,hs-CRP 被认为是目前反映微炎症的较好指标。Himmelfarb 等[25]认为氧化应激指标MDA 水平与hs-CRP呈显著相关,表明氧化应激与微炎症关系密切。氧化应激是指部分还原形态的活性氧自由基(reactive oxygen species,ROS)的生成量超过细胞内源性解毒和/或清除能力的非稳态状态。研究表明,RAAS激活、交感神经兴奋性增强及炎性反应可导致肾功能不全患者氧化应激损伤[26]。炎症指标hs-CRP 不仅是房颤导管消融术后复发的预测指标,同时,hs-CRP也可通过促进活性氧自由基的形成,进而引起心房纤维化[27]。脂质过氧化作用的产物与房颤发生风险增加有关,该风险可被抗氧化剂,如他汀类药物降低。
RAAS异常激活、交感神经兴奋性增强、炎性反应均可导致肾功能不全患者氧化应激损伤[26]。炎症因子促进活性氧自由基的形成,引起心房纤维化[27]。抗氧化剂,如他汀类药物可降低房颤发生风险,佐证了氧化应激在房颤中的作用。
2.3 尿毒症毒素对心血管系统的作用 CKD 患者尿毒症毒素增加,包括硫酸吲哚酚、p-甲酚、p-甲酚基、硫酸脂、血磷、甲状旁腺激素、血尿素氮和尿酸等。尿毒症毒素参与房颤的诱发和维持,机制有以下4点:①激活神经内分泌系统,进而激活炎症反应,导致氧化损伤;②尿毒症毒素通过促进心肌细胞纤维化,促进细胞肥大,导致房颤[28];③甲状旁腺激素作为一种大分子尿毒症毒素蓄积,CKD 患者常常发生钙磷代谢紊乱。高钙血症使慢反应细胞和心肌细胞的自律性、兴奋性及传导性异常,引起房颤电重构和结构重构;血磷升高使细胞外基质的降解及平滑肌细胞发生成骨样改变,当其沉积于心肌间质和心肌血管壁时,可引起心脏传导系统异常和动作电位延迟;④对于需要透析的患者,血透过程中不可避免的出现电解质快速转移,主要是血钾紊乱。高血钾、低血钾都会引起心肌细胞自律性和兴奋性的改变,诱发房颤的发生。
2.4 CKD 和肾性高血压,左心结构重构 随CKD 的进展,eGFR 下降,RAAS活性增加,血压的钠敏感性增加,血管内皮功能失调及动脉僵硬度增加,以上因素共同促进了动脉血压的升高,而动脉血压的升高又进一步促进了氧化应激,导致肾缺氧,进而促进CKD 的进展和血压的进一步增加,形成恶性循环。由CKD 导致的肾性高血压导致了左心负荷增大,继而出现左室肥厚,同时在RAAS失调、尿毒症毒素、贫血、生长等影响下,CKD 患者往往出现病理性心房重塑。左心肥大是CKD 病人常见的心脏病变,多项研究表明其严重程度随eGFR 降低的程度而增加。无论是在轻中度的CKD,还是ESRD,左心房扩大都伴随着房颤的发生率增加[29]。此外,在CKD 患者已被证实存在心肌纤维化,并可能增强房颤致房颤作用[30]。这些CKD 中常见的结构异常可能在这些患者中作为房颤的基质,促进了房颤的诱发和发展。
3 CKD合并房颤的抗凝治疗
房颤和CKD 并存时卒中、系统性栓塞、出血的风险均增加。近年来大量研究评估了华法林和新型口服抗凝药(NOACs)在房颤合并CKD 时的有效性和安全性。
3.1 维生素K 拮抗剂 对于房颤合并轻中度的CKD 患者中,剂量调整的华法林抗凝治疗能降低卒中风险及病死率;而对于合并ESRD 患者抗凝药物治疗是否安全有效并没有统一的结论。肾功能损害越严重,所需的华法林剂量越低[31]。在房颤伴CKD 患者,无需透析的,给予华法林抗凝治疗,可降低血栓相关疾病;对于血液透析患者,则需要更严格的监测条件,且临床获益并不明确,因为这类患者出血风险显著可能会抵消抗凝带来的益处。2019 年的AHA/ACC/HRS房颤指南推荐对于任何程度的CKD 患者,都可以应用调整剂量(INR2~3)的华法林[32]。
3.2 非维生素K 拮抗剂口服抗凝药 在肌酐清除率≥30 m L/min的非瓣膜性房颤患者中,NOACs预防卒中、系统性栓塞的效果不亚于华法林,且颅内出血及大出血风险更低,对ESRD 患者的证据NOACs仍不充分[32]。2018年我国房颤指南[31]中提出对肌酐清除率<30 m L/min的患者,应禁用达比加群酯,慎用利伐沙班等药物;对于肌酐清除率<15 m L/min的患者,不论是否透析,均不推荐应用NOACs。
对于房颤合并CKD 患者,应根据卒中和出血风险谨慎选择是否抗凝治疗,抗凝治疗需要定期、充分地评估其卒中、出血以及并发症风险,加强肾功能和肝功能监测,及时进行药物调整。
4 结论
CKD 可能通过多种途径促进房颤的发生发展,其可能的机制比较复杂,且各机制相互影响,共同促进。对CKD 合并房颤患者的病理生理机制的探讨有助于进一步筛选房颤高危人群,通过其病理生理机制的研究,为CKD 合并房颤的患者提供更优的治疗策略。
