血清HPA和IL-6对动脉瘤性蛛网膜下腔出血患者预后的预测价值
2020-09-01刘春江刘熙鹏张秀峰王鹏飞
曹 兵, 丁 奇, 刘春江, 甄 诚, 刘熙鹏, 张秀峰, 王鹏飞
(河北北方学院附属第一医院, 河北 张家口 075000)
动脉瘤性蛛网膜下腔出血(aSAH)是由于颅内动脉瘤破裂后血液流入蛛网膜下腔引起的一系列临床综合征,死亡率约为32%~67%,严重危及患者生命健康[1]。研究发现[2]aSAH患者的病情与神经功能缺陷、致残率和死亡率密切相关,预后严重影响患者的生存质量。因此需要寻找能够预测aSAH患者预后的指标并分析其影响因素,以便尽早制定合理的治疗方案,进行干预,从而改善患者预后。目前,临床上应用WFNS分级、Hunt-Hess分级和Fisher分级等评价aSAH患者预后,但方法较繁琐,不能满足临床需求。研究发现[3]患者发生脑出血后炎症因子被激活,炎症反应增强,影响患者的预后。乙酰肝素酶(HPA)是一种β-葡萄糖醛酸酶,能够特异性地降解细胞外基质和基底膜中的硫酸肝素糖蛋白多糖,可参与多种炎症反应,促进血管生成及细胞迁移和分化[4];白介素6(IL-6)是趋化因子家族的细胞因子之一,主要由巨噬细胞、T细胞和B细胞分泌,参与机体炎症反应,并在脑组织损伤过程中发挥重要作用[5]。本文通过分析血清HPA和IL-6对aSAH患者预后的预测价值及影响因素,为临床诊治提供一定的理论依据。
1 资料与方法
1.1一般资料:选取2015年6月至2019年6月河北北方学院附属第一医院神经外科诊治的219例动脉瘤性蛛网膜下腔出血患者作为研究对象,其中年龄(60.08±13.07)岁,女性86例,男性133例。纳入标准:所有患者均符合中华医学会神经病学分制定《中国蛛网膜下腔出血诊治指南2015》[6]中的诊断标准;经头颅CT证实为蛛网膜下腔出血;经CT动脉造影(CTA)和数字减影血管造影(DSA)明确为单发动脉瘤破裂出血;发病至入院时间<8h。排除标准:年龄<18岁者;入院24h内死亡者;急性颅脑损失者;伴有严重肝肾功能障碍者;伴有免疫力低下、肿瘤和血液疾病者;复发的aSAH者;伴有心肺功能障碍者。本研究经医院伦理委员会批准同意,且研究对象或家属均知情同意。
1.2方法:收集所有患者的临床资料,包括年龄、性别、既往病史等基本资料,同时采用问卷调查的方法对患者或其家属进行相关问题的调查。根据患者出院或死亡时格拉斯哥预后量表(GOS)评分将患者分为预后不良组(GOS:1~3分,85例)和预后良好组(GOS:4~5分,134例);患者入院后立即采集静脉血2~3mL,以3000r/min速度离心10min,吸取上清液,放置-20℃备用,检测血清HPA、IL-6和hs-CRP的水平。应用Elisa法检测HPA和IL-6,免疫比浊法检测hs-CRP,所有指标均按照相应试剂盒说明进行操作。

2 结 果
2.1研究对象基本资料:两组患者性别分布、糖尿病和饮酒史比较,差异未见统计学意义(P>0.05);年龄、高血压、吸烟史、GCS评分比较,差异有统计学意义(P<0.05),见表1。

表1 研究对象基本资料
2.2两组血清HPA、IL-6和hs-CRP水平比较:预后不良组患者血清HPA、IL-6和hs-CRP水平高于预后良好组患者,差异存在统计学意义(P<0.01),见表2。

表2 两组患者血清HPA IL-6和hs-CRP水平比较
2.3血清HPA、IL-6和hs-CRP水平对aSAH患者预后的预测价值:HPA、IL-6和hs-CRP的AUC经DeLong检验显示,差异有统计学意义(Z=2.785,P=0.005;Z=1.999,P=0.044)。ROC曲线结果显示,血清HPA和IL-6对aSAH患者预后的预测价值优于hs-CRP,见表3、图1。

图1 血清HPA IL-6和hs-CRP预测aSAH患者预后的ROC曲线
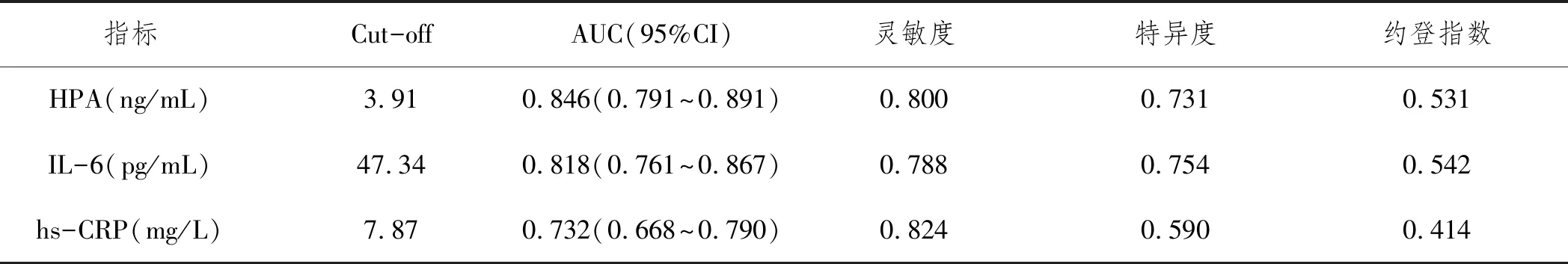
表3 血清HPA IL-6和hs-CRP水平对aSAH患者预后评估
2.4aSAH患者预后多因素分析:根据aSAH患者预后(预后不良=1,预后良好=0)作为因变量将年龄≥65岁、高血压、吸烟史、GCS评分<12分、HPA≥3.91ng/mL、IL-6≥47.34pg/mL和hs-CRP≥7.87mg/L作为自变量纳入多因素非条件logistics回归分析,结果显示年龄≥65、高血压、GCS评分<12分、HPA≥3.91ng/mL、IL-6≥47.34pg/mL和hs-CRP≥7.87mg/L是aSAH患者预后的影响因素,见表4。
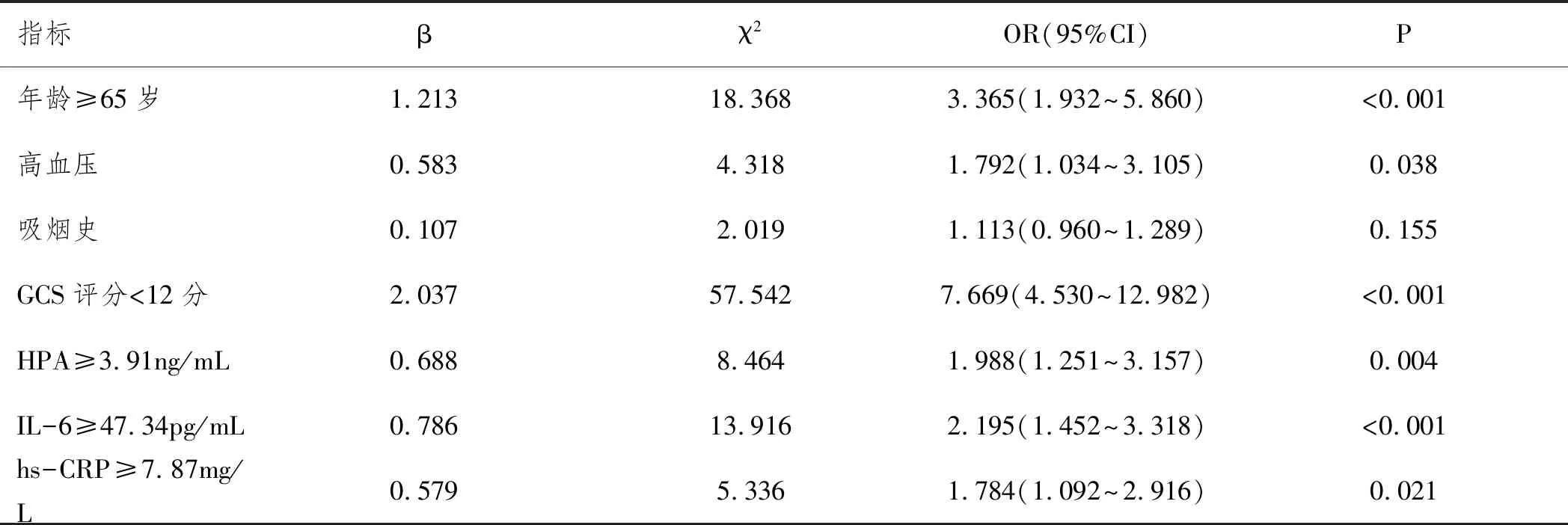
表4 aSAH患者预后的多因素分析
3 讨 论
aSAH是一种高致残率和高死亡率的神经系统疾病,严重威胁患者身心健康。当动脉瘤发生破裂时,血液迅速进入蛛网膜下腔,引起颅压快速上升、脑血流灌注发生下降和短暂性脑缺血,在颅内短暂性脑缺血和红细胞裂解物的刺激下,机体的炎症反应通路被激活,释放大量的炎性介质,最终导致血脑屏障被破坏、脑水肿形成,致使患者死亡风险增加。
hs-CRP是一种由肝脏产生的急性时相炎症反应蛋白,常用作为炎症性疾病的评价指标。研究表明[7]hs-CRP与脑出血和脑损伤等疾病密切相关。本研究发现,预后不良组血清hs-CRP水平高于预后良好组,说明hs-CRP参与aSAH患者发病过程。可能是由于aSAH患者血肿周围组织出现炎性细胞的浸润,刺激炎性细胞因子表达,并诱导肝细胞大量释放hs-CRP,加重病情,而且hs-CRP水平升高能造成血小板释放及凝集功能的异常,影响止血和凝血过程,进一步导致出血量加重,影响患者预后。HAP是一种能降解硫酸乙酰肝素的内源性糖苷酶,参与机体的多种病理生理过程,如炎症反应和肿瘤转移等[8]。正常情况下HAP的表达受限,但在病病理状态下,HAP的表达明显上升。HAP具有蛋白非酶解活性的促凝功能,从而在凝血和血管形成过程发挥重要的作用。但和脑出血的部位无关。本研究发现,预后不良组血清HAP水平高于预后良好组,说明HAP参与aSAH患者病理生理过程。这可能是由于aSAH发病初期脑出血周围的血流量明显下降、血管堵塞、颅内压急剧升高,造成脑细胞水肿和脑组织缺血缺氧,机体需要促进脑血管新生,缓解脑缺血;HAP通过降解基底膜和细胞外基质,释放血管内皮生长因子,促使血管生成和内皮细胞的增殖,从而缓解脑缺血缺氧的状态[9]。另外,当脑出血量越多时,脑血肿周围的血流量下降就越明显,脑缺血缺氧就越严重,从而造成血清HAP水平显著上升。IL-6是一种分子量为26kD的多效性炎性细胞因子,参与机体炎症反应和免疫调节。研究发现[10]机体血清IL-6水平升高,可通过单核细胞诱导中性粒细胞趋化到炎症损伤部位,释放大量炎性因子,促使炎症瀑布形成,加重炎症损伤,影响神经细胞的修复,加重脑组织损伤。本研究发现,预后不良组血清IL-6水平高于预后良好组,进一步提示IL-6参与aSAH患者病理生理过程。可能是由于aSAH发病后,小胶质细胞和星形胶质细胞能产生并释放大量的IL-6,同时外周血中的白细胞数量也大幅度增加,而白细胞又能分泌出大量的IL-6,导致血清IL-6水平显著上升[11]。另外,IL-6在刺激颅内血管痉挛过程发挥重要的作用,可造成血管阻力增加、血流速度降低,从而加重脑缺血和出血;而且IL-6可以诱导炎性因子向神经组织转移,损伤血管内皮和神经细胞,引起血管内皮细胞分泌的血管活性物质失去平衡,造成大量细胞因子被释放,血液不能正常凝固,从而发生出血,加重病情,影响患者的预后[12]。
经ROC曲线分析,血清HAP、IL-6和hs-CRP可以作为评价aSAH患者预后的指标,但是HAP、IL-6曲线下面积明显性高于hs-CRP(P<0.05),而且两者约登指数高于hs-CRP,提示HAP、IL-6的临床价值优于hs-CRP。经多因素logistics回归分析显示:年龄≥65岁、高血压、GCS评分<12分和HPA≥3.91 ng/mL、IL-6≥47.34 pg/mL和hs-CRP≥7.87 mg/L是aSAH患者预后的影响因素,进一步提示血清HAP、IL-6和hs-CRP水平与aSAH患者病理生理过程密切相关。
综上所述,血清HPA、IL-6和hs-CRP参与aSAH患者病理生理过程,可作为预测aSAH患者预后的评价值指标,但是HPA、IL-6预测价值优于hs-CRP。但由于本研观察样本量较少,而且为单中心研究,存在一定的局限性,尚需日后加大样本量进行多中心研究,探讨血清HAP和IL-6对aSAH患者预后的价值及具体作用机制。
