基于反向分子对接和网络药理学的吴茱萸次碱对心血管保护作用机制*
2020-08-31李姣欧水平张建永熊永爱王森
李姣,欧水平,张建永,熊永爱,王森
(1.遵义医科大学药学院,遵义 563000;2.遵义医科大学附属医院药剂科,遵义 563099)
中草药已被广泛认为是创新药物发现的宝贵资源[1]。吴茱萸为芸香科植物吴茱萸[Evodiarutaecarpa(Juss.) Benth]的干燥近成熟果实,其性热,味辛苦,归肝、脾、胃、肾经,具有散寒止痛、降逆止呕、助阳止泻的功效[2-3]。吴茱萸次碱(rutaecarpine,Rut)是从中药吴茱萸中提取分离的主要有效成分之一,在吴茱萸生物碱类成分中含量最高[4-5]。现代药理研究表明,Rut具有抗炎、抗动脉粥样硬化、抗血小板聚集、舒张血管、降压等多种药理作用[6-9]。越来越多的研究显示,Rut 在心血管保护方面发挥着重要的作用,它不仅可以减轻大鼠缺氧诱导的右心室重塑[10],抑制腹主动脉缩窄致模型大鼠左心室肥厚[11],还能明显降低自发性高血压大鼠及两肾一夹型大鼠血压[12]。Rut在离体血管和整体动物水平均证明能有效地舒张血管、保护心脏和降压,但由于中药有效成分多靶点发挥系统治疗作用的特点和作用机制的多样性,Rut抗心血管作用的机制尚未明确,合理解释其抗心血管作用机制的科学内涵具有重要的意义。
网络药理学是建立在网络生物学与多向药理学基础上的一门新兴学科,涉及到组学和系统生物学技术的应用[13]。近年来,网络药理学已被广泛用于探索中药的潜在有效成分、靶点和药理机制,为分析中医整体作用的科学内涵提供线索,极大地促进了药物的发现。反向分子对接技术是一种基于反向药效团匹配的计算机辅助药物设计技术,因其特有的高效便捷等特点,被联合网络药理学广泛应用于中药的药理作用机制研究,为中药现代化研究提供了新方向和思路[14]。
为了进一步研究Rut的抗心血管作用机制,笔者采用反向分子对接和网络药理学方法,挖掘Rut的潜在作用靶点、关联疾病及信号通路,从系统生物学整体角度解释Rut抗心血管的作用机制,为Rut的药物开发和基础实验研究提供理论参考。
1 资料与方法
1.1Rut的成药性评价 TCMSP数据库(http://ibts.hkbu.edu.hk/LSP/tcmsp.php)是一个独特的中药系统药理学平台,可以计算天然化合物的ADME(吸收、分布、代谢和排泄)相关特征[15]。利用TCMSP搜索关键词“Rutaecarpine”,可获得Rut的分子结构和ADME相关特性。
1.2Rut的靶点预测 PharmMapper是一种通过反向对接获得潜在药物靶标的服务器,已被广泛用于单味中药及复方的活性成分靶点预测[16-18]。将Rut结构导入PharmMapper服务器进行Rut的反向靶点预测分析,将Select Target Set设置为Human Protein Target Only,其他参数默认。
1.3相关疾病分析和抗心血管靶点的筛选 Comparative Toxicogenomics Database(CTD)(http://ctdbase.org/ about/)是一个强大的开放数据库,可通过化合物靶点查询对应疾病[19]。为分析Rut潜在相关疾病,将上述Rut潜在靶点输入CTD数据库,通过基因搜索获得各个靶标的相关疾病,然后根据医学主题词(MeSH)的疾病分类,筛选出心血管疾病(cardivovascular disease,CVD)的相关条目,得到Rut相关的CVD和抗心血管靶点。
1.4化合物-靶点-CVD网络的构建与分析 Cytoscape是一种强大的生物信息学软件包,可用于可视化生物通路和分子间相互作用研究[20]。为了将化合物-靶标-疾病的相互关系进行可视化,利用Cytoscape 3.6.0版软件构建化合物-靶点-CVD网络。将Rut、潜在靶点和对应的CVD构建成Rut-潜在靶点数据集和潜在靶点-CVD数据集,并依次导入Cytoscape,采用软件中的合并功能(Merge)将成分、靶点及CVD构建成一个成分、靶点和CVD的三元综合网络模型。
1.5蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建与分析 String是一种开放的数据分析平台,常用于分析蛋白质-蛋白质之间的相互作用[21]。为探讨Rut相关的心血管疾病靶点之间的相互作用,将上述获得的Rut抗心血管靶点导入String平台进行在线分析,研究物种限定为人,数据导出为TSV格式,并借助Cytoscape构建Rut抗心血管靶点的PPI网络。
1.6分子对接验证 为进一步验证预测靶点的可靠性,利用Systems Dock(http://systemsdock.unit.oist.jp/)数据库对Rut和度值前5个抗血管靶点进行分子对接。通过输入5个靶蛋白的PDB ID,导入Rut结构,得到Rut和5个靶蛋白的对接得分值(Dock Score)。根据Dock Score来判断Rut与靶蛋白之间的匹配度。Dock Score越大,表示Rut与靶蛋白之间结合越稳定。根据文献[20,22],通常Dock Score大于5.0说明分子与靶点有较好的结合活性,大于7.0则说明分子与靶点的结合构型具有强烈的活性。
1.7通路富集分析和高级气泡图的绘制 为阐明Rut作用于CVD的潜在机制,将Rut 抗心血管靶点映射到DAVID在线分析系统以富集分析,选择“正式基因符号(official gene symbol)”,研究对象限定为人。根据CVD的发病机制,进一步筛选与CVD相关的显著富集通路,并借助Omicshare在线平台将所得通路构建成高级气泡图。
2 结果
2.1Rut的ADME相关参数 OB和DL是两个重要的药动学参数。Rut的OB和DL值分别为40.30%和0.60,其他参数如相对分子质量、AlogP、Hdon、Hacc、Caco-2、BBB、RBN、HL分别为287.34,3.36,13,1.13,0.71,0,8.21,均满足文献中活性化合物的筛选原则[23-24],表明Rut是药物开发的良好候选者。
2.2Rut的靶点预测 利用PharmMapper服务器将Rut反向对接进行潜在靶点预测,总共得到192个靶蛋白,进一步通过Z值降序排列挑选出前100个靶蛋白进行下一步的分析,靶点详细信息见表1。
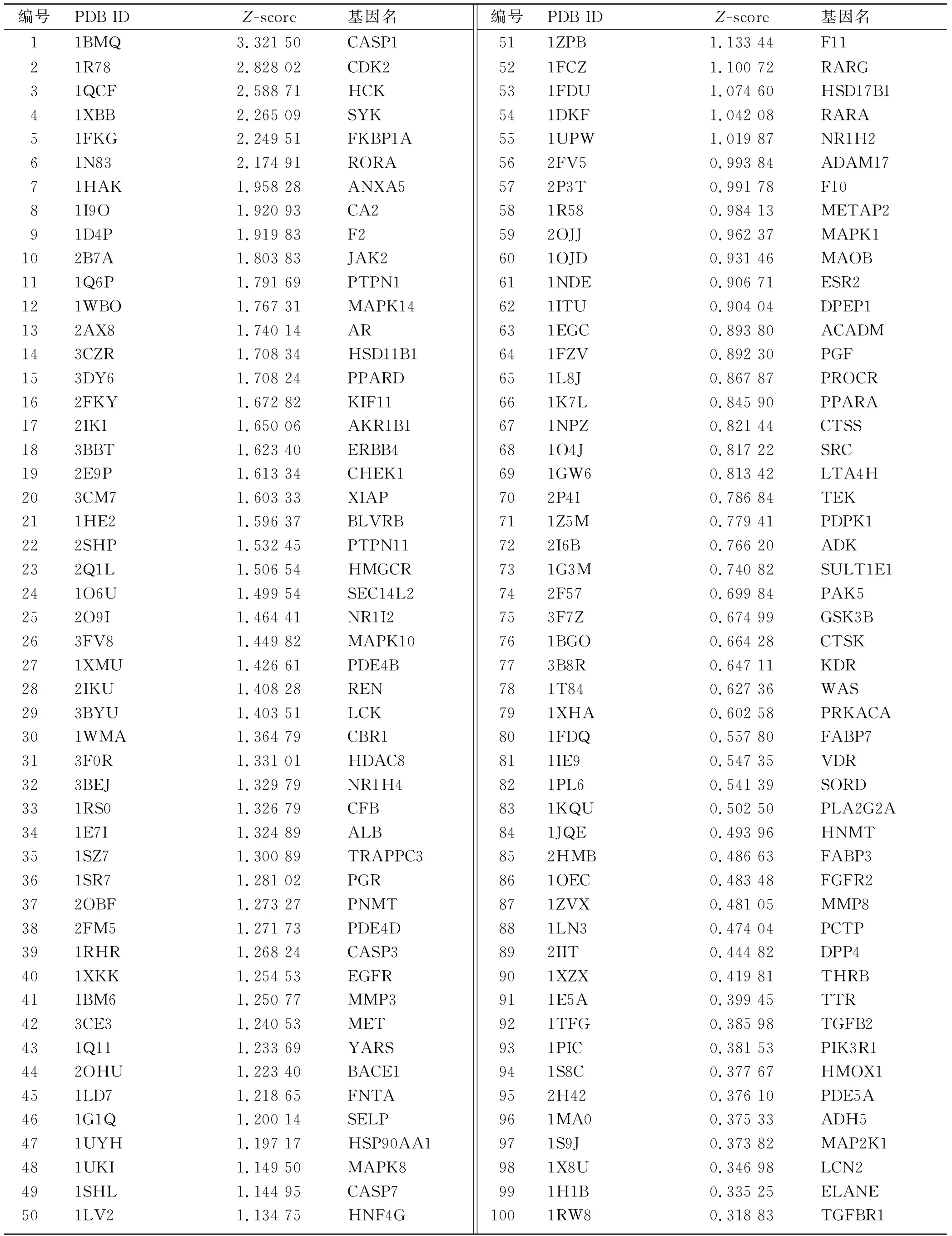
表1 Rut的潜在靶点信息Tab.1 Information of potential targets from Rut
2.3化合物-靶点-CVD网络的构建与分析 为了将化合物、靶点和疾病之间的关系进行可视化,借助Cytoscape构建化合物-靶点-CVD网络,见图1。该网络包括72个节点(1个化合物、42个靶点和29种CVD)和134条边。网络中不同颜色的节点分别代表化合物、抗心血管靶点和CVD,边代表它们三者之间的相互作用。节点的大小反映了度值的大小。较大的节点表示较高的度值。网络结果表明,筛选的100个潜在靶点中有42个靶点与29种CVD相关。在29种CVD中,高血压具有最多的度值,其次是心肌再灌注损伤、心肌缺血、心脏肥大,它们分别与11,7,7,6个靶点连接。在网络中,度值是指一个节点与其他节点的连接数目,度值的大小代表该节点在网络中的重要性。由此表明,Rut对高血压、心肌再灌注损伤、心肌缺血、心脏肥大等多种CVD具有潜在的治疗效果。而现代药理学研究证明,Rut能明显降低自发性高血压大鼠及两肾一夹高血压大鼠血压[12];减轻缺氧诱导的右心室重构,抑制血管肥大和血管紧张素II诱导的大鼠血管平滑肌细胞增殖[25-26]。这在一定程度上证明本研究策略的可行性。

黄色代表药物;绿色代表靶点;蓝色代表心血管疾病。图1 Rut-靶点-心血管疾病网络Yellow color represents drug;green color represents targets;blue color represents cardiovascular disease.Fig.1 Rut-target-CVD network
在大多数情况下,疾病的发生和发展可被认为是作用于多个靶标而非单个靶标的结果[27-28]。一种疾病可能作用于多个靶点,同一个靶点也可能与多种疾病相关。在图1中,与多种CVD作用较多的靶点有血红素加氧酶1(HMOX1,度=9),凝血酶原(F2,度=9),血清白蛋白(ALB,度=8),肾素(REN,度=7)和半胱氨酸蛋白酶-3(cathepsin-3,CASP3,度=7)等,表明这些靶点可能在Rut的心血管保护作用中起着至关重要的作用。
2.4心血管相关靶点PPI网络的构建和分析 通过将上述42个心血管相关靶点输入String数据库,得到这些靶蛋白之间的相互作用,利用Cytoscape将结果绘制成PPI网络(图2)。该网络包含39个蛋白、186条边(其中CBR1、HSD11B1和SULT1E1与其他蛋白没有相互作用,未在网络中显示)。在该网络中,节点的大小和颜色的深浅代表度值的大小,边的粗细代表蛋白之间的Combine score值。节点越大、颜色越深表示该节点的度值较高;边越粗表示Combine score值越大。由图可知,ALB、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、类固醇受体共激活因子(steroid receptor coactivator,SRC)、表皮生长因子受体(epidermal grouth factor receptor,EGFR)和CASP3在该网络中占据着重要的地位,表明这些靶蛋白可能在Rut治疗CVD中扮发挥重要的作用。
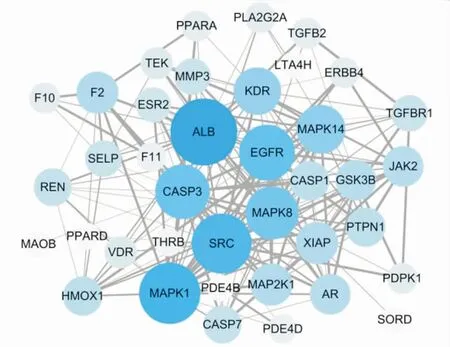
图2 蛋白质-蛋白质相互作用网络Fig.2 Protein-protein interaction network
2.5分子对接验证 为了进一步验证预测结果的可靠性,使用Systems Dock对Rut和Rut-靶点-CVD网络中度值前5个关键靶点进行分子对接验证。结果Rut与F2、HMOX1、ALB、REN、CASP3之间的对接得分分别为8.016,6.182,6.320,5.688,7.101,均高于5.0,表明Rut与5个靶蛋白之间具有较好的结合活性。同时,该结果验证了预测靶点的可靠性。
2.6通路富集分析与高级气泡图的绘制 使用DAVID数据库对Rut 42个抗心血管靶点进行KEGG通路富集分析,分析结果见表2,进一步利用Omicshare平台构建高级气泡图(图3)。高级气泡图是通过数值、颜色、图形大小等直观指标展示富集通路差异基因情况。气泡面积大小表示目标基因集中属于这个pathway的基因数量,气泡颜色表示富集显著性(即P值),X轴表示富集因子(rich factor),Y轴表示pathway名称。其中富集因子越大,富集程度越大。由图可知,Rut抗心血管靶蛋白主要富集于VEGF信号通路、MAPK信号通路以及缺氧诱导因子(hypoxia-inducible factor,HIF)-1信号通路。此外,研究发现Rut亦调控了CVD的经典通路如胰岛素抵抗和Toll样受体信号通路等,进一步表明Rut的多靶点、多通路协同作用,推测Rut可能是通过调控这些通路发挥治疗CVD作用。

表2 吴茱萸次碱潜在靶点的KEGG信号通路Tab.2 KEGG signaling pathway of potentially target of Rut

图3 通路分析气泡图Fig.3 Bubble plot of pathway analysis
3 讨论
药物毒性和药动学是影响药物开发的重要因素,在药物开发过程中优先考虑这些方面,就能够极大地降低药物开发的成本。近年来,随着生物信息学和网络药理学的发展,这种推测和模拟药动学和药物毒性的优势更加凸显。基于此,本研究以Rut为对象,首先采用TCMSP平台对Rut的ADME相关特性进行考察。
TCMSP的预测结果表明,Rut具有较好的药动学特征和成药性,是良好的潜在候选药物。通过进一步进行药物-靶点预测、靶点-疾病分析和化合物-靶点-CVD网络构建,发现HMOX1、ALB、F2、REN和CASP3等具有较高的度值,推测Rut可能是通过作用于这些关键靶点从而发挥干预CVD的作用。HMOX1是血红素加氧酶系统中最重要的同工酶,具有抗炎、抑制细胞凋亡等作用,在高血压、动脉粥样硬化等多种心血管疾病中发挥着极其重要的作用[29]。研究显示,Rut对叔丁基过氧化氢诱导的肝毒性具有保护作用,与增加HMOX1产生的产物有关[30],提示Rut可能是通过作用于HMOX1,影响相关体内代谢过程进而发挥心血管保护作用。血清ALB是人血浆中最丰富的蛋白质之一,具有蛋白质转运及清除自由基等功能[31]。血清ALB水平过低会导致高血压脑出血患者的水肿程度加重,且其严重程度与血清ALB的水平呈负相关[32]。有研究指出,Rut和ALB可形成1:1型稳定的复合物,最有可能的结合位点为Trp213残基(牛血清ALB)或Trp214残基(人血清ALB)附近[33]。由此推测Rut可能是通过与ALB结合、调节ALB水平发挥心血管保护作用。F2亦称第Ⅱ因子,是血液凝固因子之一,存在于血浆中,是凝血酶的前身物质,在凝血机制中起着中心的作用。研究表明,F2缺陷会导致血栓形成[34],但目前笔者未见Rut通过作用于F2干预心血管疾病的报道,对进一步深入研究具有重要意义。肾素是肾素-血管紧张肽系统(renin-angiotensin system,RAS)的重要组成部分,RAS是维持血压、水和电解质平衡及心血管稳态的重要调控系统,对CVD的发生发展至关重要[35-36]。Rut可能通过作用于REN、调节RAS、维持心血管内环境稳态从而在治疗CVD中发挥重要作用。细胞凋亡在CVD中起核心作用,CASP3是一种与细胞凋亡密切相关的蛋白酶,参与调控糖尿病大鼠心肌细胞凋亡,下调Caspase-3能够减弱心肌细胞的凋亡[37]。提示Rut可能是通过调节CASP3蛋白酶的表达,控制细胞凋亡进而干预CVD,但目前笔者尚未见Rut通过调控CASP3进而发挥心血管保护作用的报道,因此对本研究结果仍需进一步深入研究。
通路富集预测结果显示,Rut可能主要通过调控血管内皮生长因子(vascular endothelial growth factor,VEGF)、MAPK和HIF-1信号通路进一步发挥心血管保护作用。VEGF信号通路通过增加细胞增殖和降低血管内皮细胞的黏附而具有内皮保护作用[16]。研究显示,Rut可通过调节VEGFR2和VEGFR2介导的Akt / mTOR / p70s6k信号传导途径来抑制血管生成[38];MAPK信号转导通路可以控制细胞的增殖、发育、分化、凋亡和炎症反应,MAPK信号级联反应可能在心血管疾病的发病机制中发挥重要作用[39]。研究报道,Rut可通过干扰氧化应激反应和抑制JNK / p38 MAPK信号通路,减轻大鼠肾脏缺血-再灌注损伤[40];明显防治大鼠腹主动脉缩窄所致左室肥厚,其作用机制至少部分与其抑制MAPK/ERK信号通路有关[11]。HIF-1α信号通路在生长因子和血管生成的调节中起重要作用[41]。报道显示,Rut还可通过调节IRS-1/PI3K/Akt和AMPK/ACC2信号通路改善大鼠的高脂血症和高糖血症[42-43];通过抑制TLR4/NF-κB信号通路保护心肌缺血-再灌注损伤,此作用与促进降钙素基因相关肽释放有关[44]。
综上所述,本研究利用反向分子对接和网络药理学方法对Rut的心血管保护作用机制进行预测分析,结果表明Rut在心血管领域具有较好的研究前景,其可能是治疗CVD的潜在药物。进一步通过对靶点和通路预测分析,发现Rut可能通过作用于HMOX1、F2、ALB、REN和CASP3等靶点进而参与调控VEGF、HIF-1、MAPK等信号通路,其可能是通过多靶点、多通路协同作用的机制发挥心血管保护作用。本研究为Rut干预CVD的药理活性、靶标和药物开发研究提供了重要参考。但网络药理学的实验方法还存在一定的局限性,仍需进行进一步的实验支持与验证。
