虾青素脂质体的制备与表征*
2020-08-31杨安平顾斯颖梁一俊杜卓
杨安平,顾斯颖,梁一俊,杜卓
(佛山科学技术学院医药工程学院,佛山 528000)
虾青素(astaxanthin)为一种具有13个共轭双键的酮式脂溶性类胡萝卜素,主要存在于藻类、酵母、甲壳类动物和鱼类表皮中,具有较强的抗氧化能力[1-2],因结构不稳定、水溶性差及生物利用度低等特点影响其应用。有学者通过微囊化[3]、纳米乳液化[4]等方法来改善其缺点,但效果不明显。
脂质体(liposome)是一种类似细胞膜结构的双分子层微小囊泡,药物被脂质体包裹后,可以提高药物稳定性,改善水溶性,增加生物利用度[5-7]。有学者将番茄红素、β-胡萝卜素和叶黄素等类胡萝卜素成分通过制成脂质体的方法[8-10]来改善其溶解性、稳定性及生物利用度。刘媛等[11-12]使用乳化蒸发-低温固化法制备虾青素脂质体用于皮肤伤口愈合的治疗,但制备方法复杂,难以产业化。本研究拟采用乙醇注入法制备虾青素脂质体,探究其最佳处方与工艺并进行质量评价,具体研究结果报道如下。
1 仪器与材料
1.1仪器 手掌式医用离心机(江苏新康医疗器械有限公司,型号:XK-1200型),超声波清洗机(深圳钰洁清洗设备有限公司,型号:F-060),电子分析天平(常熟市双杰测试仪器厂,型号:JJ124BF,d=0.1mg),高效液相色谱仪(北京钢臣科技有限公司,UV3000型紫外可见光检测器,型号:LC3000),柱温箱(大连日普利科技仪器有限公司,型号:RPL-D2000),纳米粒度及ZETA电位仪(英国马尔文公司,型号:NANO ZS90)。
1.2材料 虾青素对照品(上海麦克林有限公司,含量:96%,批号:201424),胆固醇[艾伟拓(上海)医药科技有限公司,批号:B61251],大豆磷脂[艾伟拓(上海)医药科技有限公司,批号:SY-SI-180101],甲醇(西陇科学股份有限公司,色谱纯),纯化水(实验室自制),其余试剂均为分析纯。
2 方法
2.1虾青素脂质体的制备 称取处方量的磷脂、胆固醇、虾青素溶入10 mL乙醇中,用注射器匀速缓慢注入水合介质(0.01 mol·mL-1磷酸盐缓冲液)中,恒温水浴加热,并搅拌至乙醇完全蒸发,超声10 min,用孔径0.45 μm微孔滤膜滤过,即得橙红色澄清透明的虾青素脂质体液体,冰箱4 ℃冷藏避光保存。
2.2处方设计与筛选 以脂质体包封率为评价指标,通过单因素实验,观察脂药比、磷脂与胆固醇的质量比、水合介质pH值、水合介质用量、温度5个因素对脂质体包封率的影响,选出影响脂质体包封率的最不明确4个因素、3个水平进行正交实验,优选最佳处方与工艺,并按最优处方与工艺制备虾青素脂质体5批。
2.3含量测定
2.3.1色谱条件 参考文献[13]的方法,色谱柱为Kromasil(250 mm×4.6 mm,5 μm),流动相为甲醇-水(95:5),流速为1.0 mL·min-1,柱温30 ℃,检测波长为475 nm,进样量20 μL。
2.3.2标准曲线的制备 精密称取虾青素对照品5 mg,用甲醇溶解并定容在50 mL棕色量瓶中,得0.1 mg·mL-1虾青素对照品母液。精密吸取不同量的虾青素对照品母液,制成0.001,0.002,0.003和0.004 mg·mL-1的虾青素溶液,按“2.3.1”项下色谱条件进行测定,以虾青素溶液浓度为横坐标,峰面积为纵坐标进行线性回归,得标准曲线方程:Y=228 860 150X+14 761.2(R2=0.999)。
2.3.3包封率的测定 参考文献[14]介绍的方法,吸取制备好虾青素脂质体液体1mL,用甲醇稀释至10 mL,按“2.3.1”项下色谱条件进行测定,计算虾青素的浓度(C0);吸取制备好虾青素脂质体液体1mL,用甲醇稀释至10 mL,超声破乳2 min,以10 000 r·min-1离心10 min(r=1.8 cm),取上清液按“2.3.1”项下色谱条件进行测定,计算虾青素的浓度(C1),根据下式计算包封率(EE):EE(%)=(C1/C0)×100%。式中,C1为包封在脂质体中的虾青素质量浓度,C0为脂质体中虾青素的总质量浓度。
2.4最优处方虾青素脂质体的表征检测
2.4.1虾青素脂质体形态 取最优处方虾青素脂质体加水合介质稀释250倍,吸取适量样品至碳支持膜的铜网,滴加2%磷钨酸负染,晾干,透射电镜拍摄不同放大倍数下的虾青素脂质体,并观察虾青素脂质体的显微形态。
2.4.2虾青素脂质体粒径 取最优处方虾青素脂质体加水合介质稀释100倍,在室温25 ℃下,使用NANO ZS90 纳米粒度仪测得虾青素脂质体的平均粒径和粒径分布。
3 结果
3.1单因素筛选实验
3.1.1脂药比对包封率的影响 按“2.1”项的方法制备虾青素脂质体,其他条件不变,考察脂药比分别为10:1,20:1,30:1,40:1,50:1时对脂质体包封率的影响。结果显示,不同脂药比所得的脂质体包封率分别为11.24%,14.68%,18.01%,19.46%,19.01%,结果见图1。

图1 脂药比对脂质体包封率的影响Fig.1 Effect of the ratio of lipids to astaxanthin on the encapsulation efficiency of the liposome
3.1.2磷脂与胆固醇的质量比对包封率的影响 按“2.1”项的方法制备虾青素脂质体,其他条件不变,考察磷脂与胆固醇质量比分别为25:1,20:1,15:1,10:1,5:1时对脂质体包封率的影响。结果显示,不同磷脂与胆固醇质量比所得的脂质体包封率分别为14.95%,15.34%,20.38%,18.45%,18.30%,结果见图2。
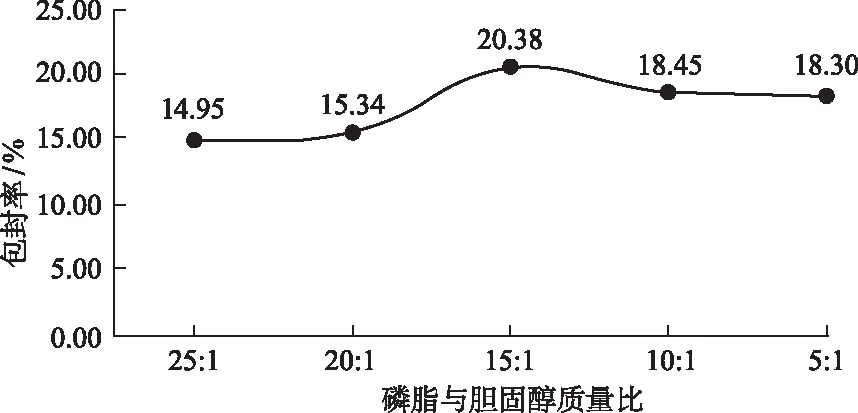
图2 磷脂与胆固醇的质量比对脂质体包封率的影响Fig.2 Effect of the ratio of phospholipid to cholesterol on the encapsulation efficiency of the liposome
3.1.3水合介质pH值对包封率的影响 按“2.1”项的方法制备虾青素脂质体,其他条件不变,考察水合介质pH值分别为6.0,6.5,7.0,7.4,8.0时对脂质体包封率的影响。结果显示,不同水合介质pH值所得的脂质体包封率分别为19.42%,19.86%,22.26%,20.87%,18.44%,结果见图3。
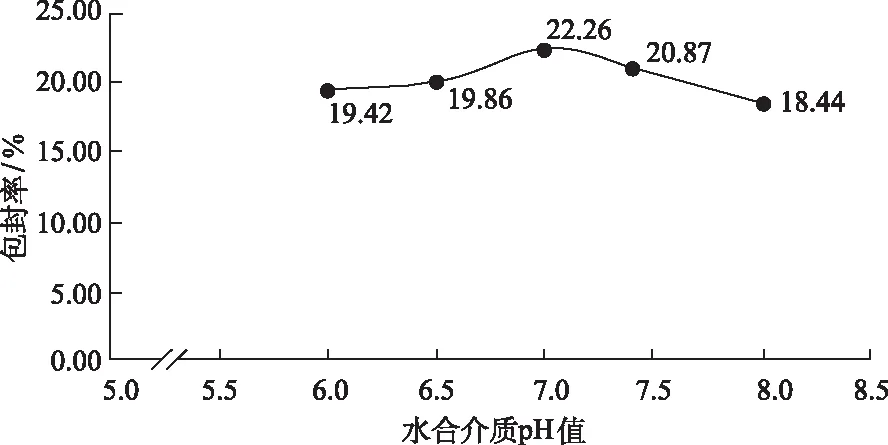
图3 水合介质pH值对脂质体包封率的影响Fig.3 Effect of pH value of hydration medium on the encapsulation efficiency of the liposome
3.1.4水合介质用量对包封率的影响 按“2.1”项的方法制备虾青素脂质体,其他条件不变,考察水合介质用量分别为10,20,30,40,50 mL时对脂质体包封率的影响。结果显示,不同水合介质用量所得的脂质体包封率分别为7.12%,19.13%,18.10%,16.56%,15.10%,结果见图4。

图4 水合介质用量对脂质体包封率的影响Fig.4 Effect of the amount of hydration medium on the encapsulation efficiency of the liposome
3.1.5温度对包封率的影响 按“2.1”项方法制备虾青素脂质体,其他条件不变,考察水浴温度分别为45,50,55,60,65 ℃时对脂质体包封率的影响。结果显示,不同水合介质温度所得的脂质体包封率分别为15.62%,19.76%,22.46%,22.37%,15.58%,结果见图5。

图5 温度对脂质体包封率的影响Fig.5 Effect of temperature on the encapsulation efficiency of the liposome
3.2正交实验 根据单因素实验结果,选择脂药比(A)、磷脂与胆固醇的质量比(B)、水合介质pH值(C)、温度(D)4个因素,各选取3个水平进行L9(34)正交设计实验,结果见表1~3。

表1 正交实验因素水平Tab.1 Levels and factors of orthogonal test
由表2直观分析与表3方差分析可知,极差R的大小顺序为:D(温度)>B(磷脂与胆固醇的质量比)>C(水合介质pH值)>A(脂药比),由于因素A的极差与离差平方和最小,作为误差项,经过方差分析,因素A(脂药比)、C(水合介质pH值)、D(温度)对实验结果影响差异无统计学意义(P>0.05)。综合直观分析和方差分析结果,确定虾青素脂质体制备处方与工艺为A2B1C2D3,即脂药比40:1,磷脂与胆固醇的质量比20:1,水合介质pH值为7.0,温度为60 ℃。
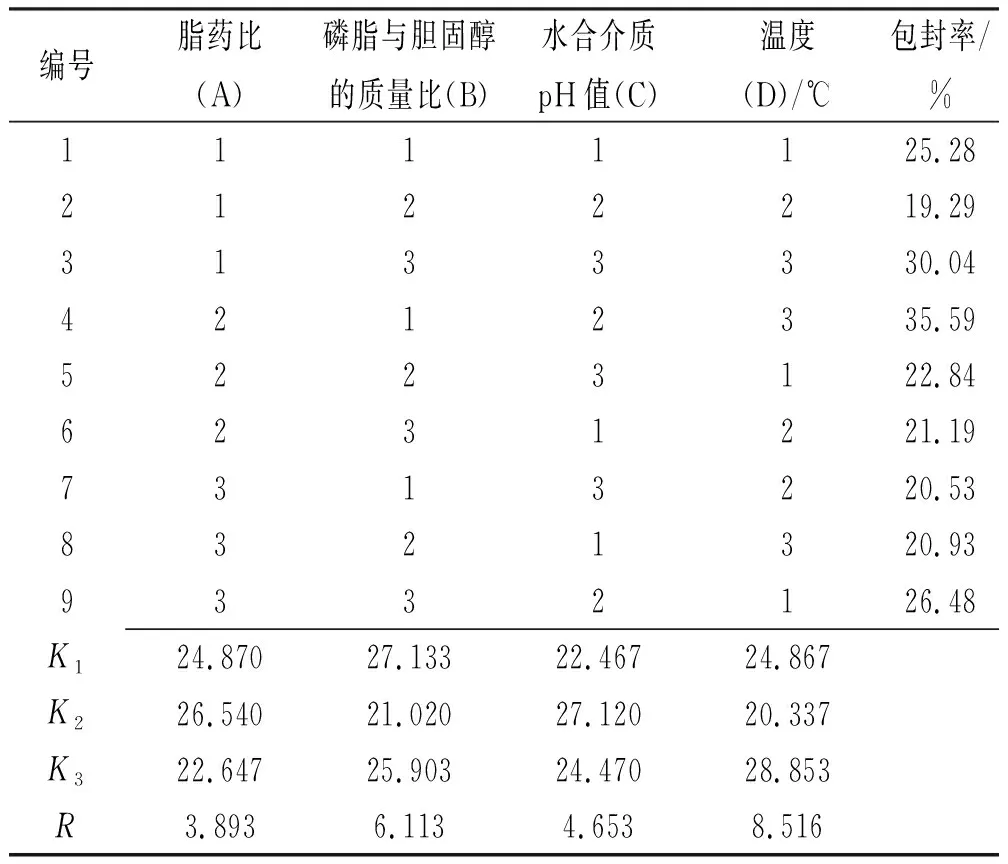
表2 正交实验设计及结果Tab.2 Design and results of orthogonal test

表3 正交实验方差分析 Tab.3 Variance analysis of orthogonal test
3.3最佳工艺验证 精密称量磷脂 80 mg、胆固醇4 mg、虾青素2 mg,溶入10 mL乙醇中,用注射器匀速缓慢注入0.01 mol·mL-1磷酸盐缓冲液20 mL中,60 ℃恒温水浴加热,搅拌至乙醇完全蒸发,超声10 min,用孔径0.45 μm 微孔滤膜过滤,即得橙红色澄清透明的虾青素脂质体液体,重复制备5批次,并测定脂质体批次包封率分别为33.68%,35.62%,35.74%,34.96%,36.42%,平均包封率为(35.28±0.93)%。
3.4最优处方虾青素脂质体的表征检测
3.3.1形态观察 按最优处方制备虾青素脂质体在1 μm的标尺下可观察到许多类球形的物质,分布均匀,结果见图6;放大到200 nm的标尺,可清晰观察到脂质体的形态,外层包裹内层,结果见图7。

图6 虾青素脂质体透射电镜图(标尺:1 μm)Fig.6 Transmission electron microscope image of astaxanthin liposome(Scale:1 μm)
3.3.2粒径检测 按最优处方与工艺制备虾青素脂质体的平均粒径为143.2 nm,PDI值为0.199,粒径大小分布呈正态分布,见图8。

图8 虾青素脂质体的粒径分布Fig.8 Particle size distribution of of astaxanthin liposome
4 讨论
虾青素的化学名称为3,3'-二羟基-4,4-二酮基-β,β'-胡萝卜素,由位于两侧的羟基和羰基取代的紫罗兰酮环和中间多聚烯链组成,具有多个共轭双键的萜烯基团化合物,对光、氧、温度等因素极易敏感,容易发生全反式虾青素向9-顺式或13-顺式异构体反应与环氧化、羟基化化学降解反应而出现褪色、生物活性降低、甚至失去生物活性等[15]。此外,虾青素不溶于水,也影响其生物利用度。为了提高稳定性、改善溶解性、提高生物利用度,已有研究将虾青素制成脂溶性制剂、包合物、微囊、纳米制剂等[16]。
脂质体是一种将药物包封于类脂质双分子层内而形成的微型泡囊体。药物被包裹后,与外界氧、光隔离,可增加药物的稳定性,同时,药物制成脂质体后,脂质体的粒径较小,特别是粒径小于100 nm的纳米脂质体,易分散在水中,对药物起到增溶效果。因此,将虾青素制成脂质体,在稳定性、溶解度和生物利用度方面会有效改善。脂质体的制备方法主要有乙醇注入法、反向蒸发法、薄膜分散法、超声分散法、冷冻干燥法、超临界二氧化碳法、微乳法、薄膜挤压-硫酸铵梯度法、薄膜分散-机械振荡法等[17],其中乙醇注入法操作简便,不使用毒性较大的有机试剂,可用于工业化生产。本实验研究采用乙醇注入法制备的虾青素制成脂质体平均粒径为143.2 nm,虽大于100 nm,但在水中也是易均匀分散,同时通过稳定性实验,虾青素制成脂质体后在50 ℃水浴加热3 h的降解率为3.36%,比游离虾青素在50 ℃水浴加热3 h的降解率33.82%提高近10倍,本实验研究制备的虾青素脂质体包封率仅约为35.28%,还有很大提升空间。下一步可继续研究,将虾青素脂质体制成冻干制剂,解决液态脂质体易发生聚集、融合、磷脂氧化,最终导致包裹的药物泄露的稳定性差问题[18],增加虾青素脂质体的稳定性,结合超声制备出粒径更小、包封率更大的虾青素脂质体,推动其市场应用。
